百奥动物药理药效部病理平台可提供不同组织部位及多种靶点的HE、IHC染色技术,助力不同种属、不同疾病模型的组织病理学分析。下边将为大家介绍HE及IHC切片质量检查要点。
HE切片质量检查
苏木精(Hematoxylin)-伊红(Eosin)染色,简称HE染色,是应用最广泛的组织病理学常规染色技术。染色结果细胞核呈蓝色,细胞质、肌纤维、胶原纤维和红细胞呈不同程度的红色,钙盐和细菌可呈蓝色或紫蓝色。
HE染色应着色鲜艳,红、蓝分明,对比清晰。制片完成后实验人员应将切片与相应的病理制片记录单认真核对,确认无误后在镜下进行切片质量检查,检查要点如表1:

HE染色:A为小鼠肝组织,可见肝实质和门管区▲小叶间静脉、★小叶间胆管、→小叶间动脉。B为小鼠肌肉组织,可见明显炎细胞浸润及钙化灶(→所示蓝紫色钙化灶)。
表1. 常规石蜡包埋-HE染色切片质量的基本标准
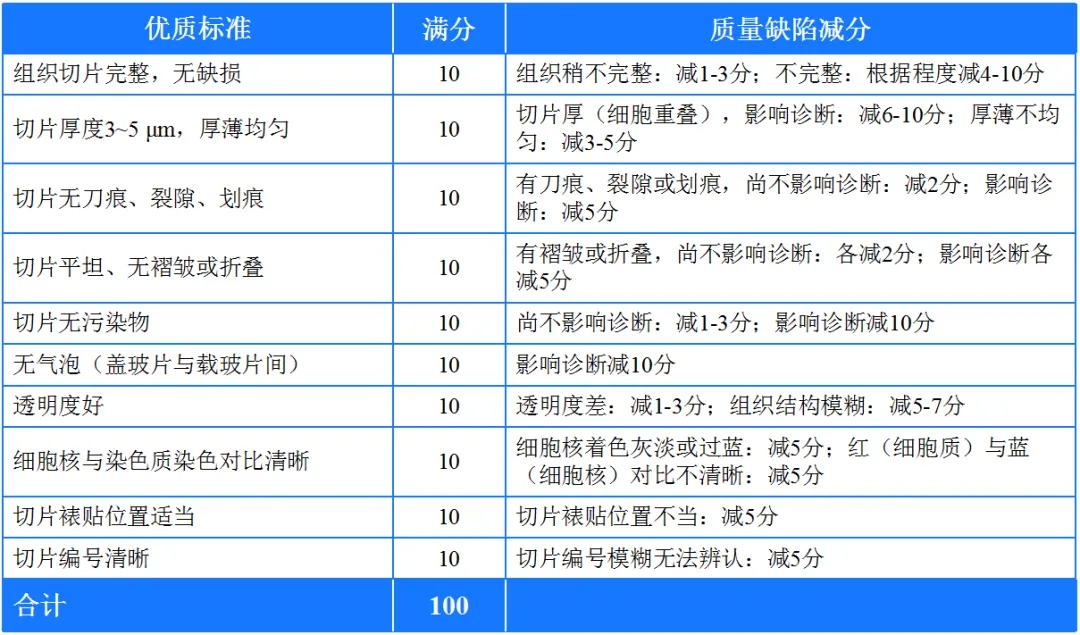
注:切片质量分级标准:①甲级:≥90分(优);②乙级片:≥75~89分(良);③丙级:60~74分(基本合格);④丁级:≤59分(不合格)[1]
IHC切片质量检查
免疫组织化学(Immunohistochemistry, IHC)根据标记物的不同,可分为不同的方法,例如免疫荧光组织化学方法、免疫酶组织化学方法和免疫金组织化学技术等。不同的免疫组织化学技术各具有独特的试剂和方法,但其基本技术方法是相似的,都包括抗体和组织材料的准备、免疫组化染色前的处理、免疫染色、显色剂的选择、染色对照的设计、结果的观察和分析等。
理想的IHC染色切片除了要满足基本的无刀痕、无褶皱、组织完整等要求,还应该满足结果特异性好、定位准确、阳性反应与阴性背景对比清晰、细胞结构显示良好等。然而由于免疫组化染色过程中涉及许多环节,多种因素可影响染色结果,最终可能出现非正常的假阴性或假阳性现象,干扰对染色结果的判断。

A.大鼠:T淋巴细胞绕中央动脉形成淋巴鞘,B淋巴细胞位于边缘区和淋巴小结;
B.大鼠:T淋巴细胞CD3免疫组化染色(蓝),B淋巴细胞CD20免疫组化染色(黄)。[2]
IHC染色后的切片质量控制聚焦在结果的判读,目前病理诊断中应用的IHC抗体种类繁多,对于不同的抗体,其IHC染色结果的判读标准可能存在差异,因此,判读IHC结果时首先应当掌握该指标的判读标准。

IHC染色:A为小鼠卵巢组织,细胞结构显示良好,核染清晰,可见位于透明带的棕褐色染色的ZP2阳性信号。B为小鼠脾脏,细胞结构显示良好,核染清晰,可见棕褐色染色的CD4+T淋巴细胞。
免疫组织化学结果的判断原则
1、必须设染色对照
每批染色都要以特异性的阳性对照和阴性对照为基础,才能对染色结果做出正确的判断。没有阳性对照,也就不能做出真正阴性结果的判断;同理,没有阴性对照,也就不能做出真正阳性结果的判断。因而,没有对照的免疫组化染色,即使做出了判断也是不可信的。
2、抗原表达必须在特定部位
阳性表达必须在细胞和组织特定的抗原部位才能视为阳性。如角蛋白(Keratin)在细胞质内,细胞核增殖抗原(PCNA)在胞核内,上皮细胞膜抗原(EMA)和白细胞共同抗原(LCA)在细胞膜上。不在抗原所在部位的阳性表达一概不能视为确切的阳性结果,而只能视作为阳性着色。难以确定或存在争议的阳性分布必须经由对照染色结果加以证实。
3、阴性结果不能视为抗原不表达
遇到阴性结果不能不加分析地武断认为具有否定意义。阳性表达有强弱、多少之分,哪怕是只有少数细胞阳性(但只要出现在抗原所在部位)也要视为阳性表达,不能认为个别细胞阳性而不作阳性看待。
4、尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达
特别是酶免疫标记检测,由于内源酶的干扰,出血坏死区常呈现弥漫性成片着色,属非抗原定位反应,判断时应加以除外。切痕和组织片周边界面也常常呈现非特异阳性着色,这是由于界面不平整,标记试剂残留干扰所致,也非真实抗原阳性标记。
5、对免疫组化标记结果的意义不能绝对化
当免疫组化诊断结果与HE切片诊断不一致时,应再结合临床资料、X射线等影像学及实验室结果综合分析,并复核免疫组化切片及HE切片,审慎判断观察结果,不宜用免疫组化检查结果简单否定HE切片病理组织学诊断。[3]
参考资料:
[1]:中华医学会,临床技术操作规范 病理学分册[M]. 北京:人民军医出版社,2015:6.
[2]:李宪堂,K. Nasir Khan, John E. Burkhardt, 实验动物功能性组织学图谱[M]. 北京:科学出版社,2019:93.
[3]:倪灿荣,马大烈,戴益民,免疫组织化学实验技术及应用【M】,北京,化学工业出版社,2006:128.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号