利用EGE™或ESC/HR基因编辑技术,百奥赛图可以对多种小鼠品系进行基因改造,包括C57BL/6、BALB/c、DBA2和NOD-scid等。基于CRISPR / Cas9的 EGE™技术和基于ESC技术的模型制备周期分别为6-8个月和9-12个月。小鼠生命周期短且与人类的遗传相似,通常作为哺乳动物模式生物的首选。同时,小鼠也是基因组学、转录组学、蛋白质组学和表型研究得最深入的哺乳动物模式生物。
品系
实验室小鼠品系有远交系或者近交系之分。近交系(又称自交系)是由于长期近亲交配而在基因型上几乎相同的特定物种的个体。一个近交品系至少要经过20代的兄妹或后代亲本交配,该品系个体中至少98.6%的位点是纯合的,并且每个个体都具备有效性。常见的近交系小鼠有C57BL/6,BALB/c,Fvb,A/J,C3H,CBA,DBA/2等。
应用示例
CD3e人源化小鼠模型的制备和验证
基因编辑策略:
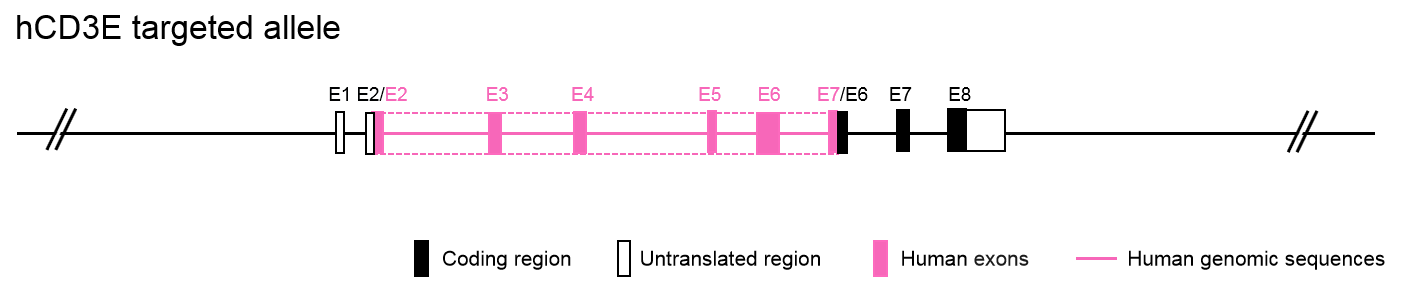
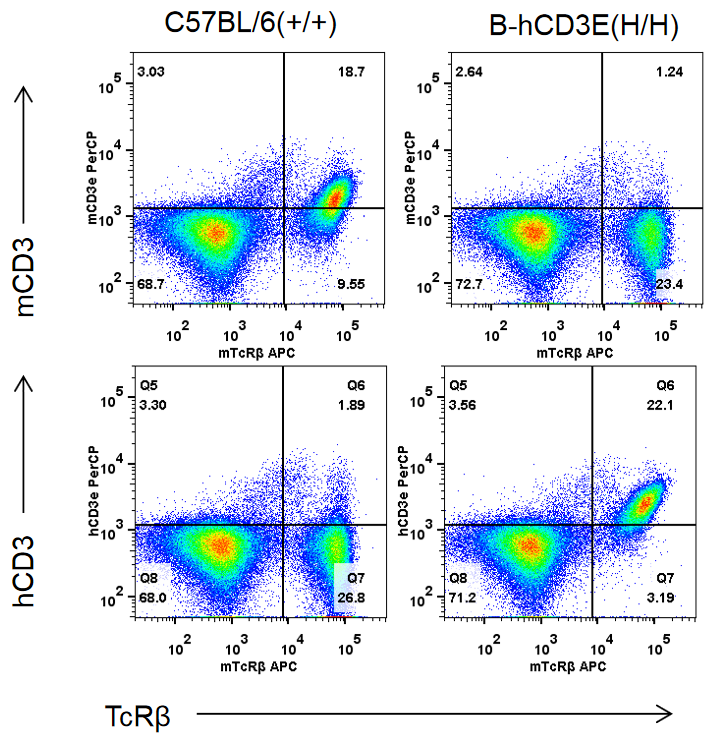
mRNA表达分析:

蛋白质表达分析
尽管小鼠是最常用的哺乳动物实验动物模型,但大鼠疾病模型相对于小鼠和其它生物体具有许多优势。
大鼠疾病模型的生理学不仅与人类更为相似,也相对容易监测。常见实验大鼠品系包括Sprague Dawley,Wistar。百奥赛图可以利用基于CRISPR/Cas9的EGE™技术来制备基因敲除和敲入大鼠。
应用示例
2014年百奥赛图开发了第一只报告基因大鼠
如下所示,利用EGE™技术将pCAG-loxP-3X STOP-loxP-tdTomato-WPRE-bGHpA读码框插入大鼠ROSA26安全位点。将cKI大鼠与Crh-Cre大鼠交配后,tdTomato在Crh-Cre/tdTomato后代的海马体中高表达。
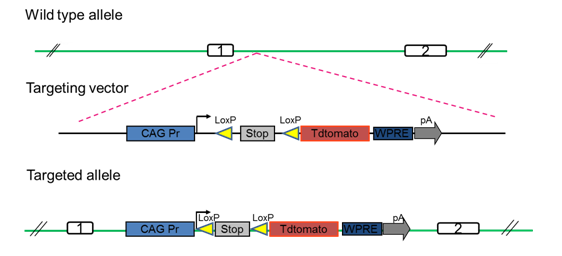
打靶策略
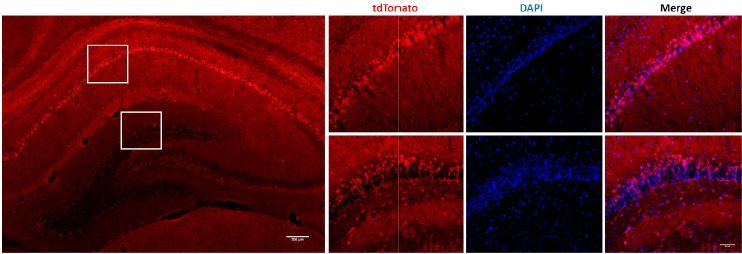
TdTomato大鼠与大脑特异表达Cre大鼠交配后子代的组织荧光实验
虽然基因编辑动物模型是生物医学研究的有力工具,但是细胞系也具有许多优势,包括使用便捷、实验成本低、适用于高通量筛选,等。百奥赛图细胞系基因编辑服务包括可行性评估,方案设计,细胞转染,单细胞克隆,基因型鉴定,以及所需的表型验证分析。
应用示例
示例1
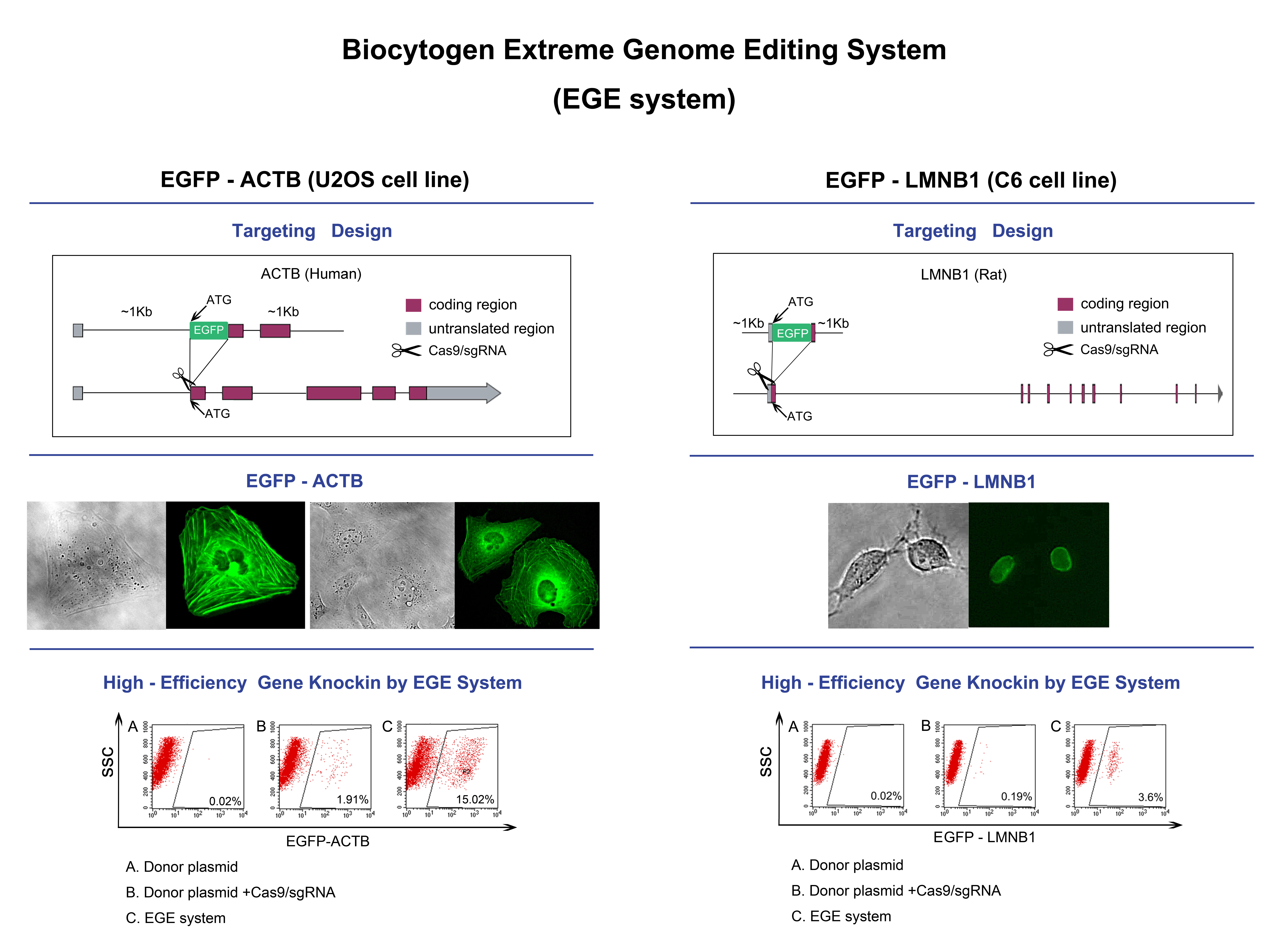
百奥赛图在人骨肉瘤U2OS细胞株的ACTB(细胞骨架丝状蛋白)基因编码框翻译起始处插入EGFP,建立了敲入细胞系模型。
ACTB基因编码β-ACTIN蛋白,一种细胞骨架蛋白。打靶载体的同源臂约为1 kb,分别利用CRISPR/Cas9技术和EGE™技术介导打靶载体的同源重组。
LMNB1编码核蛋白Lamin-B1,使用了类似的基因编辑策略。
利用流式细胞术分析重组效率发现,在U2OS细胞系中,CRISPR/Cas9介导的EGFP-ACTB基因敲进效率只有1.91%,而EGE™可以达到15.02%,提高了约8倍。在C6细胞系中,EGE技术将EGFP-LMNB1的敲进效率从0.19%提升至3.6%,提高了约19倍。
示例2
hESC和iPSC的基因编辑
高效的EGE™系统是诱导多能干细胞(iPSCs)和人胚胎干细胞(hESCs)基因组编辑的理想选择。
通过非整合质粒从人成纤维细胞诱导重编程为多种iPSC细胞。图A显示相位对比度图像。如图B所示,该iPSC细胞系表达多能性标记物OCT4,SSEA-4和TRA-1-60,并具有正常的核型(图C)。 可以在免疫缺陷小鼠中形成畸胎瘤(图D)。
 苏公网安备:32068402320845号
网站建设:北京分形科技
苏公网安备:32068402320845号
网站建设:北京分形科技






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn