贫血是指红细胞数量或红细胞内血红蛋白浓度低于正常水平的血液性疾病,全世界约有三分之一人口受到贫血的影响,主要是在妇女和儿童中。贫血由多种因素引起,包括营养不良、遗传因素、感染、慢性疾病和炎症等,地中海贫血、镰状细胞病、缺铁性贫血、再生障碍性贫血、慢性病或癌症引起的贫血都是新药研究的热点疾病领域。
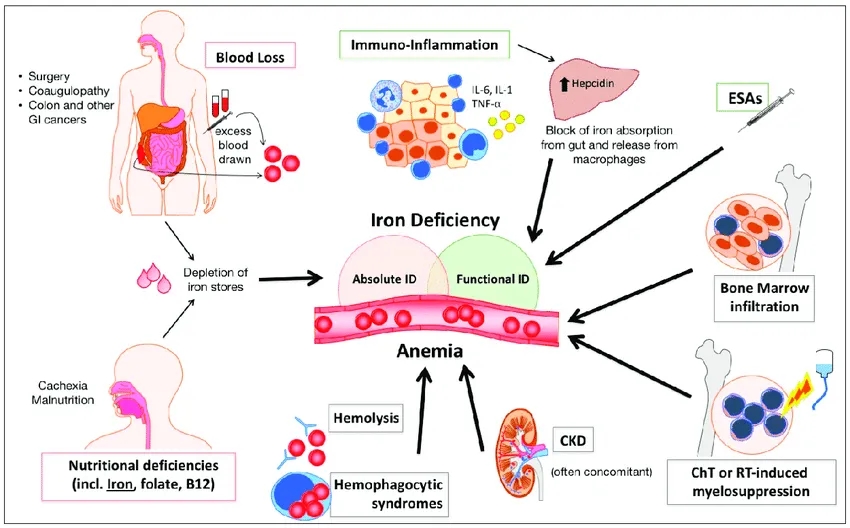
图1. 贫血机制示意图[1]
贫血疾病及新药研究进展
健康的成年人每秒钟大约会产生200万个红细胞(RBC),这一过程由多潜能造血干细胞和祖细胞(HSPCs)通过造血稳态调控的复杂机制完成。当稳态机制失调时,就会出现贫血,这通常是由影响红细胞的三个基本问题引起的:红细胞生产减少、红细胞破坏增加(溶血)或红细胞丢失(出血)。成人的血红蛋白是一种异四聚体,由α-珠蛋白和β-珠蛋白两个亚基组成[2]。
镰状细胞病
镰状细胞病(Sickle Cell Disease, SCD)是一种血红蛋白遗传缺陷疾病,由β-珠蛋白基因(HBB基因)的第六位氨基酸突变引起,导致患者的大部分血红细胞呈镰刀状,易于破裂且无法通过毛细血管,引发慢性贫血[2]。全球共6款治疗药物获批上市,其中包括诺华开发的SELP(P-选择素)抗体Adakveo,通过减少血小板聚集和炎症反应改善贫血症状,但由于未能在三期临床试验中降低VOC发生率而被欧洲EMA撤市。基因疗法成为新的治疗希望,其中已有两款基因疗法获批上市:蓝鸟生物开发的Lyfgenia,2023年12月8日获FDA批准上市;Vertex和CRISPR联合开发的Casgevy,靶向BCL11A基因,降低BCL11A表达导致HbF水平升高,2023年11月16日在英国获批上市;国内邦耀生物和正序生物的基因疗法均在临床试验阶段。
地中海贫血
地中海贫血(Thalassemia)由α-珠蛋白和β-珠蛋白基因突变和缺失使蛋白生成缺陷造成,临床上分为α-地贫和β-地贫,根据是否需要定期输血分为输血依赖型(TDT)和非输血依赖型(NTDT)。Zynteglo是蓝鸟生物开发的首个获批治疗输血依赖性β-地中海贫血的基因疗法,2024年1月Casgevy药物也在英国获批治疗TDT。地中海贫血患者骨髓的红系前体细胞高表达TFR1,降低TFR1表达可有效改善贫血症状 [3] 。
再生障碍性贫血
再生障碍性贫血(Aplastic Anemia, AA)是一种由多种病因造成的骨髓造血衰竭综合征,免疫抑制治疗和造血干细胞移植是主要治疗手段之一,血小板生成素受体激动剂TPO-RA已经成为重要的二线治疗药物。2024年ASH大会中,多项TPO-RA与免疫抑制治疗药物的联用临床结果公布,成为研究热点。海曲泊帕是恒瑞医药开发的中国首个自主开发的口服非肽类小分子TPO-RA药物,与抗胸腺细胞球蛋白(ATG)和环孢素(CsA)联合治疗重型SAA的III期临床研究显示完全缓解率CR显著升高(28.1% vs 13.8%)。
慢性病性贫血
慢性病性贫血或炎症性贫血(Anemia of chronic disease, ACD)是一种中度贫血,通常见于具有临床相关病理状况的患者,例如癌症、慢性感染、自身免疫性疾病、慢性肾病(CKD),以及一般所有以持续大量产生促炎性细胞因子为特征的疾病。
红细胞生成素(EPO)与造血前体上的EPO受体(EPOR)结合,会启动一系列促进红系分化、存活和增殖的信号事件。细胞因子如IL-1β、γ-干扰素和 TNF-α 等对红细胞生成有负面影响:它们会降低红EPO的产生、红细胞上的EPOR表达以及总体EPO反应性;此外,它们还会诱导铁代谢的改变,以将铁从循环中隔离出来 [4] 。
肾脏是EPO的主要生理来源。因此,CKD与EPO缺乏有关,导致因红细胞生成减少而引起的贫血。此外,铁调素过量也是导致CKD贫血的主要因素。红细胞生成刺激剂 (ESA)和辅助铁剂疗法是治疗CKD贫血的主要手段,但仍需要更安全的药物,Akebia Therapeutics开发的缺氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)vadadustat在2024年3月获FDA批准上市,治疗至少接受3个月透析的慢性肾病(CKD)贫血患者。
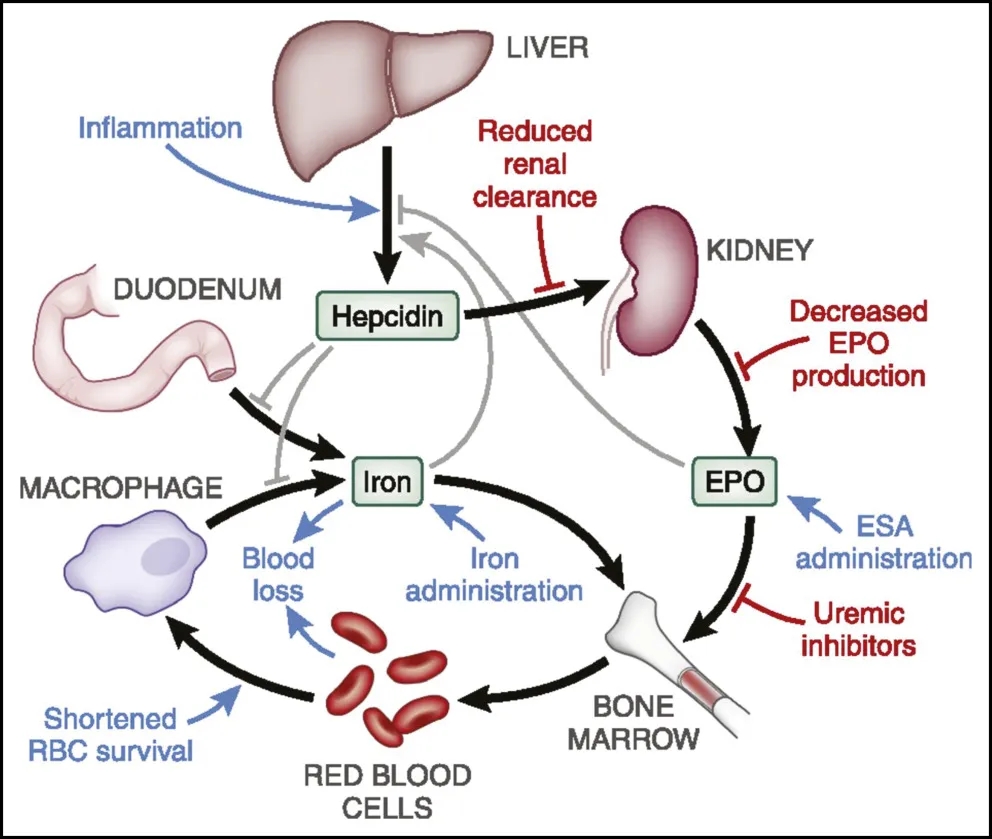
图2.CKD 贫血潜在机制的示意图[3]
贫血相关疾病小鼠模型
百奥动物开发了系列贫血相关疾病基因编辑小鼠及靶点人源化小鼠模型,助力新型疗法开发。
针对基因缺失或突变
β-珠蛋白由HBB基因编码,β-地中海贫血患者的HBB基因发生突变。我们同时敲除小鼠的Hbb-bt和Hbb-bs基因可构建了β-地中海贫血模型,用于地贫药物的药效评价。
产品名称:B-Hbb-bt KO, Hbb-bs KO mice 产品编号:113046
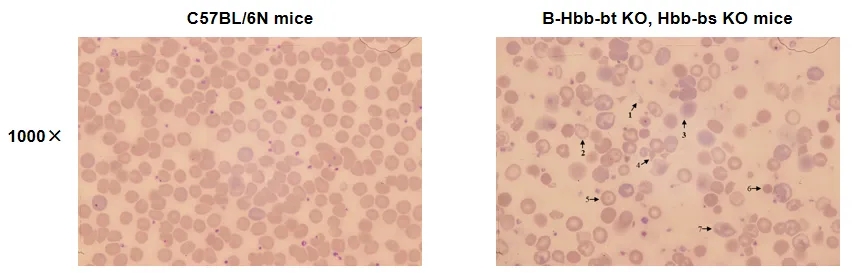
在野生型C57BL/6N小鼠和杂合B-Hbb-bt KO、Hbb-bs KO小鼠(H/+)中进行血涂片分析。
血涂片分析结果显示,杂合B-Hbb-bt KO、Hbb-bs KO小鼠(H/+)的红细胞大小不一致,中央苍白区增大。此外,血涂片中还显著出现了异常的碎裂红细胞和有核红细胞,包括裂形红细胞(1)、锯齿状红细胞(2)、影像红细胞或裂形红细胞(3)、刺状红细胞或刺细胞(4)、靶状红细胞(5)、球形红细胞(6)和口形红细胞(7)。
在正常骨髓中,c-Kit由造血干细胞表达,在自我更新和分化为各种血细胞中起着至关重要的作用。我们在B-NDG小鼠的Kit基因中引入了W41点突变,可用于造血干细胞移植及地中海贫血研究。
产品名称:B-NDG Kit W41 mice 产品编号:112914

通过RT-PCR在B-NDG小鼠和B-NDG Kit W41小鼠中进行种属特异性Kit mRNA表达分析。
分别从B-NDG小鼠(+/+)和杂合B-NDG Kit W41小鼠(Mut/+)中分离脾脏和肺组织的RNA,通过逆转录合成cDNA文库,再使用小鼠Kit引物进行PCR扩增。在B-NDG小鼠(+/+)和B-NDG Kit W41小鼠(Mut/+)中均能检测到小鼠Kit mRNA的表达。序列分析显示,B-NDG Kit W41小鼠(Mut/+)在第831位氨基酸处存在G到A的点突变。
针对细胞因子—CSF3、EPO
CSF3(集落刺激因子3),也被称为G-CSF,临床上主要用于治疗中性粒细胞减少症,与EPO联合使用可改善骨髓增生异常综合征引起的贫血症状。
产品名称:B-hCSF3 mice 产品编号:111899

通过ELISA在纯合B-hCSF3小鼠中进行种属特异性CSF3表达分析。
从野生型小鼠(+/+)和纯合B-hCSF3小鼠(H/H)中收集血清,使用种属特异性的CSF3 ELISA试剂盒进行分析。ELISA检测显示,野生型小鼠中可以检测到小鼠源的CSF3,而人源的CSF3仅能在纯合B-hCSF3小鼠中检测到,在野生型小鼠中未检测到。
EPO是红细胞生成的主要调控因子,通过调控肾脏中的EPO基因,提高其在贫血中的表达和分泌,可以有效促进红细胞生成。
产品名称:B-hEPO mice 产品编号:112458
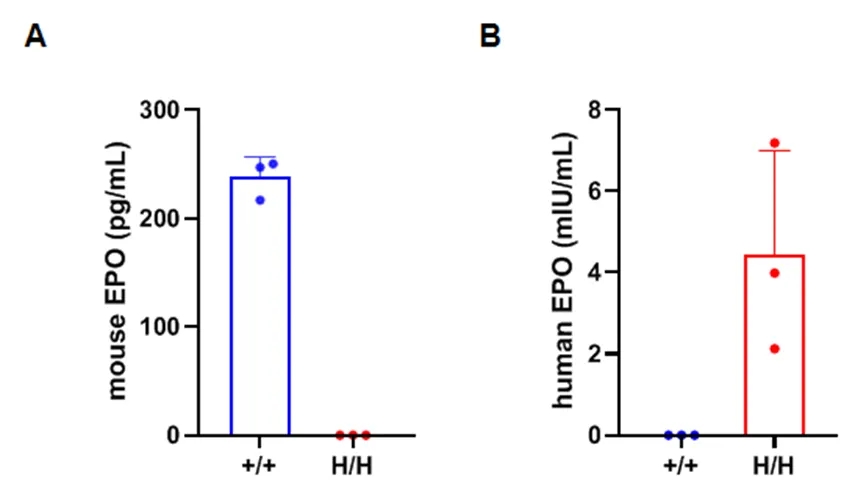
通过ELISA在纯合B-hEPO小鼠中进行种属特异性EPO表达分析。
从野生型C57BL/6小鼠(+/+)和纯合B-hEPO小鼠(H/H)中分离血清,使用种属特异性的EPO ELISA试剂盒进行分析。ELISA检测显示,野生型小鼠中可以检测到小鼠源的EPO(A);人源EPO仅能在纯合B-hEPO小鼠中检测到,在野生型小鼠中未检测到(B)。* 1 ng/mL = 21.2 miu/L
针对免疫调节—SELP、CD163
SELP是一种细胞粘附分子,广泛存在于血小板和内皮细胞中,主要调节血小板与白细胞的黏附及炎症反应。SELP抑制剂为SCD治疗提供新的方向。
产品名称:B-hSELP mice 产品编号:110836
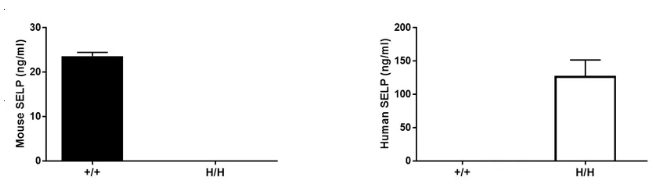
通过ELISA检测纯合B-hSELP小鼠中种属特异性SELP表达分析。
从野生型C57BL/6小鼠(+/+)和纯合B-hSELP小鼠(H/H)中采集血清,使用种属特异性的SELP ELISA试剂盒进行分析。ELISA检测显示,野生型小鼠的血清中可以检测到鼠源SELP,而人源SELP仅能在纯合B-hSELP小鼠中检测到,在野生型小鼠中未检测到。
CD163是M2型巨噬细胞表达的清道夫受体,富含半胱氨酸,主要负责结合并清除珠蛋白-血红蛋白复合物,在溶血性贫血及ACD中具有重要作用。
产品名称:B-hCD163 mice 产品编号:111298
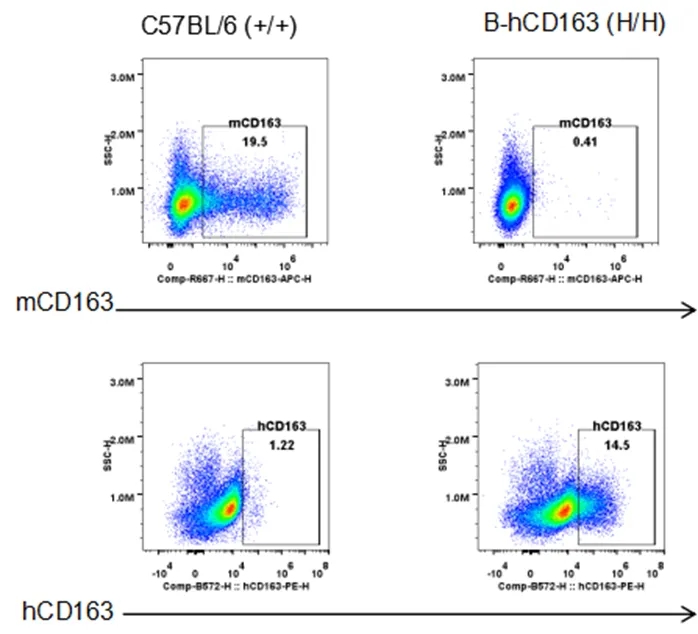
通过流式细胞术在纯合B-hCD163小鼠中进行种属特异性CD163表达分析。
从野生型C57BL/6小鼠(+/+)和纯合B-hCD163小鼠(H/H)中收集腹腔巨噬细胞(PEMs),使用种属特异性的抗CD163抗体通过流式细胞术进行分析。流式细胞术检测显示,野生型小鼠中可以检测到鼠源CD163,而人源CD163仅在纯合B-hCD163小鼠中检测到,在野生型小鼠中未检测到。
针对铁代谢—HAMP、BMP9
HAMP编码肝脏铁调素(Hepcidin),是铁代谢的关键调节因子,通过调控铁输出蛋白的降解,阻止巨噬细胞和肠细胞释放铁。铁调素过量与炎症性贫血、慢性病性贫血和缺铁性贫血有关。BMP9(骨形态发生蛋白9)是TGF-β家族成员,又称生长分化因子 2 (GDF2),通过与红细胞祖细胞表面的内皮糖蛋白相互作用对红细胞分化产生抑制作用。针对HAMP和BMP9抑制剂的开发可能会对贫血疾病的治疗带来新的希望。
产品名称:B-hHAMP mice 产品编号:111019
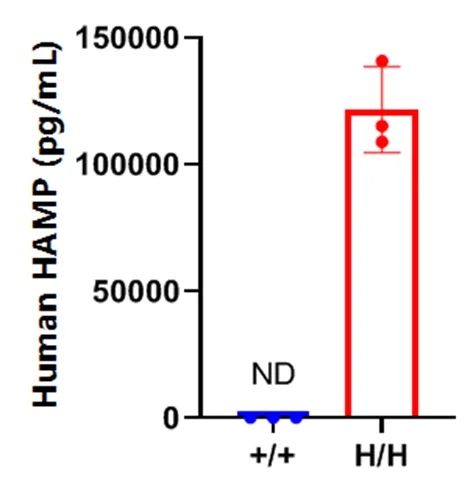
通过ELISA在纯合B-hHAMP小鼠中进行种属特异性HAMP表达分析。
从野生型C57BL/6小鼠(+/+)和纯合B-hHAMP小鼠(H/H)中分离血清,使用种属特异性的HAMP ELISA试剂盒进行分析。人源HAMP仅能在纯合B-hHAMP小鼠中检测到,而在野生型小鼠中未检测到。
产品名称:B-hBMP9 mice 产品编号:112354
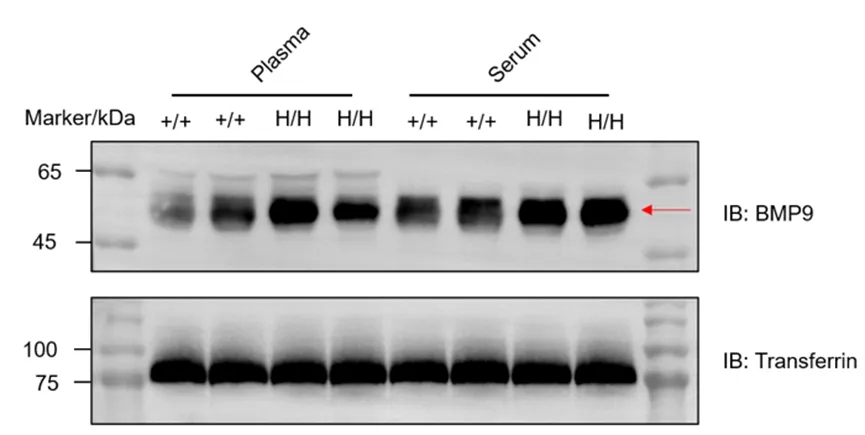
通过Western blot分析在纯合B-hBMP9小鼠中的BMP9蛋白表达。
从野生型C57BL/6N小鼠(+/+)和纯合B-hBMP9小鼠(H/H)中收集血浆和血清(雄性,7周龄,n=2),然后使用抗BMP9抗体进行Western blot分析。每个样本加载了20 μg总蛋白进行分析。所使用的抗体能够交叉识别鼠源和人源BMP9。
除贫血外,百奥动物还开发了更多血液疾病相关动物模型.
参考资料
[1]Busti, F., Marchi, G., Ugolini, S., Castagna, A., & Girelli, D. (2018). Anemia and iron deficiency in cancer patients: Role of iron replacement therapy. Pharmaceuticals (Basel), 11(4), 94.
[2]Sankaran, V., Weiss, M. Anemia: progress in molecular mechanisms and therapies. Nat Med 21, 221–230 (2015).
[3]Shander, A., et al. (2020). Iron metabolism and management: Focus on transferrin receptor 1. Journal of Clinical Medicine, 9(3), 847.
[4]Camaschella, C. (2017). New insights into iron deficiency and iron deficiency anemia. Blood Reviews, 31(5), 316–330.
[5]Weiner, D. E., et.al. (2006). Mechanisms of anemia in chronic kidney disease. Kidney International, 69(3), 515–520.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号