定制模型的基因编辑策略包括:
全基因敲除
条件性基因敲除
基因敲进
条件性基因敲进
Cre(ERT2)敲进
点突变
ROSA26安全位点敲进
Tol2转基因
注:与ESC/HR技术相比,利用基于CRISPR/Cas9的EGETM技术构建的动物模型,通常不需要筛选标记。以下策略中,含有抗性标记的是基于传统的ESC/HR技术的设计方案,不含有抗性标记的是基于EGETM的设计图示。
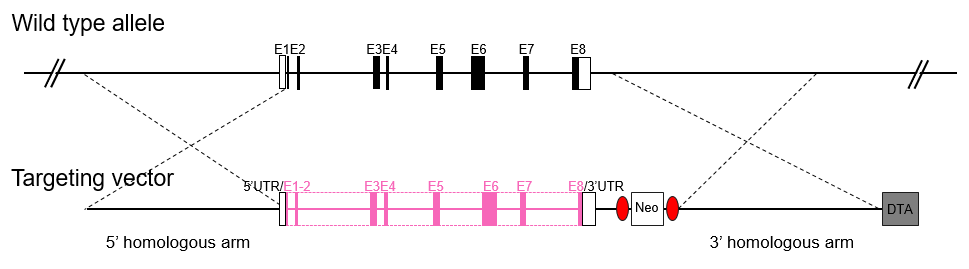
在全基因敲除(KO)小鼠模型中,靶基因的外显子被删除(EGE™方法)或用阳性筛选标记替换(ESC/HR),从而使基因失活。在全身的KO小鼠中,每一个组织中的目的基因都被敲除。
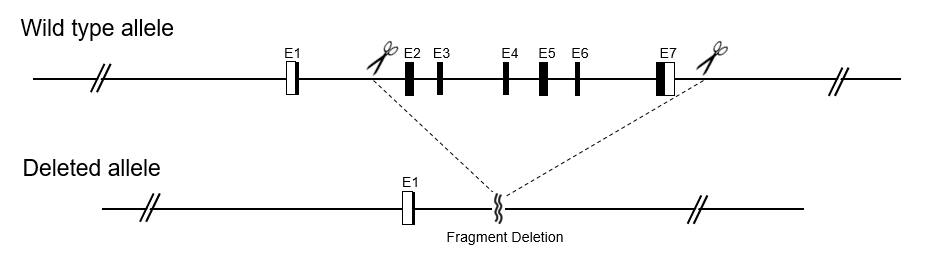
通过Cre-LoxP重组酶系统建立条件性敲除(cKO)模型,在敲除的目的片段两侧插入LoxP序列。将Flox小鼠和含有组织特异性的Cre鼠交配,LoxP位点之间的序列将以组织特异性方式从后代基因组中移除。DNA序列删除后通过移码突变达到基因敲除目的。
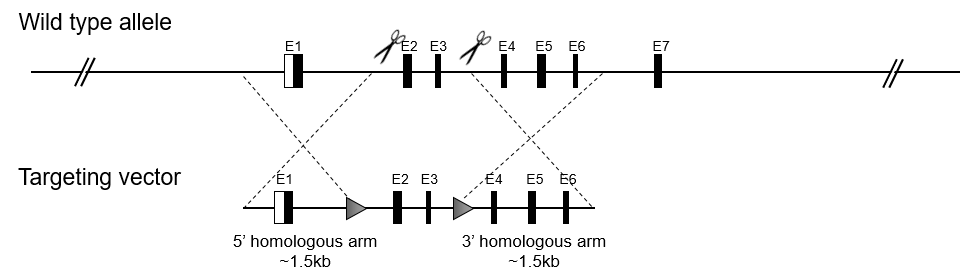
全基因敲进小鼠模型将外源DNA序列插入小鼠基因组中的特定位点。此模型可以在引入突变时模拟遗传性疾病,或者利用各种蛋白质(如EGFP、mRFP、mCherry、YFP、LacZ和Flag等)标记来监测基因表达。
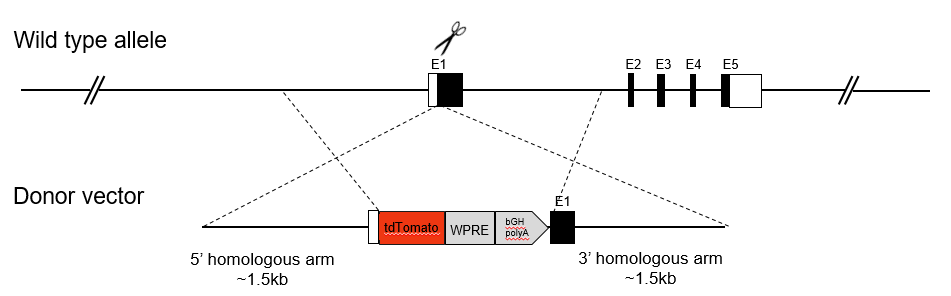
条件敲进小鼠模型含有flox(或条件)等位基因,与表达Cre的小鼠杂交,可以让外源基因在特异组织内表达。
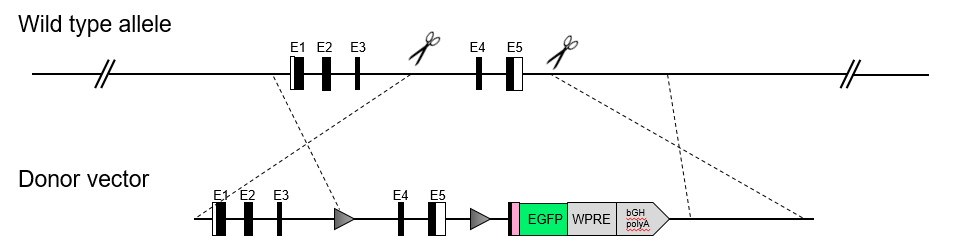
Cre重组酶介导LoxP位点之间DNA片段的组织特异性缺失。因此,利用驱动Cre表达的启动子,Cre小鼠模型可以实现组织特异性基因敲除。ERT2序列是雌激素受体靶向性基因,其核转运和活性受Tamoxifen控制。因此,Tamoxifen给药能够对Cre活性和基因缺失进行诱导发生和时间调控。
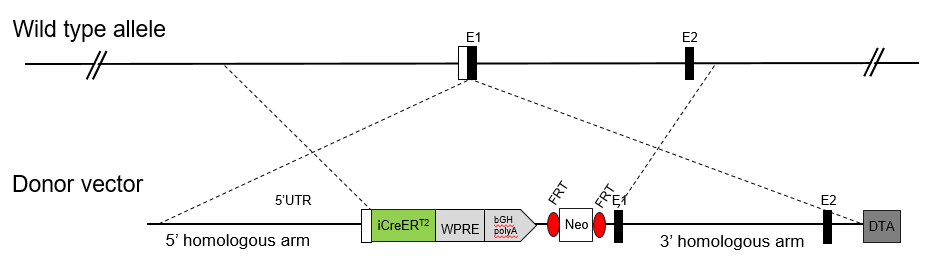
常规点突变
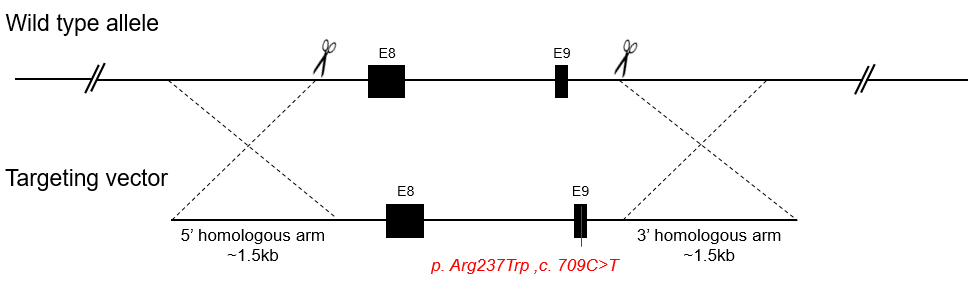
常规的点突变小鼠属于基因敲进模型,其中小鼠基因组中的一个或多个核苷酸被突变核苷酸替代,可能导致蛋白质氨基酸序列的变化。点突变小鼠模型广泛应用于蛋白质中特定核苷酸或氨基酸的作用,以及人类遗传疾病模型的研究。
条件性点突变
条件点突变小鼠模型可以满足在特定条件下引入点突变。在下面的设计策略中,当存在Cre重组酶时,点突变位点通过Cre活性特异地引入到小鼠特定组织的基因组中。下面有两个主要的设计策略:
双LoxP(Flex)条件点突变敲入
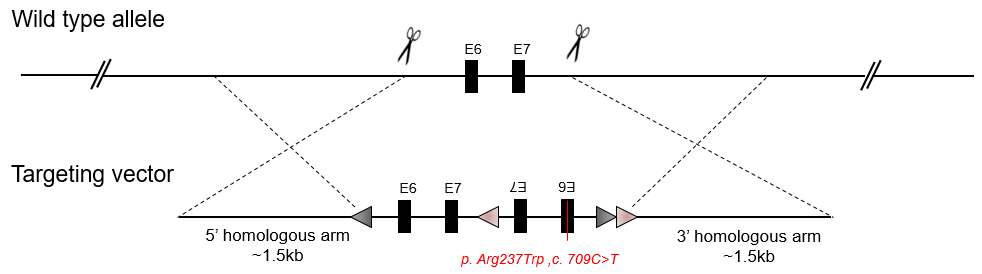
条件点突变敲入
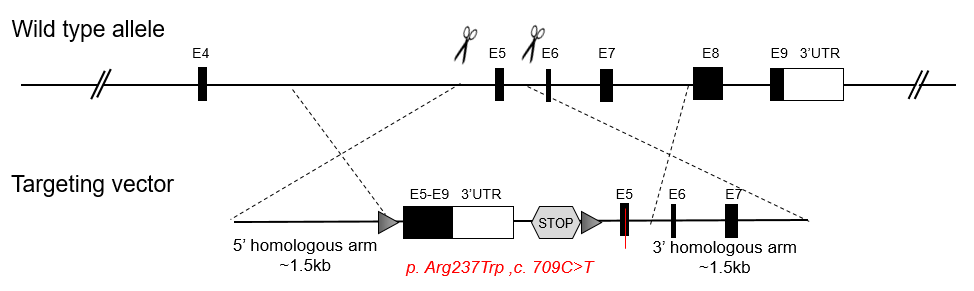
敲除鼠源基因,同时敲进人源基因,构建人源化小鼠模型,用来研究人疾病模型发病机制及治疗性研究。
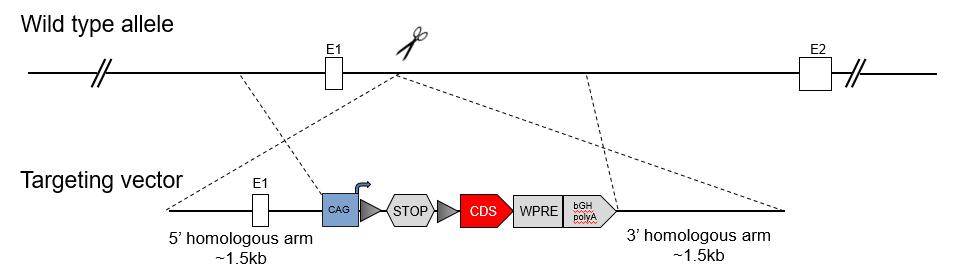
传统的转基因小鼠一般通过利用质粒进行受精卵原核注射的方式来制备,通常会得到多个品系(Founders)。不同品系由于质粒在染色体上的整合位点不同、拷贝数不同,不同品系之间不容易得到一致的结果。目前,大多数研究者利用位点特异性整合策略构建基因编辑小鼠模型。ROSA26是最常用的“安全位点”,它在几乎所有组织中编码表达非必需核RNA。将LoxP-STOP-LoxP序列插入ROSA26位点的外源序列上游,并与Cre小鼠杂交,将产生外源基因的条件性表达。还有一些其他的安全位点,如H11,TIGRE等。
ROSA26位点基因敲进模型
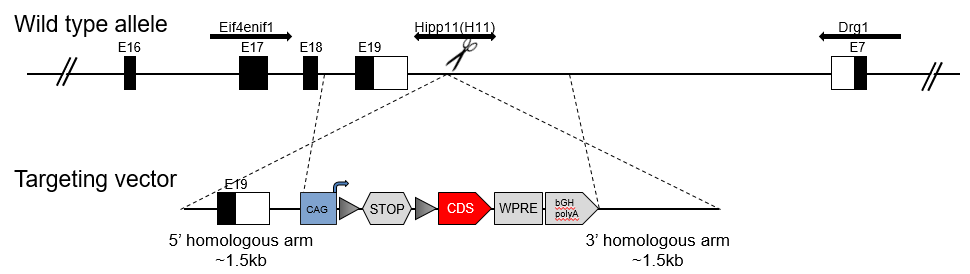
Hipp11位点基因敲进模型
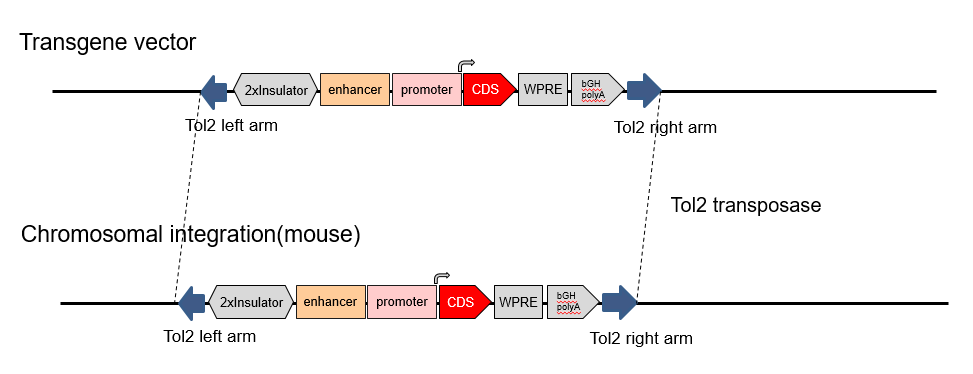
Tol2小鼠模型利用Tol2转座酶活性制备转基因小鼠。Tol2转座子系统不仅可以提高基因整合率,而且无位点特异性,无碱基倾向性。
 苏公网安备:32068402320845号
网站建设:北京分形科技
苏公网安备:32068402320845号
网站建设:北京分形科技






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn