11月20日(当地时间),Jazz Pharmaceuticals宣布,美国食品药品监督管理局(FDA)加速批准Ziihera®(zanidatamab-hrii) 50mg/mL静脉注射用药,用于治疗既往接受过治疗的、不可切除的或转移性HER2阳性(IHC 3+)胆道癌(BTC)成人患者。Ziihera是美国批准用于HER2+ BTC的第一种也是唯一一种靶向HER2的双特异性抗体。

(图片源自Jazz Pharmaceuticals网站)
Ziihera获得了加速批准,其依据是HERIZON-BTC-01临床试验的独立集中审核(ICR)确定的52%的客观缓解率和14.9个月的中位缓解持续时间。继续批准这一适应证可能取决于验证性试验中对临床获益的验证和描述。HERIZON-BTC-302 3期验证性试验正在进行中,以评估zanidatamab联合标准治疗与单独标准治疗在一线治疗HER2阳性BTC患者的效果。
Ziihera (zanidatamab-hrii)是一种靶向HER2的双特异性抗体,能够同时与HER2上两个不同表位结合。Zanidatamab-hrii与HER2的结合促进内化,导致肿瘤细胞表面受体减少。Zanidatamab-hrii可诱导补体依赖性细胞毒性(CDC)、抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。这些机制导致体内外肿瘤生长抑制和细胞死亡。
Zanidatamab由Jazz和百济神州根据首先开发该分子的Zymeworks公司的许可协议开发。
FDA曾批准zanidatamab在先前治疗过的HER2基因扩增BTC患者中的突破性治疗,以及zanidatamab的两个快速通道指定:作为难治性BTC的单一药物,以及与1L胃食管腺癌(GEA)的标准治疗化疗联合使用。
Zanidatamab也正在其他一些肿瘤类型中进行研究,包括在胃食管腺癌(GEAs)和转移性乳腺癌(mBC)中的3期试验。HERIZON-GEA-01 试验评估了zanidatamab+化疗(联用或不联用tislelizumab)作为晚期/转移性HER2阳性GEAs患者一线治疗的潜力。EmpowHER-303试验正在评估zanidatamab联合医师选择的化疗用于治疗既往曲妥珠单抗-deruxtecan治疗进展或不耐受的HER2阳性mBC患者的潜力。
百奥赛图自主开发了HER2相关靶点人源化鼠和细胞系,也可在同种移植模型和异种移植模型中提供HER2药效或毒性服务,助力相关药物临床前研究。
B-hHER2 mice
HER2表达的IHC分析

收集WT小鼠和纯合型B-hHER2小鼠(H/H)的乳腺、结肠和胃组织,用抗HER2抗体进行免疫组织化学分析。由于抗体的交叉反应性,WT小鼠和纯合B-hHER2小鼠均可检测到HER2。箭头表示HER2染色阳性的组织细胞(棕色)。
毒性试验
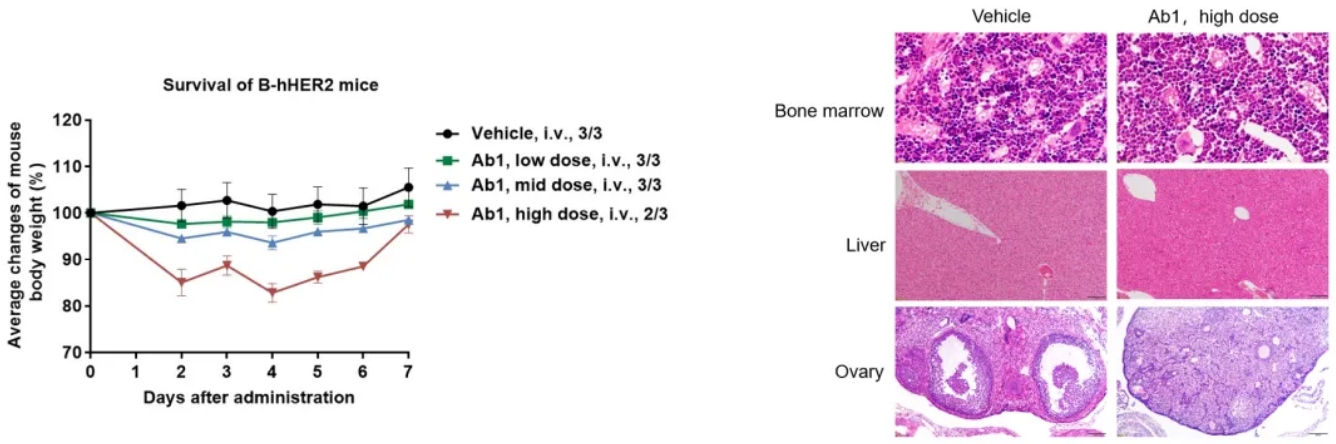
将不同剂量抗人HER2抗体Ab1单次静脉注射到B-hHER2小鼠体内。B-hHER2小鼠的体重呈剂量依赖性下降。高剂量组1只小鼠死亡。组织病理学检查:肝脏未见明显异常,卵巢未见未成熟卵泡,骨髓中髓系细胞增多,红细胞计数减少。这提示B-hHER2小鼠可用于评估抗人HER2抗体的毒性。数据来自合作伙伴。值表示为平均值±SEM。
B-hHER2 MC38 plus
抗人HER2 ADC DS8201药效
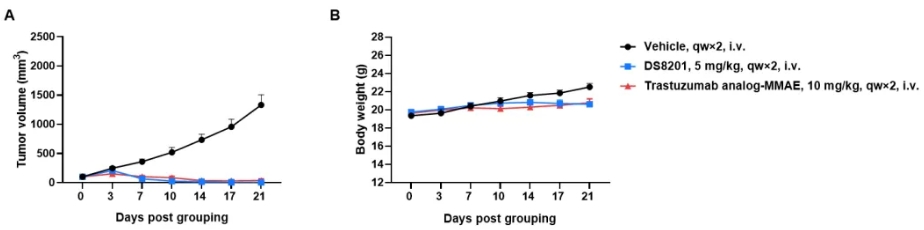
抗人HER2 ADC DS8201对B-h4-1BB/hHER2小鼠的抗肿瘤活性。(A)抗人HER2 ADC抑制B-hHER2 MC38 plus 在B-h4-1BB/hHER2小鼠上肿瘤生长。小鼠结肠癌B-hHER2 MC38 plus细胞皮下植入纯合B-h4-1BB/hHER2小鼠(雌性,9周龄,n=6)。当肿瘤体积达到约100 mm3时,将小鼠分组,此时静脉注射抗人HER2 ADC DS8201(购自阿斯利康/Daiichi Sankyo)或曲妥珠单抗类似物-MMAE(图中所示)。(B)治疗期间体重变化。如A图所示,两种抗人HER2 ADC均能有效控制B-h4-1BB/hHER2小鼠的肿瘤生长,说明B-hHER2 MC38 plus 为体内评价抗人HER2 ADC提供了强有力的临床前模型。数值以平均值±SEM表示。
CDX模型
HER2 ADC药物在CDX模型中药效

与A431细胞HER2表达水平降低相一致,A431细胞对HER2的抑制作用减弱。
PDX模型
HER2 ADC药物在PDX模型中药效

在HER2/TROP2高表达和低表达的PDX模型中,HER2 x TROP2 ADC均表现出明显的肿瘤生长抑制作用。
更多数据信息,欢迎联系我们。
参考资料:
[1]. Jazz Pharmaceuticals官网
[2]. 封图自 DOI https://doi.org/10. 1200/JCO.19.02488






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号