在日常生活中,偏头痛常常被人们提及好似在念“紧箍咒”,但却没有引起足够的重视,一般认为稍加休息忍一忍就过去了。但殊不知偏头痛早就被世界卫生组织列为全球致残性疾病之一,其危害性与老年性痴呆和严重精神疾病相当。
偏头痛简介
偏头痛是一种使人衰弱的复杂神经系统疾病,可引起反复发作的头痛和其他症状,如畏光、畏声、对气味或触觉敏感,以及恶心或呕吐等,严重影响个人的生活质量。偏头痛一词源于希腊语(Hemicrania),意思是“头部的一半”,这是该疾病的一个显著特征,即大多数人的一侧头部会感到疼痛。研究偏头痛的潜在原因已有报道,可能涉及遗传、环境和生活方式。诱发因素因人而异,包括压力、激素变化、饮食和睡眠障碍等。识别和管理诱因对于预防偏头痛发作并降低其发生频率、持续时间和严重程度至关重要。
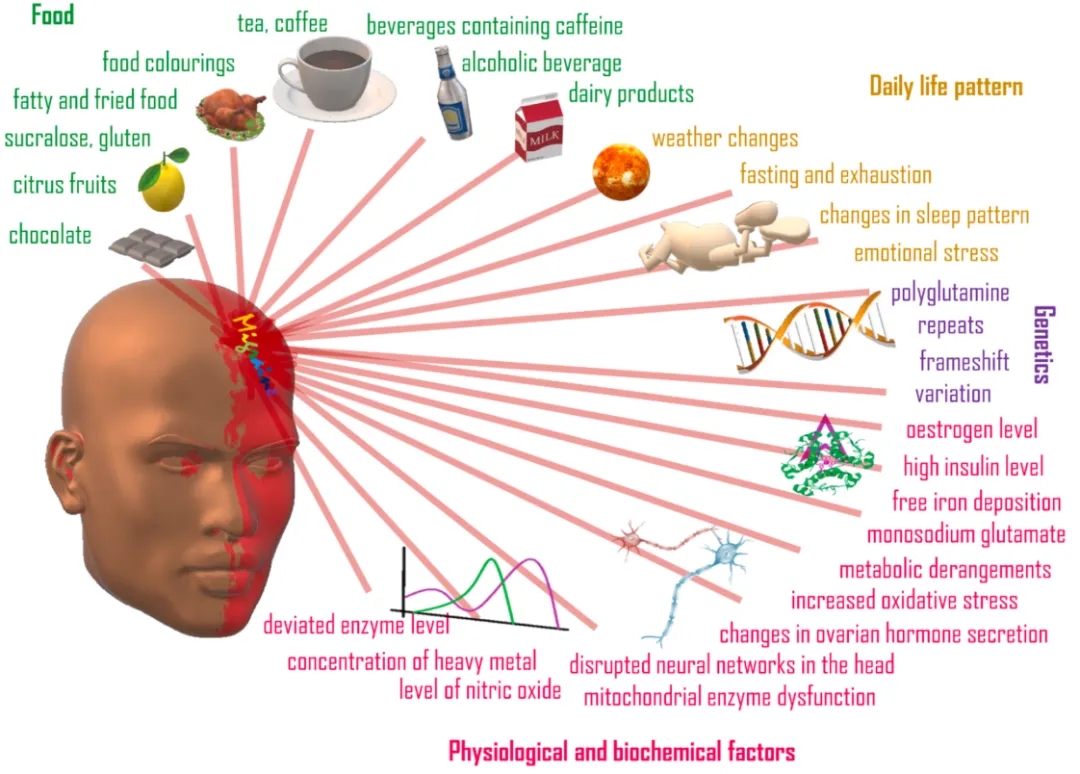
图1. 触发偏头痛的因素[1]
偏头痛发病机制
偏头痛可分为四个阶段:发作前征兆期(Premonitory)、先兆期(Aura)并非所有患者都有、头痛期(Headache)和后期(Postdromal)。各阶段可以依次发生,也可重叠出现。虽然偏头痛的确切病理生理机制仍不清楚,但皮质(下)兴奋性增加、三叉神经血管激活和神经肽降钙素基因相关肽(Calcitonin Gene-Related Peptide, CGRP,降钙素家族的成员)的释放已被证实在偏头痛的发病机制中发挥着关键作用。神经元机制(例如皮层扩散性抑制和血管周围感觉神经末梢的敏化)和结构(例如下丘脑和脑干)的参与对偏头痛的发作至关重要。
由于征兆期症状先于头痛期,为了探索真正的偏头痛触发因素,这一阶段已被广泛研究。基于目前对征兆期的理解,偏头痛最有可能的调节/启动者是下丘脑。Schulte 和May[2]的研究中发现下丘脑在偏头痛发作前的最后24小时更加活跃。这种活跃的下丘脑进一步与脑干耦合,并向下延伸至三叉神经脊束核(Trigeminal Nucleus Caudalis, TNC)。TNC的激活可促进三叉神经血管疼痛传递的神经元活性增加和CGRP的释放。如图2,科学家整合了临床前和临床研究的最新进展,为偏头痛的病理生理学机制提供了可能的解释。
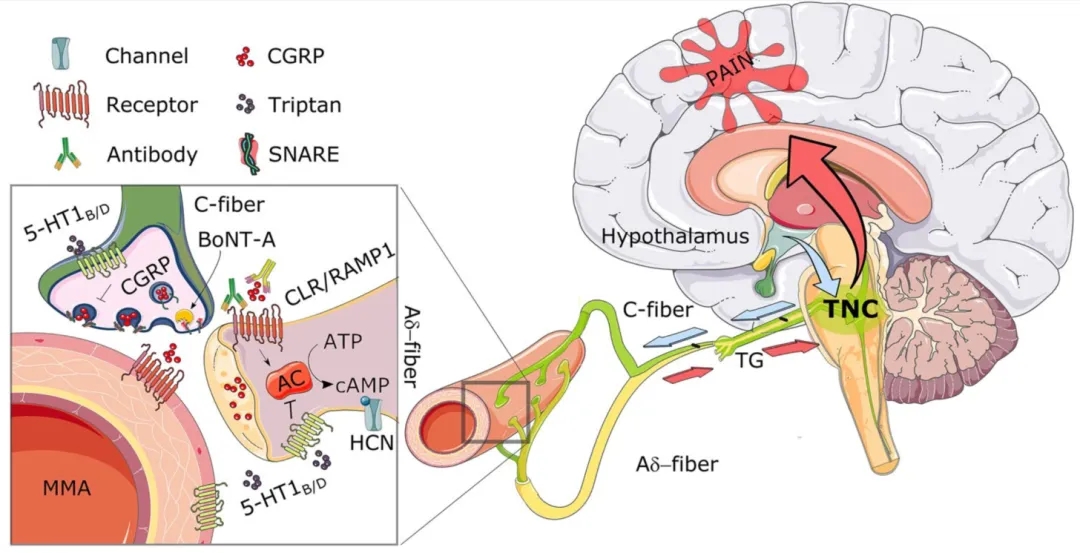
图2. 偏头痛病理生理学和现有特异性治疗的潜在机制的当前观点。偏头痛发作始于发作前征兆症状和下丘脑的激活。下丘脑激活后,三叉神经脊束核(TNC)被激活进一步导致三叉神经节(TG)的激活(很可能是单侧)和降钙素基因相关肽(CGRP)的释放。如图例示CGRP释放在脑膜中动脉(Middle Meningeal Artery, MMA)部位,导致血管舒张。而且,CGRP可激活Aδ-纤维上的降钙素受体样受体/受体活性修饰蛋白(Calcitonin receptor-Like Receptor/Receptor Activity-Modifying Protein, CLR/RAMP1, CGRP受体)。CGRP受体激活腺苷酸环化酶(adenylate cyclase, AC),增加细胞内环磷酸腺苷(cyclic Adenosine Monophosphate, cAMP)。cAMP的增加导致超兴奋性和超极化激活环核苷酸门控(Hyperpolarization-activated Cyclic Nucleotide-gated, HCN)通道的假设激活。cAMP增加了从Aδ-纤维发出的动作电位的开放概率,动作电位返回到TNC,进一步被感知为疼痛。此外,Aδ-纤维的敏化可能导致对正常刺激如触摸,也被感知为疼痛。目前针对偏头痛的特异性治疗是曲坦类药物,它可以阻止CGRP的释放,诱导MMA上的血管收缩,并导致Aδ-纤维的低兴奋性。新型单克隆抗体既可与CGRP受体结合,也可与CGRP直接结合,从而阻止CGRP的作用。CGRP囊泡融合依赖于3种胞吐的可溶性n -乙基马来酰亚胺敏感性融合附着蛋白受体(SNAREs),其中包括SNAP25、突触融合蛋白1和突触短蛋白。SNAP25由A型肉毒毒素(BoNT-A,Botox®)切割,可防止胞吐。[2]
偏头痛药物研究进展
偏头痛主要是多基因的,有多个遗传变异体,每个变异体有较小的效应量,通过累积导致发病。现已发现180多种变异属于几种复杂的“促偏头痛”分子异常途径,这些异常主要涉及神经或血管。目前的数据指出,CGRP和其他神经肽如垂体腺苷酸环化酶激活肽(PACAP)可引发略超过50%的患者偏头痛发作。cAMP(CGRP受体下游)和cGMP诱导均可在约80%的患者中触发偏头痛。偏头痛的复杂发病机制及其在患者中的异质表现,表明不同的信号通路(神经肽和神经递质)可能在不同的偏头痛患者中发挥作用,需要探索这些不同的靶点。这些靶点大致可分为(I) 代谢受体或G蛋白偶联受体(G Protein-Coupled Receptors, GPCRs),其中包括肽的降钙素家族的其他成员,即胰淀素(Amylin)和肾上腺髓质素(Adrenomedullin);(II)细胞内靶点;(III)离子通道。
偏头痛在急性发作期最常用的治疗药物是血清素(5-羟色胺[5-HT])受体激动剂,特别是靶向5-HT1B/1D的激动剂。近30年来,曲坦类(Triptans)药物一直被用作偏头痛急性治疗的一线药物。2018年批准的CGRP拮抗剂是第一类专门被批准用于预防偏头痛的药物,目前靶向CGRP的抗偏头痛治疗可分为吉泮类(Gepants)药物和单克隆抗体两大类。靶向CGRP的加卡奈珠单抗(Galcanezumab)、瑞玛奈珠单抗(Fremanezumab)和艾普奈珠单抗(Eptinezumab),以及靶向CLR/RAMP-1受体的依瑞奈尤单抗(Erenumab)均取得了成功的临床试验并被批准上市,耐受性良好且极少出现不良反应。
除了CGRP,神经肽PACAP作为潜在的抗偏头痛靶点也备受关注。PACAP是一种内源性肽,属于血管活性肠肽(Vasoactive Intestinal Polypeptide, VIP)、胰泌素(Secretin)和胰高血糖素(Glucagon)超家族肽,存在两种主要亚型;由38个氨基酸组成的神经肽(PACAP38),以及由27个氨基酸组成的截短版本(PACAP27)。PACAP可通过与3种不同的G蛋白偶联受体即PAC1、VPAC1和VPAC2分别结合启动多种信号机制。这些受体的激活可触发cAMP途径(图3)。PACAP38对PAC1受体的亲和力很高,这使PAC1受体成为治疗偏头痛的潜在新靶点。
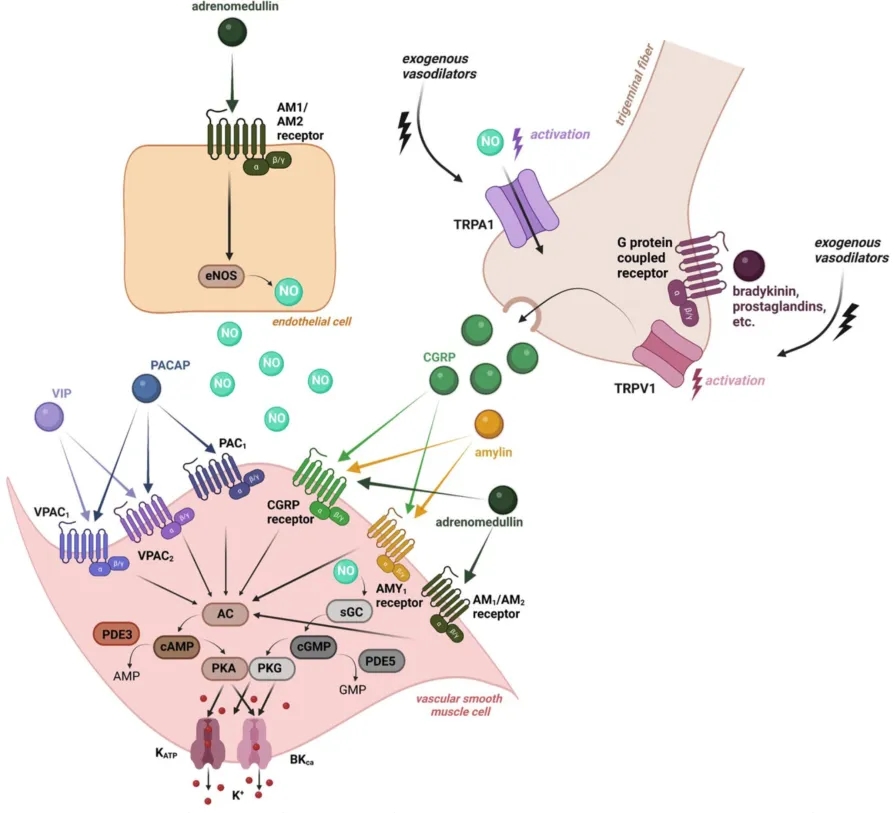
图3. 简化示意图,概述了几种与CGRP相关和非CGRP相关的靶点之间的相互作用,这些靶点可能成为未来偏头痛治疗的研究兴趣点。这些靶点的最终作用是通过打开KATP和BKCa通道来促进钾的外流。[3]
临床前和临床研究的联合有助于创新药物研发,使用动物模型可以探索疾病的发病过程,评估症状和合并症,是衔接基础研究与临床应用的重要工具。百奥赛图开发了针对偏头痛相关靶点人源化鼠,助力该疾病药物临床前药物研究,欢迎联系我们了解详情。

参考资料
[1] https://doi.org/10.1016/j.biopha.2021.111557
[2] https://doi.org/10.1007/s40263-019-00630-6
[3] https://doi.org/10.1186/s10194-023-01567-4
[4] https://doi.org/10.1186/s10194-023-01547-8
[5] https://doi.org/10.3390/cells12222649
[6] https://doi.org/10.3390/ijms241512268






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号