白细胞介素-1(Interleukin-1,IL-1)家族是最早被描述的细胞因子家族之一,IL-1家族由8种激动配体(IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β, IL-36γ, IL-37)和3种特异性受体拮抗剂(IL-1Ra, IL-36Ra和IL-38)组成,它们通过四种不同的异质二聚体受体复合物介导其效应。这些受体包括特定的配体结合链(IL-1R1, IL-33R (ST2), IL-18Rα和IL-36R),与配体相互作用后,IL-1R1、IL-33R和IL-36R会招募IL-1R辅助蛋白(IL-1RAcP),而IL-18R则招募IL-18Rβ链(见图1)。一旦被激活,这些受体复合物便会启动由NF-κB和MAPK依赖的细胞内促炎信号传导通路,并能够在全身和特定组织中发挥指导作用,推动固有和适应性炎症反应。
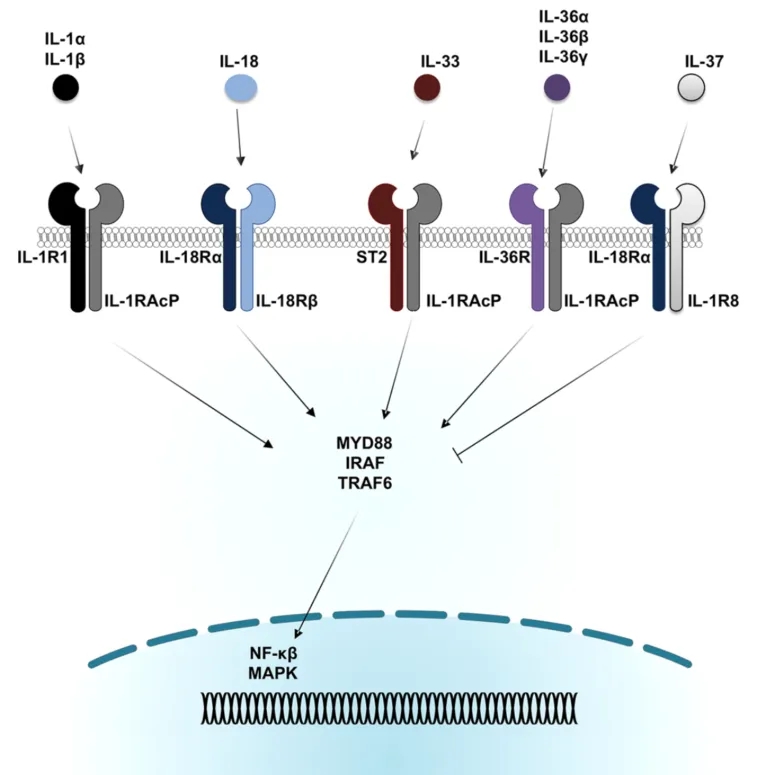
图1. IL-1家族细胞因子成员及其同源受体。[1]
IL-1家族的成员们根据前体的长度可归类为3个亚家族:IL-1亚家族,IL-36亚家族和IL-18亚家族。IL-1亚家族包括促炎细胞因子IL-1α、IL-1β和IL-33以及抗炎细胞因子IL-1受体拮抗剂(IL-1Ra),这些细胞因子已被广泛认为在促炎和免疫调节作用中具有重要作用。
IL-1亚家族成员简介
IL-1α和IL-1β均以31 kDa的前体形式表达,通过酶切成具有完全活性的17kDa形态。IL-1α和IL-1β在生物学活性方面表现出高度的相似性,通过与1型白细胞介素-1受体(IL-1R1)结合来刺激炎症反应,这种相互作用可以通过与内源性白细胞介素-1受体拮抗剂(IL-1Ra)的优先结合来阻断。尽管以这种方式发挥相似的促炎活性,但两种配体也有一些区别特征。首先,影响IL-1α和IL-1β裂解为成熟形式的因素不同。IL-1β的前体由半胱氨酸天冬氨酸蛋白酶(caspase)-1在炎症小体的下游进行切割。而在IL-1α前体的切割中起作用的是炎症小体,而不是caspase-1。其次,成熟形式的IL-1α在膜结合时发挥作用;而IL-1β则以成熟形式分泌并在溶液中发挥作用。在稳态条件下,IL-1β在细胞中不存在,仅在淋巴细胞和髓细胞中上调后表达。相反,IL-1α存在于多种健康细胞中,包括稳态时的淋巴细胞和髓细胞。
IL-1受体拮抗剂(IL-1Ra)是IL-1亚家族中的了解较少的成员。虽然IL-1Ra与IL-1α和IL-1β几乎同时被发现,但它没有受到广泛关注。IL-1Ra可作为IL-1α和IL-β的天然拮抗剂,IL-1Ra与IL-1R1结合却不启动信号转导,它可通过与IL-1R1结合并阻止IL-1RAcP共受体募集,从而阻止信号级联,该机制是IL-1R1的调控方式之一。由于IL-1Ra通过阻断IL-1α和IL-1β的受体来抑制其促炎作用,IL-1Ra可被视为一种抗炎分子,IL-1Ra可能潜在地抑制这些细胞因子的促肿瘤作用。
IL-33是IL-1亚家族中新发现的一个成员,主要因其能诱导2型免疫应答而闻名。IL33的主要受体是ST2受体,在受损细胞主动释放或死亡细胞被动释放IL-33后,IL-33直接与ST2结合,并招募IL-1RAcP共受体,激活NFκB通路。该机制在伤口愈合过程中发挥关键作用,如血管生成、基质成分的产生以及免疫细胞参与的调节。这也与癌症病理学有联系,ST2 IL-33信号通路在伤口愈合中的参与表明IL-33可能具有促进肿瘤的作用。IL-33也被认为是过敏性疾病、自身免疫性疾病药物研发的潜力靶点。
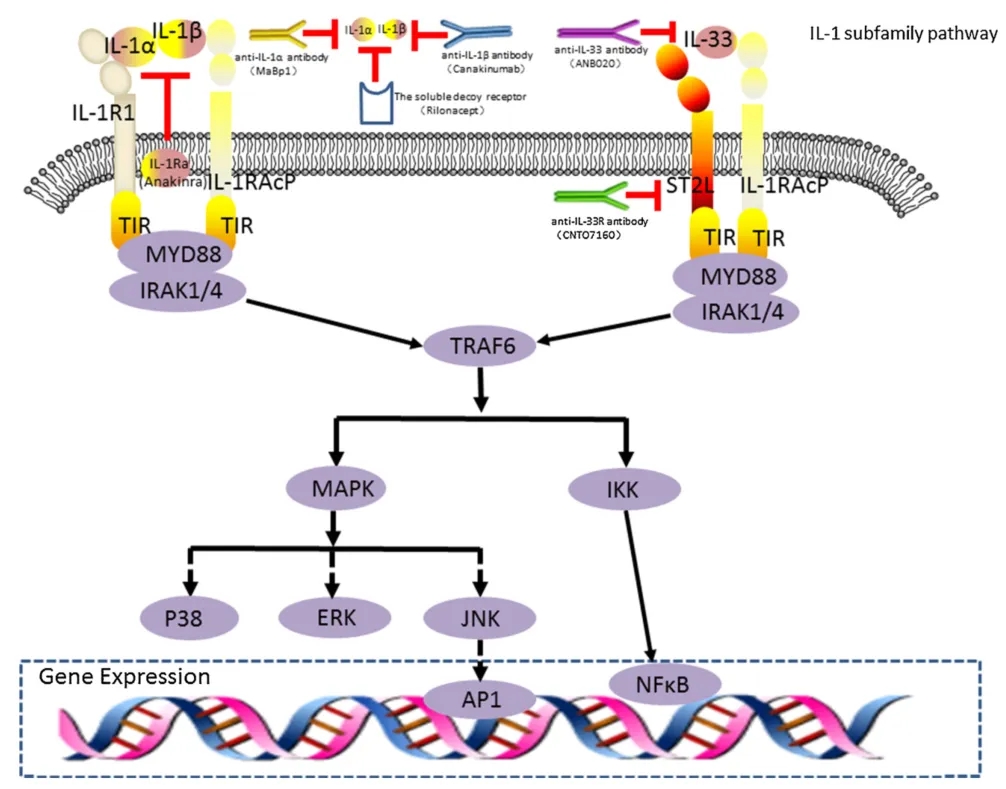
图2. IL-1亚家族的信号通路和目前可用的抑制剂。[2]
药物研究进展
数据库检索靶向IL-1亚家族成员及其共受体的抗体药物研究情况,其中,进展最快的是Canakinumab(卡那单抗),一种特异性抗IL-1β的单克隆抗体。2009年FDA批准用于治疗4岁及以上的成人和儿童Cryopyrin相关周期性综合征(CAPS),2013年FDA和EMA批准用于治疗全身型幼年特发性关节炎(sJIA)。2016年,FDA批准用于治疗肿瘤坏死因子受体相关周期性综合征(TRAPS)、甲羟戊酸激酶缺乏症/高IgD综合征(MKD/HIDS)和秋水仙碱耐药家族性地中海热(FMF)。2020年,FDA批准用于治疗成人斯蒂尔病(AoSD)的药物。
Lutikizumab(鲁提珠单抗)则是一种靶向IL-1α和Il-1β的双特异性抗体,通过结合IL-1α和IL-1β,Lutikizumab 能有效抑制其活性,III期临床开发用于治疗儿童和成人化脓性汗腺炎,溃疡性结肠炎等病症。
Tozorakimab(拖雷奇单抗)是阿斯利康收购MedImmune而获得的一款抗IL-33单抗。目前正在进行的III期临床试验评估用于治疗慢性阻塞性肺疾病(COPD)以及急性呼吸衰竭。哮喘的II期试验正在进行中。糖尿病肾病的II期治疗计划因疗效原因而终止。2023年初还停止了用于治疗特应性皮炎的临床试验项目。
Nadunolimab(尼达利单抗)是一种靶向IL-1RAcP的人源化单克隆抗体。该产品处于早期I/II临床开发阶段,用于治疗多种实体瘤,包括非小细胞肺癌(NSCLC)、胰腺导管腺癌(PDAC)、三阴性乳腺癌、结直肠癌、头颈癌等。Nadunolimab可同时抑制IL-1 α和IL-1 β信号传导,诱导表达IL-1RAcP的肿瘤细胞产生抗体依赖性细胞毒性(ADCC)。2021年,Nadunolimab在美国被授予用于治疗胰腺癌的孤儿药认定。
更多抗体药物研究进展如下表:
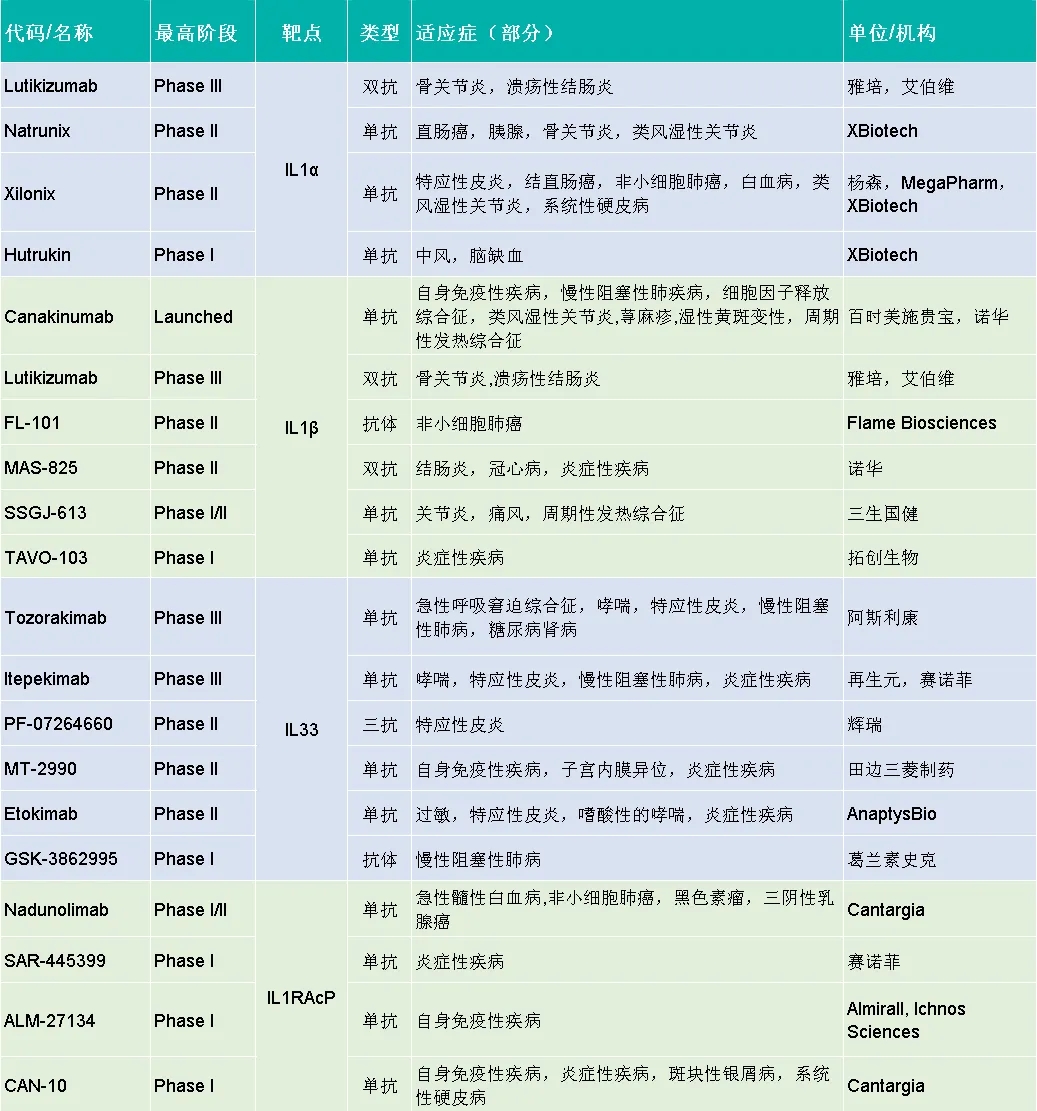
整理自科睿唯安数据库
百奥赛图百奥动物自主开发了一系列IL-1亚家族及共受体相关靶点人源化鼠,助力药物临床前研究。
B-hIL1B小鼠
抗人IL1B抗体在B-hILB小鼠中的抗肿瘤活性
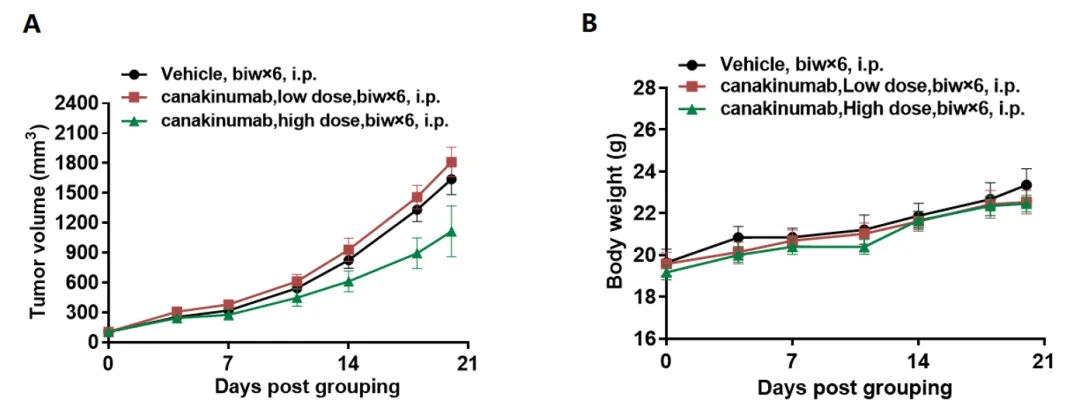
(A)抗人IL1B抗体Canakinumab(内部合成)抑制B-hIL1B小鼠中MC38肿瘤的生长。将小鼠结肠癌MC38细胞皮下接种到B-hIL1B纯合小鼠(雌性,6周龄,n=5)。当肿瘤体积达到约100 mm3时进行分组,使用不同剂量的抗人IL1B抗体对小鼠进行治疗。(B)治疗期间体重变化。如图A所示,抗人IL1B抗体Canakinumab能有效控制B-hIL1B小鼠的肿瘤生长,表明B-hIL1B小鼠为体内评估抗人IL1B抗体提供了一个强大的临床前模型。值表示为平均值±SEM。
B-hIL33小鼠
哮喘小鼠模型中BALF免疫细胞的数量和IgE产生统计分析
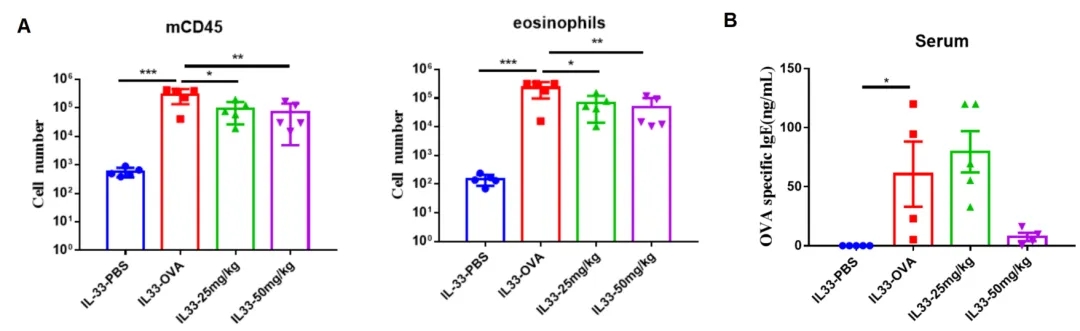
(A)从B-hIL33小鼠(n=5) BALF中分离免疫细胞。采用流式细胞术检测Etokimab类似物治疗和未治疗的急性哮喘小鼠嗜酸性粒细胞数量。Etokimab类似物治疗可减少B-hIL33纯合小鼠体内的炎症细胞。(B)研究终点收集血清。分析OVA特异性抗体反应的IgE水平。结果表明,Etokimab治疗组小鼠IgE水平明显低于未治疗组。
哮喘小鼠模型中H&E染色分析
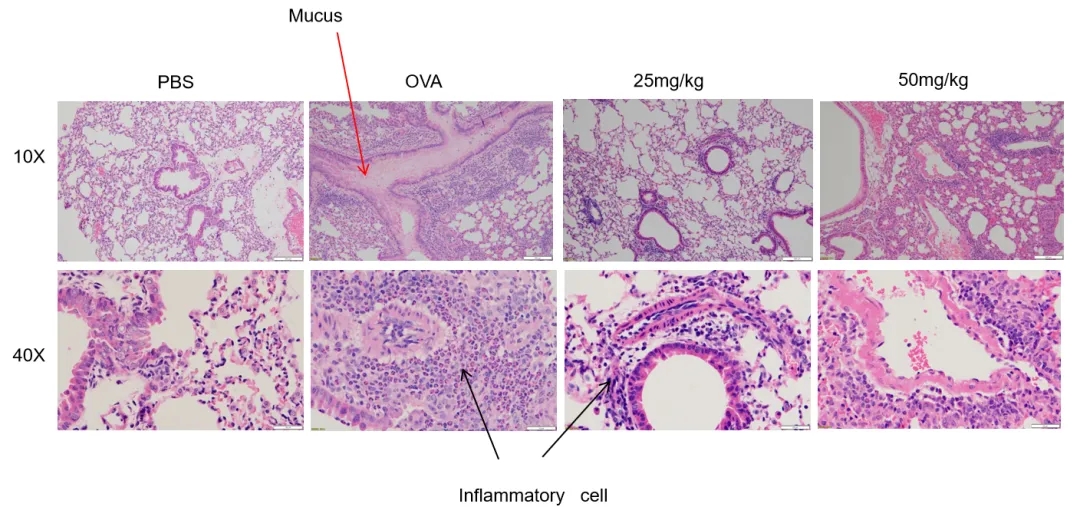
暴露于PBS气溶胶的B-hIL33小鼠的气道未显示任何炎症。OVA暴露导致支气管周围和血管周围炎症浸润明显增加,黏液分泌水平增加。在接受Etokimab类似物治疗的小鼠中观察到炎症浸润和黏液分泌减少。
B-hIL1RAcP小鼠
B-hIL1RAcP小鼠的功能验证
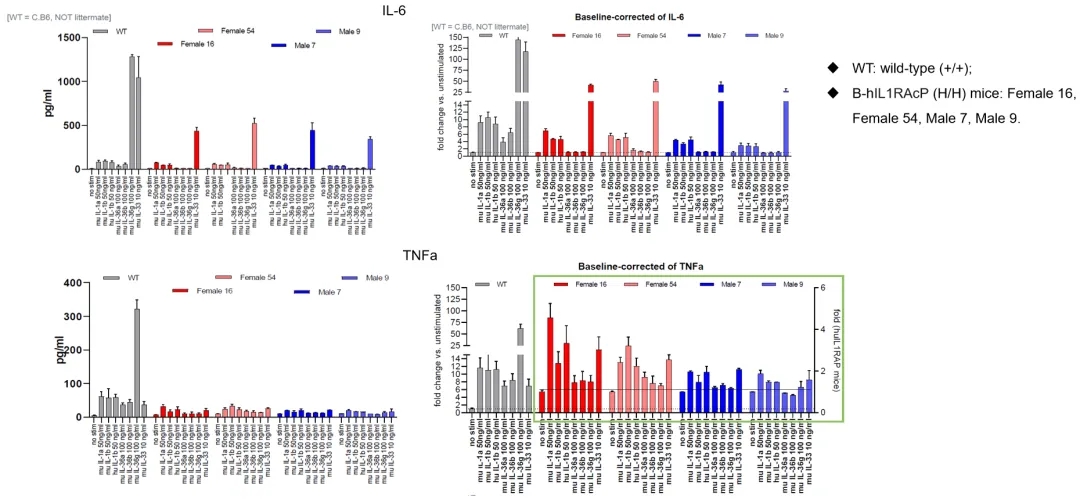
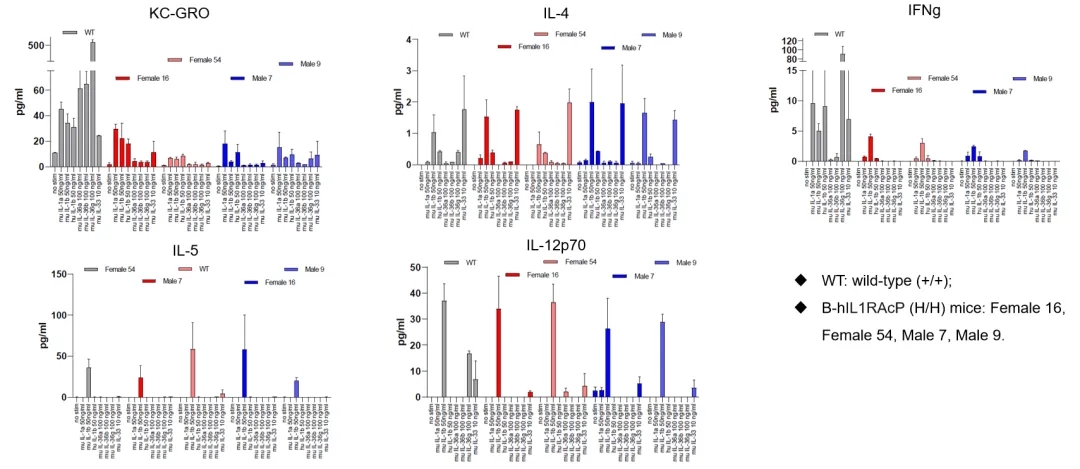
收集野生小鼠和纯合B-hIL1RAcP小鼠的脾细胞,用IL1/IL33/IL36蛋白刺激。48 h后检测脾细胞培养液中IL6、TNFα、KC/GRO、IL4、IFNg、IL5、IL12p70等细胞因子的表达。结果表明,鼠IL1/IL33/IL36蛋白能有效激活野生小鼠脾细胞,并触发相关细胞因子的分泌。小鼠IL1B和小鼠IL33蛋白能有效激活B-hIL1RAcP小鼠脾细胞并触发相关细胞因子的分泌,而小鼠IL36蛋白不能有效激活B-hIL1RAcP小鼠脾细胞。
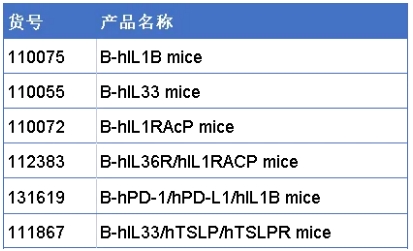
IL-1亚家族相关产品列表
参考资料
[1] doi: 10.1002/eji.201848056
[2] https://doi.org/10.1016/j.cytogfr.2018.11.001
[3] https://doi.org/10.1016/j.cytogfr.2021.09.004
[4] doi: 10.3389/fimmu.2019.01412
[5] doi: 10.1111/febs.16888






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号