自身性免疫性疾病(Autoimmune diseases)是指机体的免疫系统错误识别机体健康细胞、组织或器官为免疫原,引起不必要的炎症和组织损伤,严重甚至会导致死亡。常见引起自身性免疫疾病的危险因素包括遗传、环境刺激等,能影响皮肤、关节等机体多个部位,其中与皮肤相关的常见自身性免疫疾病包括:特应性皮炎、银屑病、斑秃等。这些疾病不仅影响患者的皮肤健康,还对生活质量产生深远影响。让我们一起深入了解这些疾病的概念、发病机制、治疗现状以及研究模型。
特应性皮炎
Atopic dermatitis
特应性皮炎(Atopic dermatitis,AD),是一种常见的慢性炎症性皮肤病,临床上主要表现为剧烈瘙痒、复发性湿疹皮损。据相关统计,特应性皮炎多发生于婴儿期及青少年期,在儿童中的患病率为15%至20%,在成人中为7%至10% [1]。
目前的研究认为,特应性皮炎的发病机制主要为:皮肤屏障被破坏,促使上皮细胞生成胸腺基质淋巴细胞生成素(TSLP)、IL-25和IL-33等细胞因子。激活Ⅱ型先天淋巴细胞(ILC2)释放IL-13,促使Th细胞向Th2,Th17和Th22细胞转换,Th2型细胞会产生IL-4,IL-13,IL-31等细胞因子,其中IL-4,IL-13可促使B细胞产生特异性IgE,导致肥大细胞脱颗粒,从而促进炎症反应[2]。而IL-31可激活神经元,引起瘙痒-搔抓恶性循环[3]。
Th22产生IL-22通过下调参与终末分化的基因,诱导角质形成细胞分化缺陷和增厚棘层。此外,Th17细胞产生IL-17,影响角质形成细胞粘附分子的表达,导致表皮屏障功能障碍[4]。
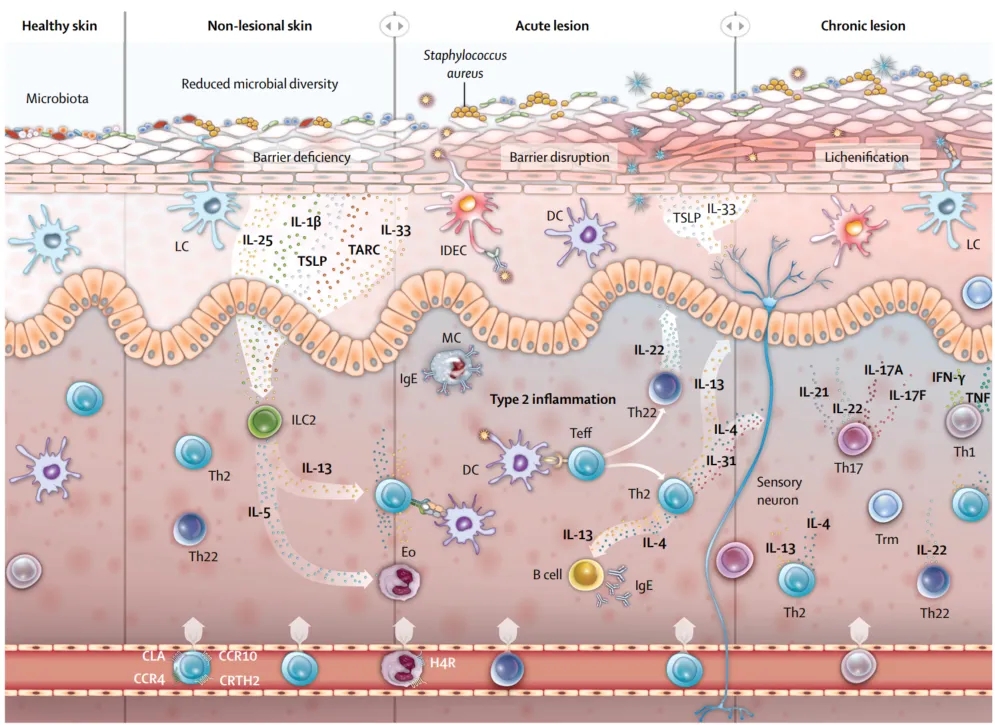
(Lancet. 2020 Aug 1;396(10247):345-360. doi: 10.1016/S0140-6736(20)31286-1.)
目前对于特应性皮炎的临床治疗主要以局部皮质类固醇药物、免疫抑制剂、抗组胺药物以及生物药为主。其中类固醇药物主要以糖皮质激素为主,具有较强的抗炎,抗过敏的作用;免疫抑制剂主要包括甲氨蝶呤,他克莫司等,对免疫反应起到抑制作用。抗组胺药物主要为H1受体拮抗剂,包括氯雷他定,西替利嗪等,可以抑制H1受体的活化,起到抑制过敏反应的作用[5]。
国际上对于特应性皮炎的研究,主要集中于生物药研发。根据科睿唯安统计的结果看,研发成功以及处于临床试验的抗体药物主要针对于IL-4,IL-13,IL-5,TSLP,OSMR以及IL-31等在特应性皮炎发病机制中具有重要作用的靶点。建立特应性皮炎建立动物模型对于相关药物的开发是至关重要的,其中常用的造模药物为恶唑酮和卡泊三醇。
OXA诱导的特应性皮炎动物模型
恶唑酮(Oxazolone,OXA)属于半抗原,能与皮肤组织蛋白结合成为抗原复合物,由树突状细胞呈递抗原后,激活T淋巴细胞。当OXA再次进入机体后会立刻引发过敏反应。
Dupilumab在OXA诱导的B-hIL4/hIL4RA小鼠AD模型中的疗效评价
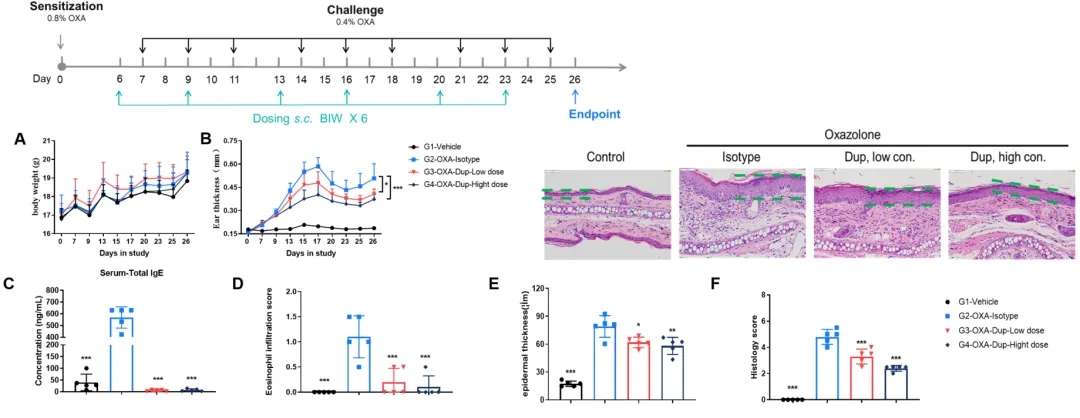
A. 治疗期间的体重变化;B. 治疗期间耳厚变化;C. 小鼠血清总IgE水平;D. 嗜酸性粒细胞浸润评分;E. 表皮厚度;F. 组织学评分。(A-B. 双因素方差分析;C-F. 单因素方差分析;* p< 0.05,** p< 0.01,*** p< 0.001)。
MC903诱导的特应性皮炎动物模型
卡泊三醇(MC903),是一种维生素D3类似物,广泛用于治疗银屑病。过去研究发现,局部使用MC903可激发小鼠上皮角质细胞高表达TSLP,促进CD4+T细胞向Th2细胞分化及激活并释放炎症细胞因子,引起小鼠产生特应性皮炎表型。
Dupilumab在MC903诱导的B-hIL4/hIL4RA小鼠AD模型中的疗效评价
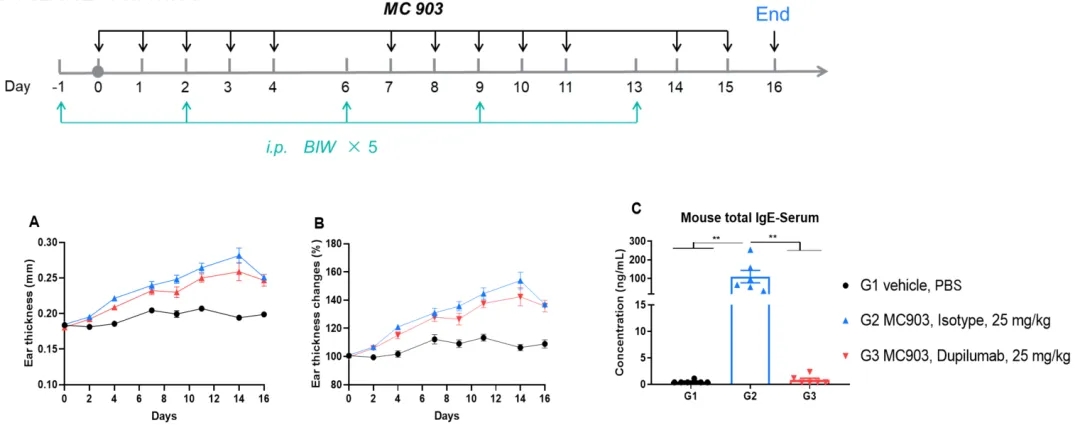
A-B.治疗期间耳厚变化。C.小鼠血清总IgE水平。数据表示为平均值±SEM。(A-B. 双因素方差分析; C. 单因素方差分析; ** p< 0.01)。
银屑病
Psoriasis
银屑病(Psoriasis),是以表皮角质细胞增生为特征的皮肤病。其临床特征表现为皮肤红斑,银白色鳞屑及瘙痒等。根据相关统计,银屑病全球患病率约为2%至3%,在青少年和成人中的发生率更高。除了皮肤表现外,银屑病患者还可能合并关节炎,称为银屑病关节炎,这进一步增加了该病的复杂性和对生活质量的影响[6]。
目前的研究认为,银屑病的发病机制病机制较为复杂,涉及遗传因素、免疫异常和环境因素的相互作用,主要为:皮肤屏障功能受损,促进浆细胞样DC细胞呈递抗原,活化CD8+细胞,引起角质细胞NF-κB通路活化,分泌CCL20、TNF等促炎因子及趋化因子,促进皮肤炎症反应。浆细胞样DC细胞分泌的炎症介质干扰素能够引起下游mDC细胞分泌IL-12、IL-23等促炎因子,活化Th17、Th22等细胞,产生IL-17进一步促进炎症过敏反应[7]。而IL-22能刺激角质形成细胞增殖,导致皮肤表层过度增生,形成银屑病特征性红色鳞屑斑块,促进银屑病皮损形成,并干扰正常的皮肤屏障功能,导致屏障损伤和水分丧失。这可能导致局部炎症加重和感染风险增加[8-9]。
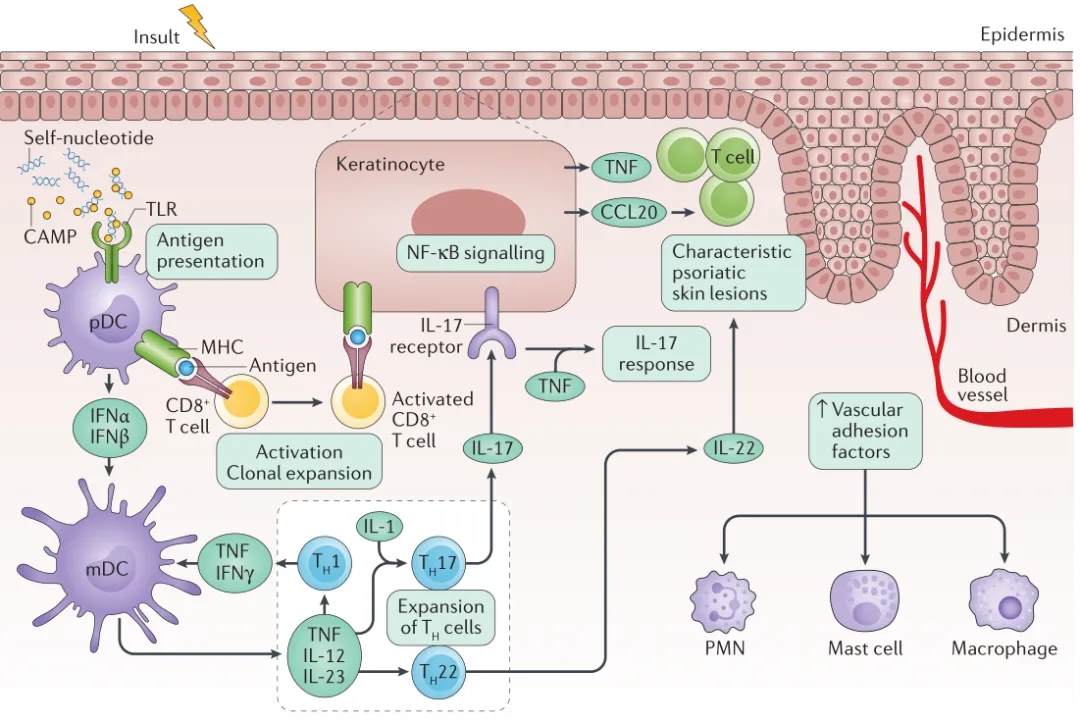
(Nat Rev Dis Primers, 2016, https://doi.org/10.1038/nrdp.2016.82)
临床上,轻度、中度银屑病阶段治疗主要以局部使用皮质类固醇药物为主,如糖皮质激素丙酸氟氯噻,具有抗炎和免疫抑制作用。对于中度、重度银屑病患者,临床常用免疫抑制剂及生物制剂进行治疗。免疫抑制剂主要包括甲氨蝶呤,环孢素A,异维A酸等,通过干扰细胞增殖分化和免疫反应发挥治疗银屑病作用。
近几年来,靶向银屑病相关的生物制剂研发取得显著进展。现银屑病靶向抗体药物主要分为抗TNF-α药物、抗IL17A药物及抗IL-22、IL-23药物。其中如阿达木单抗、恩利昔单抗可抑制TNF-α水平,抑制炎症反应。如赛克珠单抗可抑制IL-17通路发挥治疗银屑病的作用,除此之外如乌司奴单抗,可通过靶向IL-12和IL-23抑制免疫反应,减轻银屑病症状[10-11]。根据科睿唯安统计的结果看,研发成功以及处于临床试验的抗体药物主要针对于IL-17,IL-23,IL-12以及TNF-α等在银屑病发病机制中具有重要作用的靶点。针对银屑病建立动物模型研究时常用的造模药物为咪喹莫特。
IMQ诱导的银屑病动物模型
咪喹莫特(Imiquimod,IMQ)是一种Toll样受体7 (TLR7)激动剂,可与免疫细胞的TLR7结合,刺激其产生IL-23及TNF-α和干扰素-γ等促炎因子,导致Th17细胞增殖分化,分泌IL-17等促炎因子,引起一系列炎症反应,并募集其他炎性细胞到皮肤,引起角质形成细胞过度增殖和异常分化 ,导致表皮增厚,形成鳞屑斑块。
Bimekizumab在IMQ诱导的B-hIL17A/hIL17F小鼠银屑病模型中的疗效评价
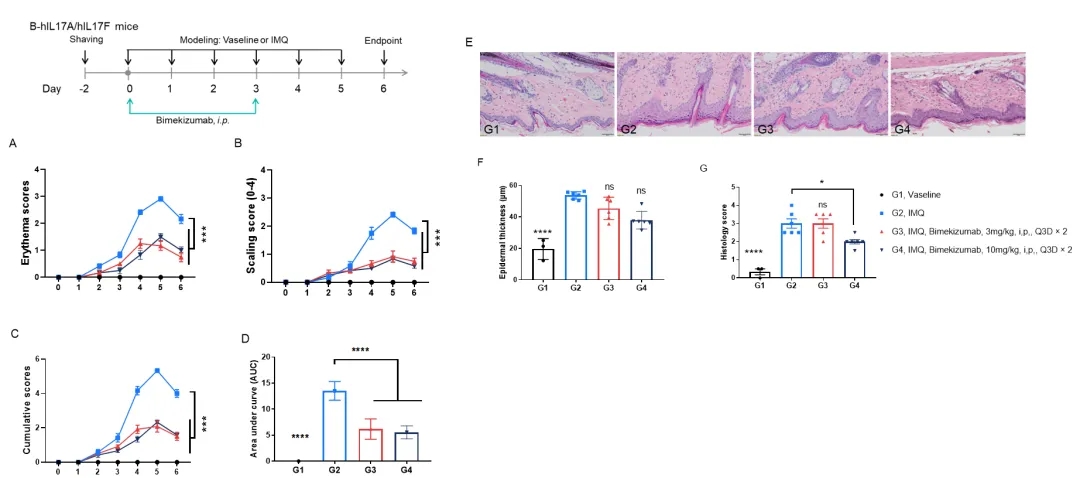
A.每日红斑评分;B.每日脱屑评分;C.各组累计得分;D.各组累积评分曲线下面积;E.背部皮肤H&E染色;F.表皮厚度;G.组织病理学评分。(双因素方差分析或单因素方差分析;* p< 0.05, *** p< 0.001, **** p< 0.0001)。
斑秃
Alopecia areata
斑秃(Alopecia areata)是指非瘢痕性的局部性脱发,是目前困扰年轻人的重要疾病之一,临床表现为突发的局部无瘢痕性脱发,头皮无明显炎症发生。斑秃的发生率约为2%,男性发病率略高于女性,可影响任何年龄段,尤以儿童和年轻成年人为多[12]。
在受到外界刺激或遗传因素、内分泌失调的情况下,毛囊角质形成细胞中的活性氧水平升高,氧化应激诱导 MHC-I 多肽相关性序列 A(MICA)表达,导致 NK 细胞活化和分泌γ干扰素(IFN-γ)。IFN-γ诱导 MHC-I 分子表达,递呈抗原给 T 细胞,引起免疫系统攻击机体自身毛囊,导致毛囊萎缩、减少,进一步产生斑秃症状[13]。
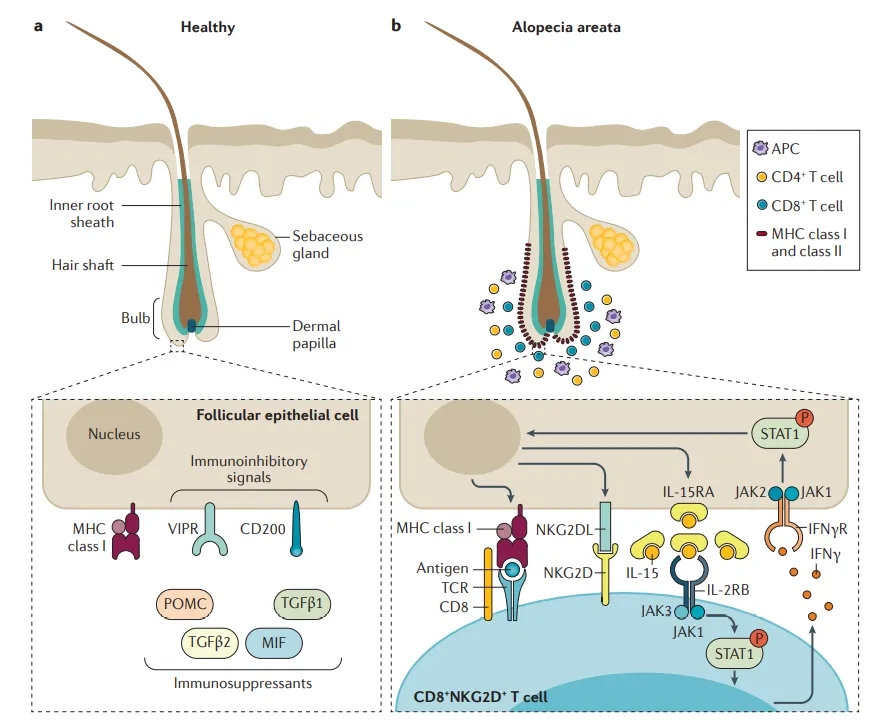
(Nat Rev Dis Primers. 2017 Mar 16;3:17011. doi: 10.1038/nrdp.2017.11.)
目前,临床上常采用外用药物治疗斑秃,最常见的为米诺地尔,可促进血管扩张,促进毛囊细胞的增殖和活性,延长毛发生长的生长期。此外如氢化可的松、克劳苯、地塞米松等类固醇激素药物可用于减轻免疫反应并促进头发再生。
随着生物疗法的兴起,针对治疗斑秃抗体药物的研究也逐渐增加。JAK/STAT信号通路阻断剂是目前治疗斑秃的一种新疗法,如托法替尼、巴瑞替尼等JAK抑制剂,可减轻IL-4、IL-6、IL-15等细胞因子的促炎作用,刺激毛母细胞增殖,促进毛发进入生长期[14]。统计发现,研发成功以及处于临床试验的抗体药物主要针对于IL-17, IL-23, IL-12,以及TNF-α等在特应性皮炎发病机制中具有重要作用的靶点。针对银屑病建立动物模型研究时常用的造模药物为咪喹莫特。
IMQ诱导的斑秃动物模型
咪喹莫特(Imiquimod,IMQ)是促进免疫细胞分泌IL-23、IL-6、TNF-α等促炎因子,激活Th17细胞,分泌IL-17,招募和激活更多的免疫细胞,局部炎症反应导致毛囊损伤,干扰毛发生长周期,最终引起脱发。这种模型也有助于发现新的治疗靶点和药物应用,促进治疗斑秃的新策略的开发。
IMQ诱导的C57BL/6 和 C3H/HeJ小鼠斑秃模型
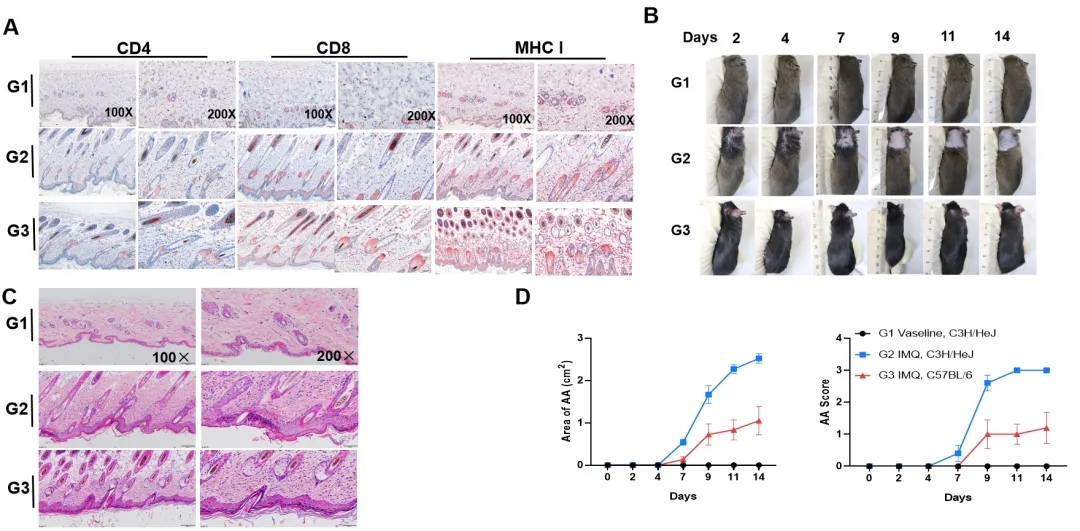
小鼠在第0、2、4、7、9、11天局部涂抹咪喹莫特80 mg,在第2、4、7、9、11、14天记录脱发图片(B),使用Image J软件计算脱发面积(D);收集颈部皮肤进行IHC (A) 和 H&E染色(C)。
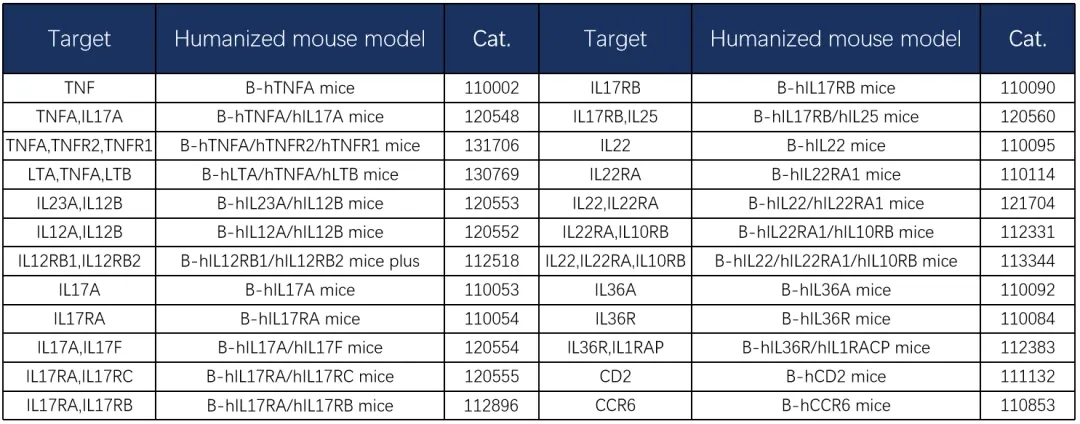
人源化小鼠为自身免疫疾病的研究中提供了强有力的支持,能够帮助科学家深入理解疾病机制、评估新疗法的效果并推动个体化治疗的发展。目前百奥赛图开发了一系列与自免皮肤疾病相关的小鼠品系,可用于快速筛选相应的抗体药物。
特应性皮炎相关靶点人源化鼠
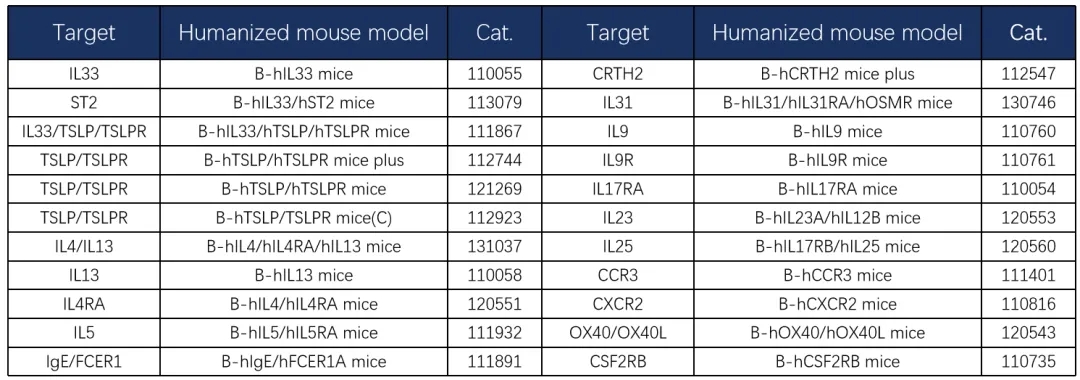
银屑病相关靶点人源化鼠
银屑病、特应性皮炎和斑秃是三种重要的自身性免疫皮肤病,各有独特的发病机制和临床表现。虽然目前已经有了多种治疗方法,但仍面临较大的挑战。百奥赛图希望通过不断的研究和临床试验,能够为患者提供更有效的治疗方案,提高他们的生活质量。让我们一起关注自身免疫疾病,共同抵御皮肤健康的威胁!
参考文献
[1] Kim J, Kim BE, Leung DYM. Pathophysiology of atopic dermatitis: Clinical implications. Allergy Asthma Proc. 2019 Mar 1;40(2):84-92. doi: 10.2500/aap.2019.40.4202. PMID: 30819278; PMCID: PMC6399565.
[2] Guttman-Yassky E, Dhingra N, Leung DY. New era of biologic therapeutics in atopic dermatitis. Expert Opin Biol Ther. 2013 Apr;13(4):549-61. doi: 10.1517/14712598.2013.758708. Epub 2013 Jan 16. PMID: 23323893; PMCID: PMC3819721.
[3] Garcovich S, Maurelli M, Gisondi P, Peris K, Yosipovitch G, Girolomoni G. Pruritus as a Distinctive Feature of Type 2 Inflammation. Vaccines (Basel). 2021 Mar 23;9(3):303. doi: 10.3390/vaccines9030303. PMID: 33807098; PMCID: PMC8005108.
[4] Leung DY, Bieber T. Atopic dermatitis. Lancet. 2003 Jan 11;361(9352):151-60. doi: 10.1016/S0140-6736(03)12193-9. PMID: 12531593.
[5] Chovatiya R, Paller AS. JAK inhibitors in the treatment of atopic dermatitis. J Allergy Clin Immunol. 2021 Oct;148(4):927-940. doi: 10.1016/j.jaci.2021.08.009. Epub 2021 Aug 24. PMID: 34437922; PMCID: PMC10166130.
[6] Michalek IM, Loring B, John SM. A systematic review of worldwide epidemiology of psoriasis. J Eur Acad Dermatol Venereol. 2017 Feb;31(2):205-212. doi: 10.1111/jdv.13854. Epub 2016 Aug 30. PMID: 27573025.
[7] Greb JE, Goldminz AM, Elder JT, Lebwohl MG, Gladman DD, Wu JJ, Mehta NN, Finlay AY, Gottlieb AB. Psoriasis. Nat Rev Dis Primers. 2016 Nov 24;2:16082. doi: 10.1038/nrdp.2016.82. PMID: 27883001.
[8] Ouyang W. Distinct roles of IL-22 in human psoriasis and inflammatory bowel disease. Cytokine Growth Factor Rev. 2010 Dec;21(6):435-41. doi: 10.1016/j.cytogfr.2010.10.007. Epub 2010 Nov 23. PMID: 21106435.
[9] Fujita H. The role of IL-22 and Th22 cells in human skin diseases. J Dermatol Sci. 2013 Oct;72(1):3-8. doi: 10.1016/j.jdermsci.2013.04.028. Epub 2013 May 3. PMID: 23746568.
[10] Simopoulou T, Tsiogkas SG, Zafiriou E, Bogdanos DP. Secukinumab, ixekizumab, bimekizumab and brodalumab for psoriasis and psoriatic arthritis. Drugs Today (Barc). 2023 Mar;59(3):135-167. doi: 10.1358/dot.2023.59.3.3419557. PMID: 36847624.
[11] Yiu ZZ, Warren RB. Ustekinumab for the treatment of psoriasis: an evidence update. Semin Cutan Med Surg. 2018 Sep;37(3):143-147. doi: 10.12788/j.sder.2018.040. PMID: 30215630.
[12] Villasante Fricke AC, Miteva M. Epidemiology and burden of alopecia areata: a systematic review. Clin Cosmet Investig Dermatol. 2015 Jul 24;8:397-403. doi: 10.2147/CCID.S53985. PMID: 26244028; PMCID: PMC4521674..
[13] Pratt CH, King LE Jr, Messenger AG, Christiano AM, Sundberg JP. Alopecia areata. Nat Rev Dis Primers. 2017 Mar 16;3:17011. doi: 10.1038/nrdp.2017.11. PMID: 28300084; PMCID: PMC5573125.
[14] Sardana K, Bathula S, Khurana A. Which is the Ideal JAK Inhibitor for Alopecia Areata - Baricitinib, Tofacitinib, Ritlecitinib or Ifidancitinib - Revisiting the Immunomechanisms of the JAK Pathway. Indian Dermatol Online J. 2023 Jun 28;14(4):465-474. doi: 10.4103/idoj.idoj_452_22. PMID: 37521227; PMCID: PMC10373824.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号