近几年,免疫治疗在抗肿瘤治疗中的作用备受关注,基于免疫治疗的新药开发和标志物探索,成为了当前肿瘤研究的热点,这也对临床前研究动物模型的建立提出了更高的要求。既可以模拟人肿瘤特征又同时存在“人源化”免疫系统的免疫重建小鼠模型,成为了肿瘤免疫研发中的优质模型。
背景概述
严重免疫缺陷的小鼠品系,如百奥赛图明星产品B-NDG小鼠,缺乏成熟的B、T和NK细胞,适合人源细胞或组织移植,已被广泛用作评估人类免疫反应的体内模型,包括在肿瘤免疫学中的应用。然而,当人外周血单核细胞(PBMC)移植到这些小鼠体内时,由于人T细胞受体(TCR)与小鼠免疫细胞表面的主要组织相容性复合体(MHC)蛋白I和II的结合,会出现严重的急性异种移植物抗宿主病(Graft-versus-Host Disease,GvHD)。
GvHD最初由Barnes、Loutit和Micklem报道[1],Billingham将其经典定义为供体免疫功能良好的细胞识别并攻击免疫功能低下的异体受体的宿主组织的综合症[2]。在临床前肿瘤免疫治疗研究中,GvHD的发生、发展给肿瘤治疗研究带来了阻碍,特别是在PBMC重建人源化小鼠模型中,因GvHD发生导致的小鼠体重下降乃至动物死亡,对药物药效实验的影响很大,导致给药窗口缩短。这些年研究者一直努力减少人类PBMC诱导的GvHD,并随后通过消除小鼠MHC I和MHC II来扩大免疫缺陷小鼠品系的人类免疫评估窗口。
针对这一问题,百奥赛图在B-NDG背景下开发了一种新型B2m基因敲除小鼠B-NDG B2m KO mice plus,该小鼠缺乏鼠源MHC I类分子的表达,但表达由鼠B2m和Fcgrt基因融合表达的鼠源FcRn蛋白,最大程度避免影响FcRn对抗体的循环代谢功能;为了消除MHC II类分子的表达,我们还在相同的B-NDG背景下开发了一种H2-Ab1基因敲除小鼠,并将这两个品系的小鼠交配到一起,以获得MHC I/II双KO小鼠模型,称为B-NDG MHC I/II DKO mice plus。相比于B-NDG小鼠均能够改善小鼠PBMC重建后的GvHD,其中以B-NDG MHC I/II DKO mice plus效果最优。
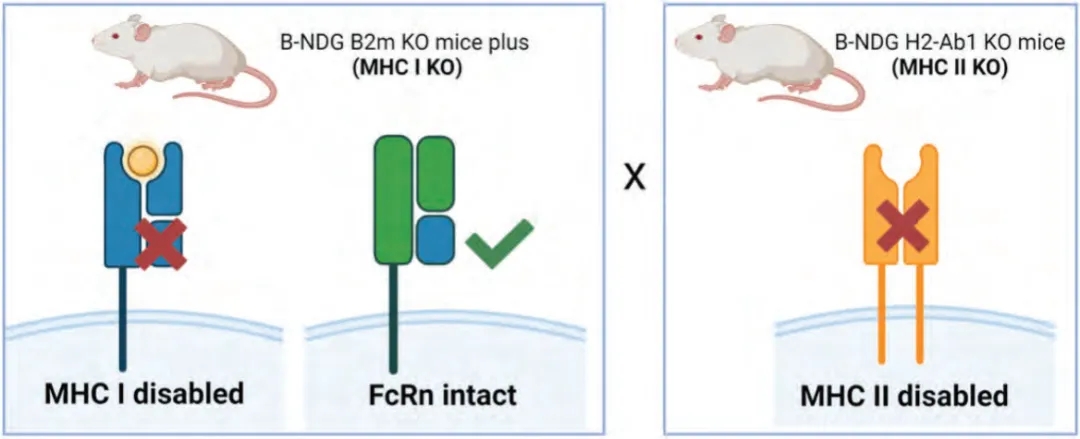
MHC-I/II DKO小鼠靶向策略概述[3]
因此,开发合适的模型来研究GvHD的发病机制及治疗药物疗效评价安全性显得尤为重要。百奥赛图以B-NDG小鼠为基础开发的二代系列小鼠——B-NDG MHC I/II DKO mice plus,以满足特定细胞功能研究和相应靶点药物评价的需求,该模型是细胞疗法和抗体体内评估的强大临床前工具。
B-NDG MHC I/II DKO mice plus部分数据展示:
- 蛋白表达分析
- 免疫细胞分型数据
- PBMC重建
- 抗体药效验证实验
蛋白表达分析

通过流式细胞术分析B-NDG小鼠、B-NDG B2m KO mice plus 和B-NDG MHC I/II DKO mice plus中品系特异性H-2Kb/H-2Db(MHC-I)和I-Ak(MHC-II)的表达,收集脾细胞,结果表明,B-NDG小鼠中检测到小鼠H-2Kb/H-2Db,但B-NDG B2m KO mice plus 或B-NDG MHC I/II DKO mice plus中未检测到。在B-NDG小鼠和B-NDG B2m KO mice plus 中检测到小鼠I-Ak,但在B-NDG MHC I/II DKO mice plus 中没有检测到。
脾脏、血液和骨髓中白细胞亚群的比例
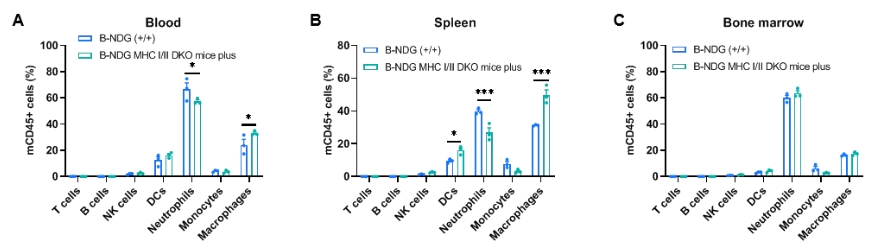
流式细胞术检测脾脏、血液和骨髓中白细胞亚群的比例。从B-NDG小鼠和B-NDG MHC I/II DKO mice plus(雄性,9周龄,n=3)中采集血液、脾脏和骨髓。通过流式细胞术分析白细胞亚群。结果显示,在B-NDG小鼠和B-NDG MHC I/II DKO mice plus 的所有组织中均未检测到T细胞、B细胞和NK细胞。数值表示为平均值±SEM。通过双向方差分析检验确定显著性*P<0.05,**P<0.01,***P<0.001。
构建GvHD模型,比较不同品系小鼠减轻GvHD的效果
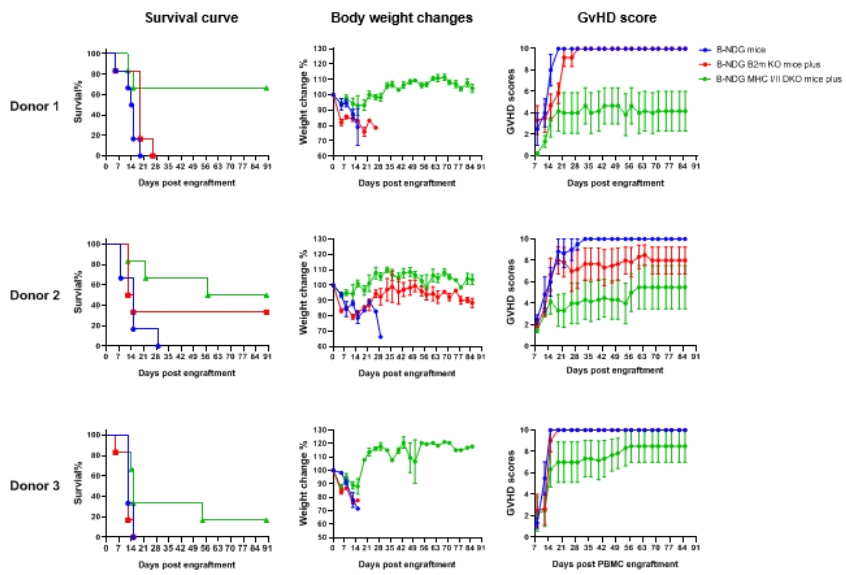
B-NDG小鼠、B-NDG B2m KO mice plus 和B-NDG MHC I/II DKO mice plus 中用人PBMC植入诱导的GvHD严重程度的比较。5周龄雌性B-NDG小鼠、B-NDG B2m KO mice plus 和B-NDG MHC I/II DKO mice plus 用1.0 Gy照射,然后在第0天(n=6)静脉植入来自三个健康供体(供体1-3)的人PBMCs(5×106)。用Kaplan-Meier生存曲线分析小鼠的存活率。每周测量两次体重。GvHD的临床症状每周评分两次。结果表明,与B-NDG小鼠或B-NDG B2m KO mice plus 相比,B-NDG MHC I/II DKO mice plus 中MHC I/II双重敲除可以显著延长人PBMC植入诱导的GvHD的寿命并减轻其严重程度。因此,B-NDG MHC I/II DKO mice plus 是更适合将人PBMC植入免疫缺陷小鼠的小鼠模型。值表示为平均值±SEM。
成功重建人PBMCs,显著延长实验窗口期
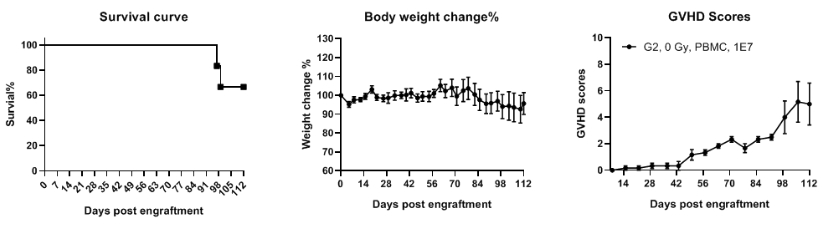
B-NDG MHC I/II DKO mice plus 移植人PBMCs后,存活时间显著延长。在第0天(n=6),将B-NDG MHC I/II DKO mice plus 静脉植入人PBMCs(1×107)。用Kaplan-Meier生存曲线分析小鼠的存活率。每周测量两次体重。GvHD的临床症状每周评分一次。当体重下降超过20%时,实施安乐死。同时,小鼠的GvHD评分记录为10。结果显示,所有小鼠的寿命可达96天。在此期间,除了体重减轻外,没有其他明显的GvHD症状。值表示为平均值±SEM。
重建的人免疫细胞
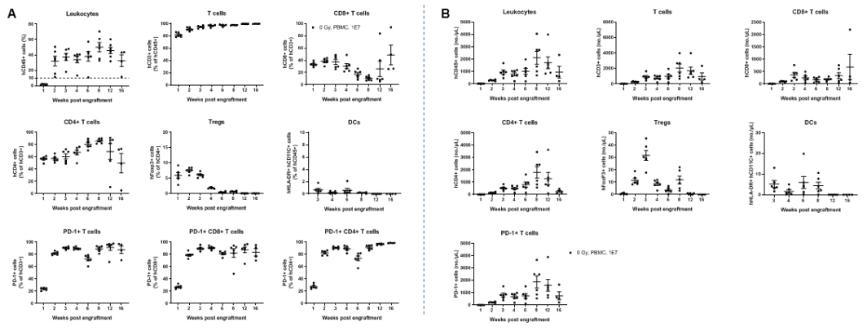
人PBMCs在B-NDG MHC I/II DKO mice plus中成功重建。在第0天(n=6),将B-NDG MHC I/II DKO mice plus静脉植入人PBMCs(1×107)。每周采集外周血,分析人体免疫细胞的重建水平。植入后112天(16周)结束实验。A.重建人免疫细胞的比例;B.重组人免疫细胞的绝对细胞数。结果显示,在B-NDG MHC I/II DKO mice plus中重建人PBMCs两周后,外周血中CD45+细胞的比例和绝对细胞数开始增加,并保持相对稳定的重建水平,直到16周的终点。重组人T细胞的频率在两周内超过90%,并继续上升,最终达到近100%。重组的人类T细胞包括CD4+T细胞、CD8+T细胞和Tregs。也可以检测到少量的DC。
抗体药效验证实验
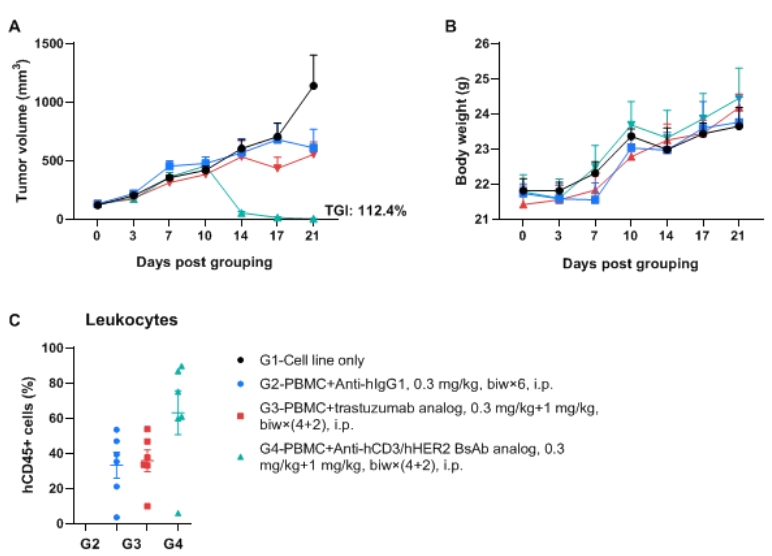
使用人PBMC移植的B-NDG MHC I/II DKO mice plus建立NCI-N87人胃癌模型,并验证抗hCD3/hHER2双特异性抗体的药效。将人胃癌细胞系NCI-N87(1×107)皮下接种于B-NDG MHC I/II DKO mice plus。接种细胞系3天后,将人PBMCs(1×107)静脉植入B-NDG MHC I/II DKO mice plus(雌性,6-9周龄,n=6)。肿瘤接种后3天,腹腔注射抗hCD3/hHER2 BsAb类似物(内部合成)和抗hHER2抗体曲妥珠单抗类似物(内部合成)。当肿瘤体积达到100mm3时,将动物分为对照组和治疗组。(A) 肿瘤体积;(B) 体重;(C) 终点时外周血中人CD45+细胞的比例。结果显示,抗hCD3/hHER2双特异性抗体显著抑制肿瘤生长,呈剂量依赖性。
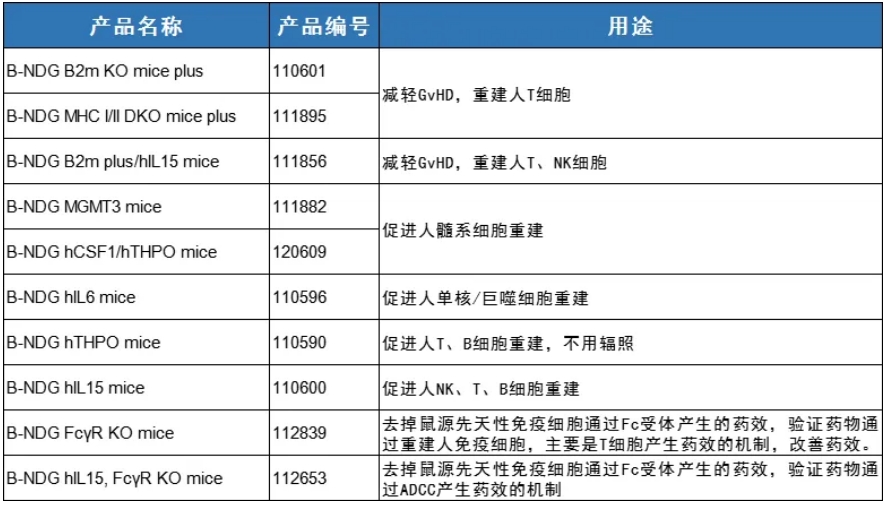
B-NDG小鼠衍生产品家族品系丰富,功能全面,查看下图了解更多详情~
参考文献
[1] Barnes D.W., Loutit J.F., Micklem H.S. “Secondary disease” of radiation chimeras: a syndrome due to lymphoid aplasia. Ann. NY Acad. Sci. 1962, 99:374–385.
[2] Billingham R.E. The biology of graft-versus-host reactions. Harvey Lect. 1966, 62:21–78.
[3] Graphic created with BioRender.com.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号