CD3双抗通过同时结合肿瘤细胞上表达的肿瘤相关抗原TAA和T细胞上的CD3来发挥作用。可以绕过TCR-MHC复合物和共刺激信号的经典激活通路,直接激活T细胞,从而可以有效的杀伤肿瘤细胞,因此一直是双特异性抗体领域研究的热点。
近日,CD3双抗领域好消息不断。2024年9月4日,岸迈生物将一款BCMA/CD3双抗的大中华区以外权益授权给Vignette Bio,交易总额达6.35亿美元。8月9日默沙东宣传收购同润生物的CD3/CD19双抗,首付款7亿美元,最高里程碑6亿美元。
药物上市方面也取得进展。8月26日,再生元的CD3/CD20双抗odronextamab获欧洲药品管理局(EMA)批准用于治疗复发/难治性滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL),此前5月其另一款BCMA/CD3双抗linvoseltamab获EMA批准治疗复发/难治性多发性骨髓瘤患者。
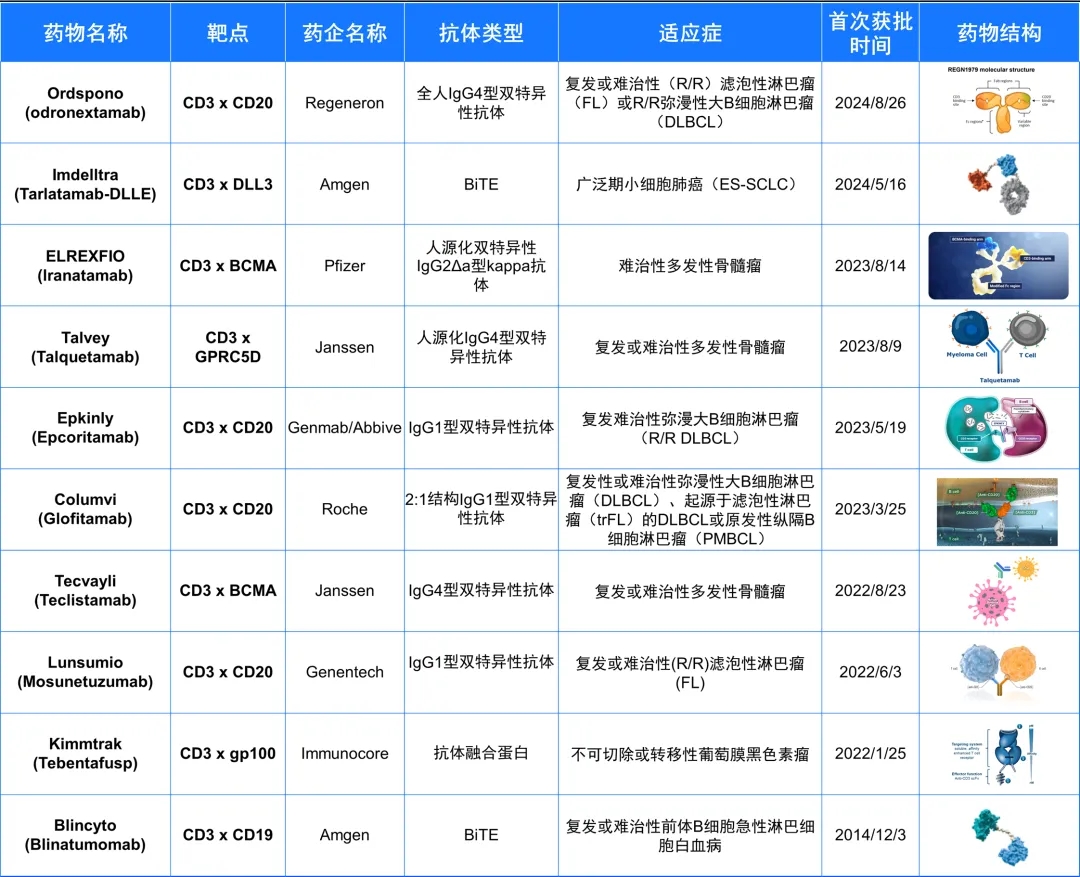
10款已上市CD3双抗药物
CD3×TAA双抗组合已在肿瘤特别是血液瘤治疗方面显示出巨大的潜力。全球目前共有10款CD3双抗成功上市,其中9款均为近三年上市,迎来黄金发展期。
已上市CD3双抗药物列表
由于免疫抑制微环境(TME)中稀疏的T细胞浸润和TME中多种免疫抑制细胞会影响效应T细胞的质量等障碍,CD3双抗仍在实体瘤治疗中面临较大的挑战。药物开发人员正在通过优化CD3亲和力、开发新的CD3表位、寻找新靶点等方法,力求在实体瘤中实现突破[1]。Immunocore开发的CD3/gp100双抗是首个获批上市TCR疗法,也是首个治疗实体瘤的T细胞衔接器,该药物用于治疗HLA-A*02:01阳性不可切除性或转移性葡萄膜黑色素瘤成人患者。今年5月16日,安进开发的first-in-class DLL3/CD3双抗Imdelltra获FDA批准上市,带来实体瘤的又一突破,用于治疗广泛期小细胞肺癌ES-SCLC,临床II期10mg剂量组客观缓解率ORR为40%,细胞因子释放综合征CRS发生率为51%,多数为1级和2级。
细胞因子释放是CD3双抗介导的主要安全相关不良事件之一。CD3双抗导致T细胞过度激活,释放过量的炎性细胞因子,如IFN-γ、IL-6和TNF-α,导致从轻度发热到多器官系统衰竭等各种症状。除了亲和力和给药剂量的优化外,有研究表明CD3结合位点的选择也会影响T细胞激活,但仍需更多临床研究验证。CD3蛋白复合物由6条肽链以非共价键组成,含有3对二聚体(εγ、εδ、ζζ),由CD3ε、CD3δ、CD3γ和 CD3ζ四个恒定链组成,分别由CD3E、CD3D、CD3G和CD247基因编码,其中CD3ε对T细胞的活化以及发育尤为重要。在研药物中多数CD3双抗识别CD3ε表位,部分识别CD3εδ表位。
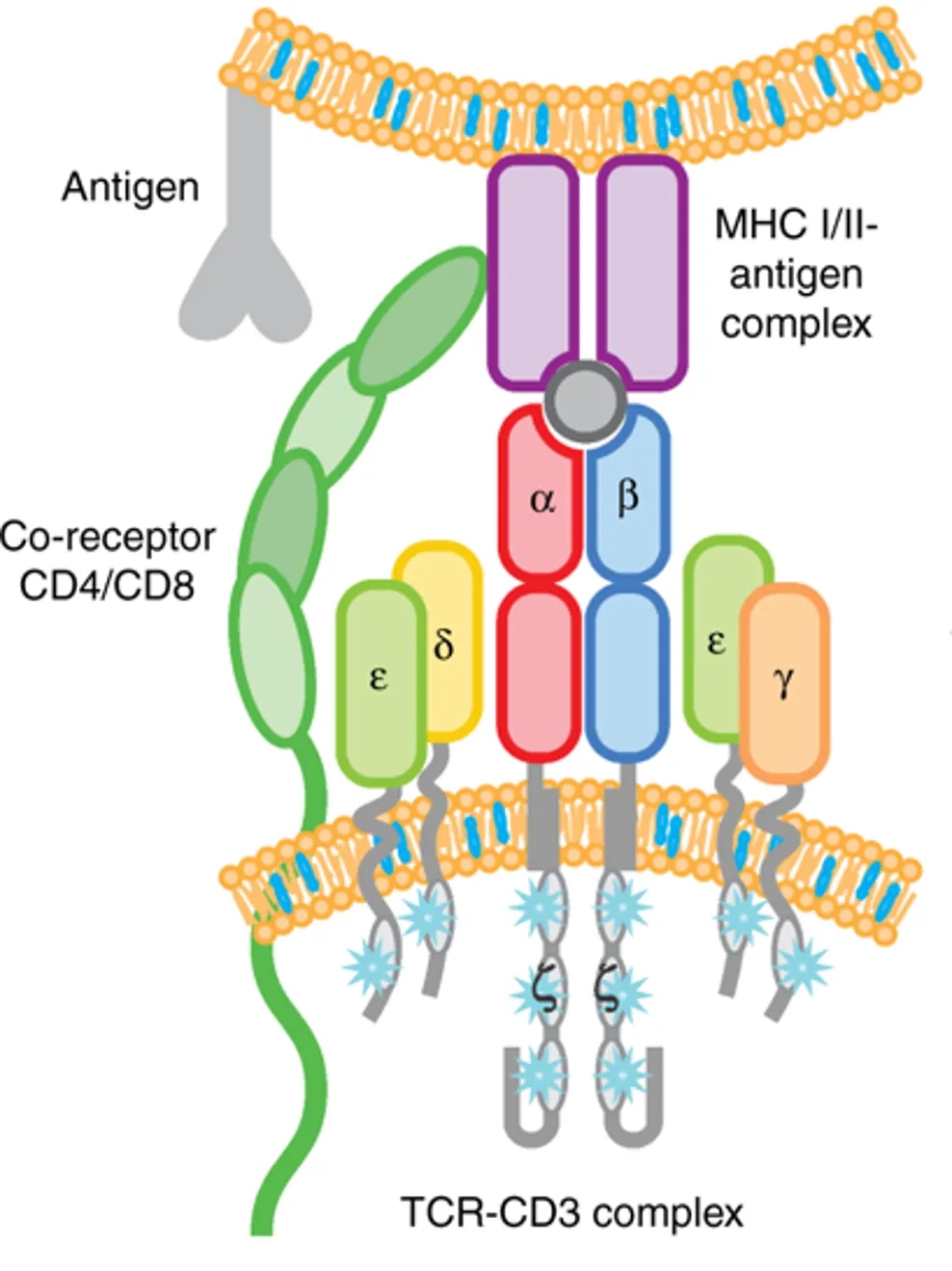
图1.TCR-CD3复合物结构示意图[2]
动物模型用于CD3双抗药物评价研究案例
百奥动物开发了PBMC免疫重建小鼠模型、系列CD3E及CD3EDG基因人源化小鼠模型及TAA人源化细胞系,是CD3双抗、三抗或多抗药物的体内药效及安全性评价的有力工具,期望助力全球药企研发进展。
01、PBMC免疫重建小鼠模型用于评价CD3双抗
PBMC重建B-NDG模型评估CD3×Claudin18.2双抗的体内药效
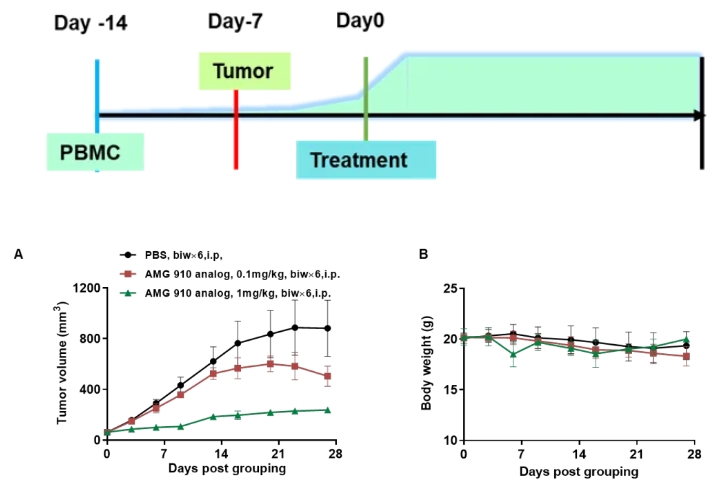
• NUGC4 cells (5E6), s.c.; human PBMC cells (5E6), i.v.
• B-NDG mice (female, 7 week-old, n=6)
• AMG 910 analog: Anti-human CD3×Claudin18.2 bispecific antibody
PBMC重建B-NDG模型评估CD3×Her2双抗的体内药效
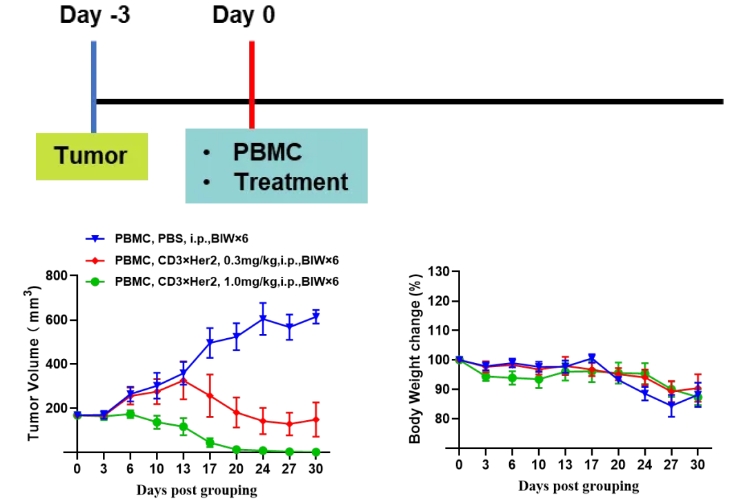
• NCI-N87 cells (1E7), s.c.; human PBMC cells (5E6), i.v.
• B-NDG mice (female, 6 week-old, n=6).
02、B-hCD3EDG人源化小鼠模型用于评价CD3双抗
利用B-hCD3EDG小鼠进行CD3×BCMA双抗的体内药效评价
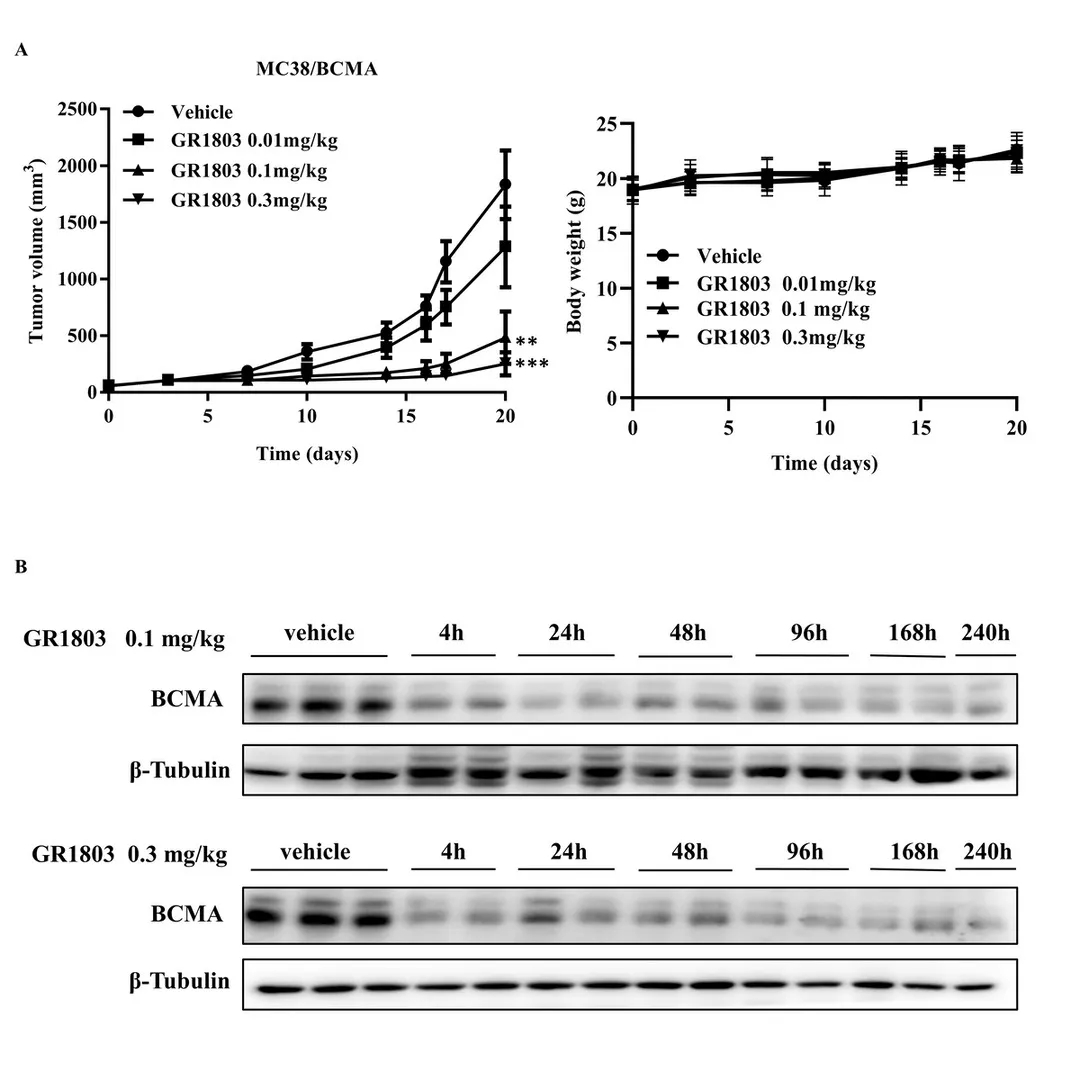
图4.GR1803抑制体内BCMA阳性肿瘤的生长(数据来自客户发表文章[3])
A.GR1803抑制皮下接种B-hCD3EDG小鼠的B-hBCMA MC38(310720)肿瘤的生长。注射对照或所示剂量的GR1803,并在所示日期测量肿瘤体积和体重。数据表示为肿瘤体积的平均值±SEM或体重的平均值±SD。**P<0.01 vs.对照,***P<0.001 vs. 对照;n=8。B.GR1803引起肿瘤组织中BCMA的下调。B-hCD3EDG小鼠皮下接种B-hBCMA MC38(310720)。对荷瘤小鼠进行单次静脉注射对照或GR1803,并在所示时间切除肿瘤组织。采用Western印迹法检测肿瘤组织中BCMA的表达水平。
利用B-hCD3EDG小鼠进行CD3×DLL3双抗的体内药效评价New
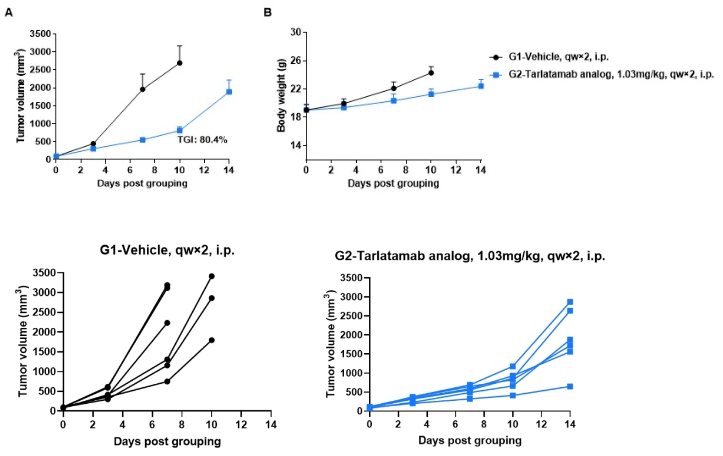
图5.(上图)抗人CD3/DLL3双特异性抗体(Tarlatamab类似物,内部合成)在B-hCD3EDG小鼠中的抗肿瘤活性;(下图)小鼠个体肿瘤生长曲线
(A) 抗人CD3/DLL3双特异性抗体抑制了B-hCD3EDG小鼠中B-hDLL3 B16-F10肿瘤的生长。将小鼠黑色素瘤细胞B-hDLL3 B16-F10皮下植入到纯合B-hCD3EDG小鼠(雌性,7-9周龄,n=6)体内。当肿瘤体积达到约100±20 mm³时,小鼠被分组,并注射抗人CD3/DLL3双特异性抗体Tarlatamab类似物(内部合成),如图所示。(B) 治疗期间体重变化。如图A所示,抗人CD3/DLL3双特异性抗体Tarlatamab类似物(内部合成)在B-hCD3EDG小鼠中对肿瘤生长具有良好的控制效果,表明B-hCD3EDG小鼠为评估抗人CD3/DLL3抗体的体内效果提供了强有力的前临床模型。数值表示为均值±SEM。
03、B-hCD3E人源化小鼠模型用于评价CD3双抗
利用B-hCD3E小鼠进行两种剂量肿瘤标志物抗体X的体内药效评价

图6.抗体X在B-hCD3E小鼠中的抗肿瘤活性分析
(A) 高剂量的抗体X在B-hCD3E小鼠(n=5)中抑制了MC38肿瘤的生长。将小鼠结肠癌MC38细胞皮下植入纯合B-hCD3E小鼠。当肿瘤体积达到约100 mm³时,对小鼠进行分组,并按照面板中显示的剂量和时间表进行抗体X的治疗(抗体由客户提供);(B) 治疗期间的体重变化。如图A所示,高剂量的抗体X有效控制了B-hCD3E小鼠中的肿瘤生长,表明B-hCD3E小鼠是抗体X体内评估的有力临床前模型。数值以平均值±SEM表示。
在两种剂量下评估肿瘤标志物抗体X的药效时,T细胞的激活情况
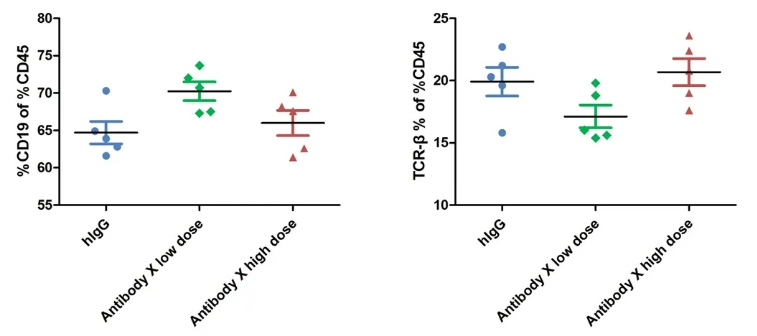
图7.通过流式细胞术检测小鼠血液中B细胞和T细胞的比例。
实验终点时,从外周血中分离淋巴细胞。在治疗组中,B细胞和T细胞的比例未发生显著变化。
利用B-hCD3E小鼠进行Blinatumomab的体内药效评价
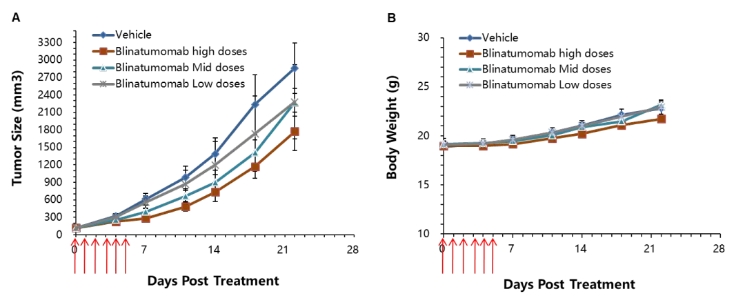
图8.将MC38-hCD19细胞皮下植入B-hCD3E小鼠中。
当肿瘤体积约为150±50 mm³时,小鼠被分为对照组和治疗组(n=6)。高剂量CD3E双特异性抗体(Blinatumomab,商业化产品)显著抑制了肿瘤的生长,证实了B-hCD3E小鼠模型是评估针对人CD3E双抗体内药效的有力工具。(A) 肿瘤平均体积 ± SEM,(B) 小鼠平均体重 ± SEM。
利用B-hCD3E小鼠进行CD3×EpCAM双抗的体内药效评价
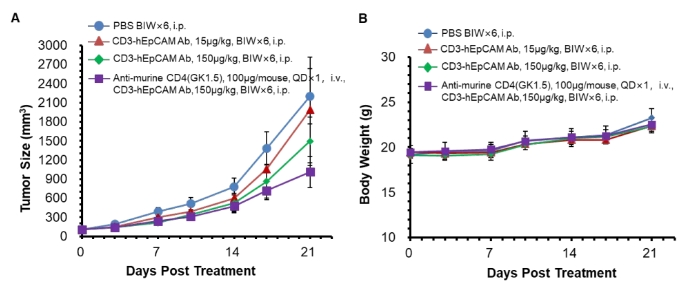
图9. 将MC38-hEpCAM细胞皮下植入B-hCD3E小鼠中。当肿瘤体积约为100±20 mm³时,小鼠被分为对照组和治疗组。结果显示,与对照组相比,客户提供的抗人CD3E/EpCAM双特异性抗体表现出中等程度的抗肿瘤活性。数据还表明,抗小鼠CD4(CD4耗竭抗体)增强了抗人CD3E/EpCAM双特异性抗体的抗肿瘤活性。
CD3双抗在自身免疫性疾病治疗的应用前景
自身免疫疾病是指机体免疫系统错误攻击自身组织,引发慢性炎症和损伤。B细胞通过产生针对自体抗原的抗体,在此过程中扮演了重要角色。由于B细胞在血液肿瘤和自身免疫疾病中共同起到关键作用,研究者开始探索靶向B细胞CD3双抗药物在自免疾病领域的潜力,靶点包括CD19、CD20、BCMA等[4]。
2024年发表的两篇文章分别报道了CD19×CD3双抗Blinatumomab作为B细胞耗竭疗法在治疗难治性类风湿关节炎和重症系统性硬化症中的应用,显示了其在这些疾病中的治疗前景[5]。近日,新格兰医学杂志报道了BCMA×CD3双抗Teclistamab临床治疗SLE患者的研究案例,及在4名患有不同自免疾病的疗效探索。8月5日,嘉和生物与TRC 2004 超4.4亿美元的海外交易合作中,提到将集中探索GB261 CD3×CD20双抗在自体免疫疾病方面的潜力。
随着研究的深入,相信CD3双抗将在肿瘤和自免治疗领域发挥更大的作用。百奥动物拥有多种CD3E/CD3EDG相关靶点人源化的小鼠模型,为更多CD3双抗在肿瘤及自免领域的药效及安全性研究提供助力。
百奥动物系列CD3E及CD3EDG靶点人源化小鼠列表
参考资料
[1] Middelburg, J., Kemper, K., Engelberts, P., Labrijn, A. F., Schuurman, J., & Van Hall, T. (2020). Overcoming Challenges for CD3-Bispecific Antibody Therapy in Solid Tumors. Cancers, 13(2), 287.
[2] Helsen, C. W., Hammill, J. A., Lau, V. W., Mwawasi, K. A., Afsahi, A., Bezverbnaya, K., Newhook, L., Hayes, D. L., Aarts, C., Bojovic, B., Denisova, G. F., Kwiecien, J. M., Brain, I., Derocher, H., Milne, K., Nelson, B. H., & Bramson, J. L. (2018). The chimeric TAC receptor co-opts the T cell receptor yielding robust anti-tumor activity without toxicity. Nature Communications, 9(1), 1-13.
[3] Li, L., Chen, X., Li, Y., & Lou, L. (2022). Pharmacological characterization of gr1803, a novel bcma × cd3 bispecific antibody for multiple myeloma treatment.
[4] Perico, L., Casiraghi, F., Sônego, F., Todeschini, M., Corna, D., Cerullo, D., Pezzotta, A., Faravelli, S., Forneris, F., Thiam, K., Benigni, A., & Remuzzi, G. (2024). Bi-specific autoantigen-T cell engagers as targeted immunotherapy for autoreactive B cell depletion in autoimmune diseases. Frontiers in Immunology, 15, 1335998.
[5] Subklewe, M., Magno, G., Gebhardt, C., Bücklein, V., Szelinski, F., Arévalo, H. J. R., Hänel, G., Dörner, T., Zugmaier, G., Von Bergwelt-Baildon, M., Skapenko, A., & Schulze-Koops, H. (2024). Application of blinatumomab, a bispecific anti-CD3/CD19 T-cell engager, in treating severe systemic sclerosis: A case study. European Journal of Cancer, 204, 114071.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号