在现代生物医学研究中,有一种特别的小鼠模型正悄然改变着我们的研究方式,带来新的科学发现,这种小鼠被称为DTR小鼠,即白喉毒素受体(Diphtheria toxin receptor, DTR)小鼠,是通过基因编辑技术将肝素结合EGF样生长因子前体的受体(proHB-EGF, 称为DTR)基因导入到小鼠的特定细胞中,从而使这些细胞对白喉毒素 (Diphtheria toxin, DT) 敏感。当研究人员给这些小鼠注射DT时,只有表达了DTR的细胞会被特异性地清除,而其他细胞则不受影响 [1]。简而言之,DTR小鼠就像一台精密的“细胞清除机器”,可以帮助研究者探索表达特定基因的一类细胞在体内具体的作用和功能。
在此基础上,报告基因EGFP (Enhanced green fluorescent protein) 和荧光素酶(Luciferase)的引入可以显著增强实验的可视化和定量分析能力。通过这种策略,研究人员可以直接观察表达DTR基因的特定细胞或组织在小鼠体内的动态变化和功能。并且通过体内成像技术(如生物发光成像),研究人员可以在活体小鼠中非侵入性地监测特定基因的表达和细胞活动。这种多功能的整合,使得EGFP-DTR-Luciferase 小鼠模型成为了解细胞功能,疾病机制以及药物作用的强大工具。
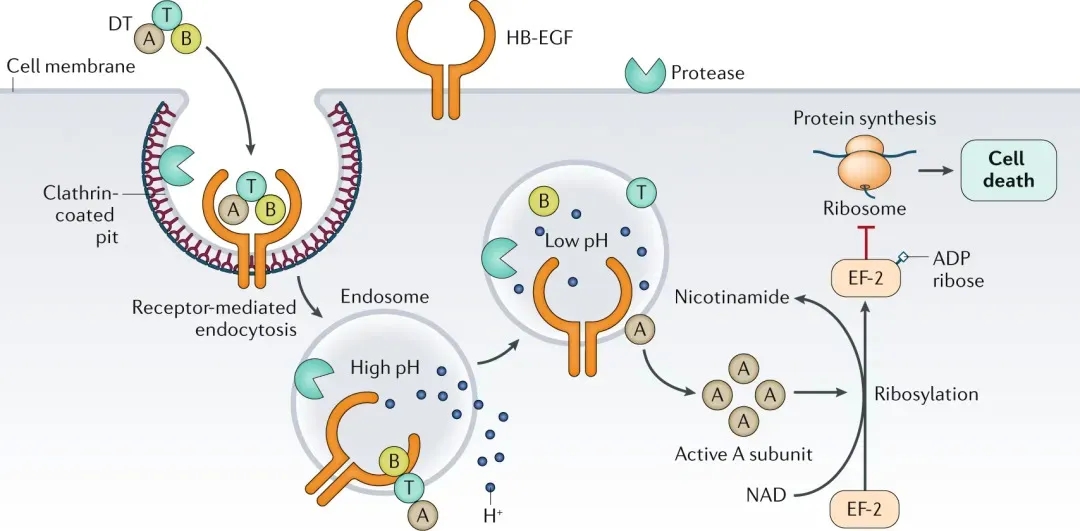
图1. DT的作用机制 [2]
DTR小鼠模型有哪些优势?
精确性:DTR小鼠模型允许研究人员在特定时间点和特定组织中选择性地清除细胞,并且减少对其他细胞的非特异性影响。
灵活性:DTR基因可以插入到多种目标基因中,可以针对不同的研究需求进行定制。
实时性:通过报告基因的引入可以实时观察到细胞清除后动态的生理和病理变化。
可逆性:在停止注射DT一段时间后,可以观察细胞在清除后再生和细胞功能恢复的情况,加深对细胞功能的理解,并且可以用于再生医学领域的研究。
高效性:独特的细胞清除机制能够避免传统基因敲除过程中可能导致的胚胎致死或发育缺陷,确保小鼠正常发育,便于进行长期研究。
DTR小鼠模型有哪些应用?
研究特定细胞类型的功能和作用
传统的基因敲除或敲入模型通常是全身性的,难以实现对特定细胞类型的精确操作。而DTR小鼠模型将EGFP-DTR-Luciferase插入到特定目的基因的启动子后面选择性地消除特定细胞,例如免疫细胞、神经细胞和肿瘤细胞等,揭示它们在免疫反应、神经系统和肿瘤微环境中的重要性 [3]。Thierry Walzer等人在NK细胞的特异的标记基因NKp46启动子后面插入了DTR-EGFP,成功建立了特异性清除NK细胞的转基因小鼠模型,并且证实这种NK细胞特异性清除具有可逆性 [4]。
建立疾病模型和研究治疗策略
在了解与疾病相关细胞的作用和功能后,利用DTR小鼠模型对一类细胞的完全清除可以建立多种疾病模型,如癌症、自身免疫性疾病和神经退行性疾病等,用于研究疾病的发病机制、进展和相关生物标志物,为新药物和治疗方法的开发提供重要的理论基础和实验依据。Yao Wang等人利用Foxp3-DTR-EGFP小鼠模型进行实验,结果表明Tregs细胞清除加剧了由双位溶血磷脂酰胆碱(LPC)诱导的髓鞘损伤、炎症反应和细胞炎性坏死,并成功揭示了作用机制,为相应的神经损伤性疾病的治疗带来了希望[5]。
疾病治疗的候选表位筛选
基于DTR小鼠模型,不仅可以探索疾病的发病机制,还可以通过对照实验确定一类细胞对能够启动免疫反应的特定表位的影响,以支持疾病候选表位的开发。例如Divya Sagar等人利用HLA-A2/DTR小鼠模型对抗HTLV-1疫苗进行评估,结果表明树突状细胞能够支持Tax(11-19) 表位对抗原特异性CD8+ T细胞免疫反应的启动 [6]。
针对上述功能,百奥动物开发了一系列DTR小鼠模型,通过在不同基因插入DTR以及报告基因得到具有示踪功能的不同细胞类型的选择性清除模型。
百奥动物DTR小鼠模型列表
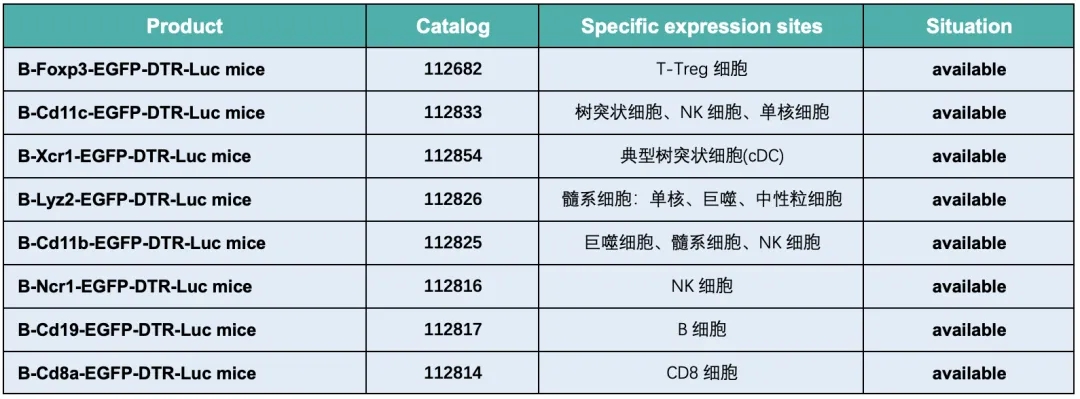
百奥动物还有更多其他相关模型正在开发中,例如针对M2型巨噬细胞、浆细胞样树突状细胞的DTR小鼠模型,敬请期待!
DTR小鼠模型案例分享
B-Foxp3-EGFP-DTR-Luc mice
脾脏白细胞亚群分析
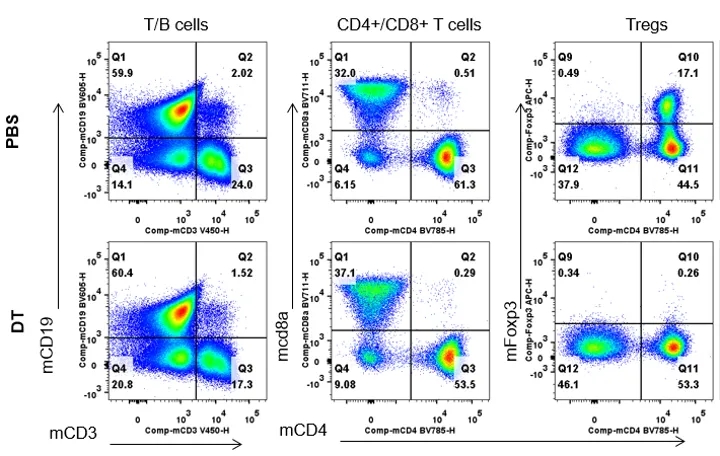
从连续两天注射PBS或DT的雄性B-Foxp3-EGFP-DTR-Luc小鼠(n=3, 7月龄)体内分离脾细胞,并通过流式细胞术对脾脏细胞进行分析,以评估白细胞亚群。
淋巴结白细胞亚群分析
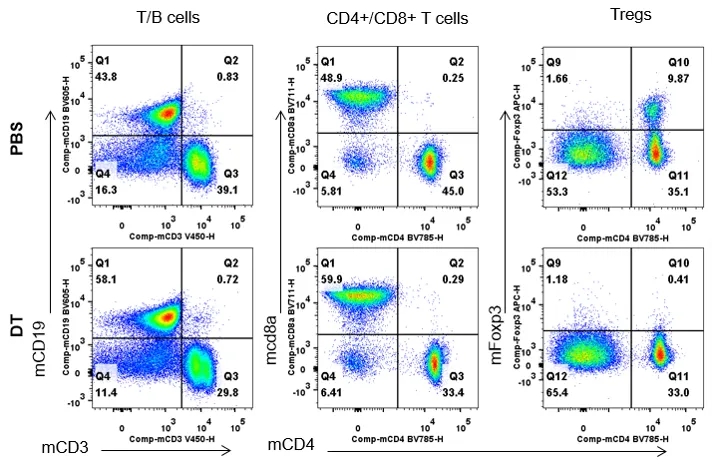
从连续两天注射PBS或DT的雄性B-Foxp3-EGFP-DTR-Luc小鼠(n=3, 7月龄)体内分离淋巴结,并进行FACS分析,以评估白细胞亚群。
脾脏EGFP表达情况分析
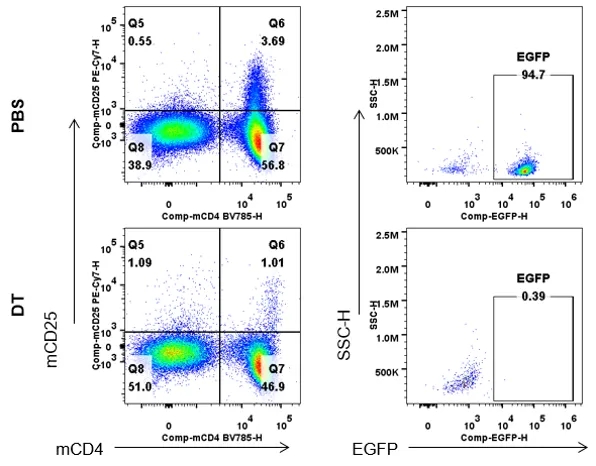
从连续两天注射PBS或DT的雄性B-Foxp3-EGFP-DTR-Luc小鼠(n=3, 7月龄)体内分离脾细胞,并通过流式细胞术对脾脏细胞进行分析,以评估EGFP表达。
B-Foxp3-EGFP-DTR-Luc小鼠注射DT后BLI分析
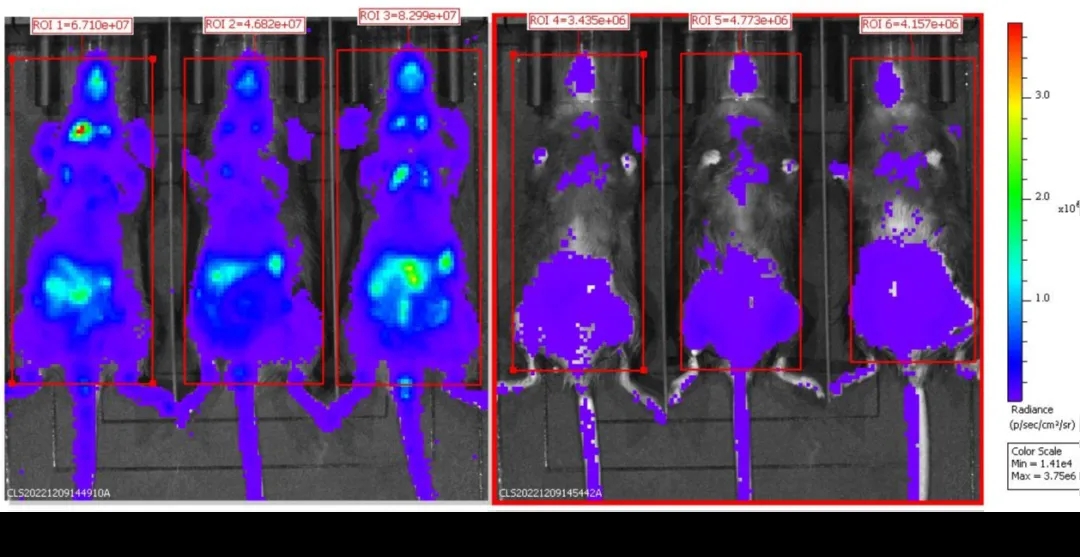
连续两天注射PBS(n=3)或DT(n=3)的B-Foxp3-EGFP-DTR-Luc小鼠被麻醉后进行生物发光成像。小鼠静脉注射 150mg/kg的D-Lucifenrin钾盐10分钟后,使用IVIS Lumina LT Inst Series III进行成像。
结果显示,B-Foxp3-EGFP-DTR-Luc小鼠的Treg细胞比例与野生型小鼠相当;只在Foxp3-EGFP-DTR-Luc小鼠的CD4+和CD25+细胞群中检测到EGFP,可作为体内Treg细胞的标记物;此外,生物发光成像也可用于追踪Tregs细胞,注射DT后,Treg细胞在EGFP、Foxp3和生物发光成像水平上都显著减少。
DTR小鼠模型的出现,为生物医学研究提供了一种强大而灵活的工具,它不仅提高了研究的精确性和效率,还开创了新的研究方向。
参考文献
1. Ruedl, Christiane, and Steffen Jung. “DTR-mediated conditional cell ablation-Progress and challenges.” European Journal of Immunology vol. 48,7 (2018): 1114-1119.
2. Sharma, Naresh C., et al. "Diphtheria." Nature Reviews Disease Primers vol. 5,1(2019): pp. 1-18
3. Van Blijswijk, Janneke, et al. “Advantages and limitations of mouse models to deplete dendritic cells.” European Journal of Immunology vol. 43,1 (2013): 22-6.
4. Walzer, Thierry, et al. “Identification, activation, and selective in vivo ablation of mouse NK cells via NKp46.” Proceedings of the National Academy of Sciences of the United States of America vol. 104,9 (2007): 3384-9.
5. Wang, Y., Sadike, D., Huang, B. et al. Regulatory T cells alleviate myelin loss and cognitive dysfunction by regulating neuroinflammation and microglial pyroptosis via TLR4/MyD88/NF-κB pathway in LPC-induced demyelination. J Neuroinflammation vol. 20,41 (2023).
6. Sagar, Divya et al. “In vivo immunogenicity of Tax (11-19) epitope in HLA-A2/DTR transgenic mice: implication for dendritic cell-based anti-HTLV-1 vaccine.” Vaccine vol. 32,26 (2014): 3274-84.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号