黄斑是视网膜的一部分,具有高水平的感光细胞,负责中央视觉。年龄相关性黄斑变性(Age-related macular degeneration, AMD)是一种与黄斑老化有关的退行性疾病,会影响眼睛的后节并损害黄斑,可在老年人中发展为视力损伤甚至失明。晚期AMD分为干性AMD(萎缩型GA,占比80-90%)和湿性AMD(渗出型,也称新生血管性AMD,占比10-20%)[1],其中90%左右的严重视力丧失是由湿性AMD所致。全球约有2亿AMD患者,随着人口老龄化,预计到2040年这一数字将增加至2.88亿;据Globaldata预测,至2031年全球AMD市场规模将达275亿美元。
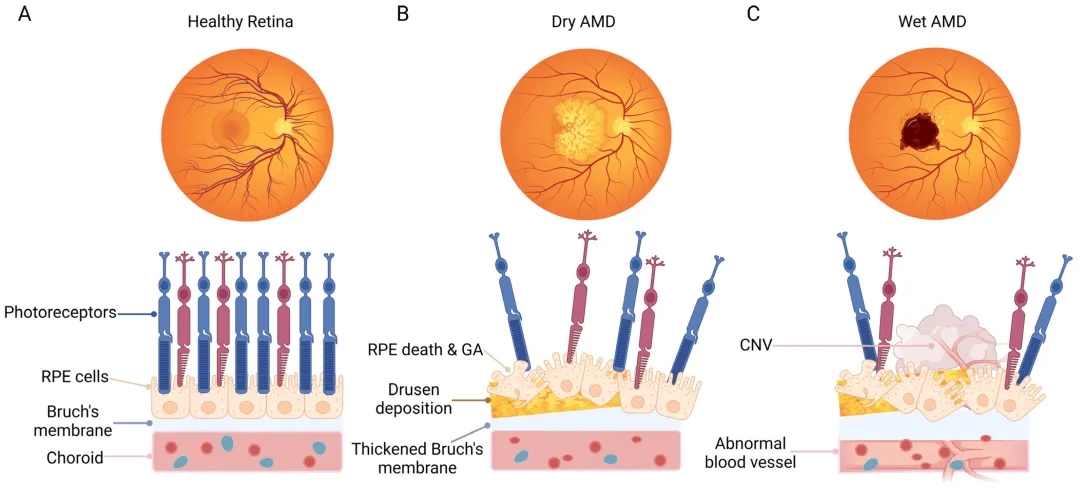
图1. 正常受试者和患有干性AMD或湿性AMD的患者的眼底和黄斑细胞组织的示意图[2]。
AMD治疗新药研究进展
在干性 AMD 中,黄斑中的光感受器和视网膜色素上皮 (RPE) 细胞的丧失会导致视网膜组织萎缩,晚期阶段RPE 变性变得融合,视力丧失加剧,这被称为地图状萎缩 (Geographic atrophy, GA) [3]。GA的发展与补体级联有关,C3和C5及其他补体因子是GA的潜在治疗靶点。Apellis开发的C3补体抑制剂Pegcetacoplan(商品名:Syfovre)是首款获批上市治疗GA的药物,2023年2月上市后全年销售额就达到了2.75亿美元,3期临床OAKS试验中12个月后每月注射组GA病变面积增长减少22%;2023年8月,安斯泰来旗下Iveric Bio开发的C5抑制剂Izervay获FDA批准上市,此前的3期临床试验GATHER1中12个月后每月注射组GA病变面积增长降低了27.4%。这两款药物是目前GA唯一获批的治疗药物,但药效仍有提升的空间。
在湿性 AMD 中,视网膜和黄斑下会形成脉络膜新生血管 (CNV) ,CNV的生成和水肿会破坏上层结构,包括 Bruch 膜、RPE 和光感受器,导致局灶性视网膜脱离和视力丧失。血管内皮生长因子VEGF抑制剂被证明是临床治疗nAWD的有效药物。
最早2006年上市的雷珠单抗(商品名:Lucentis)由罗氏开发,上市后销售额一路飙升,但需每月一次玻璃体内注射给药,患者依从性较差,亟需长效药物的开发。2011年由再生元和拜耳联合开发的全人源VEGF融合蛋白阿柏西普(商品名:Eylea)获批上市,仅需每两月一次给药,2015年销售额首超雷珠单抗,至今一直保持全球领先地位,2023年全球销售额为93.8亿元。2022年罗氏眼科新药VEGFA×Ang2双抗 法瑞西单抗(商品名:Vabysmo)在美获批上市,并以每4个月一次给药的优势成为Eylea的强有力对手,2023年再生元/拜耳推出Eylea高剂量HD版本,较Elyea可延长至每4个月给药一次,试图保持其市场地位。
表1.AMD已上市生物药
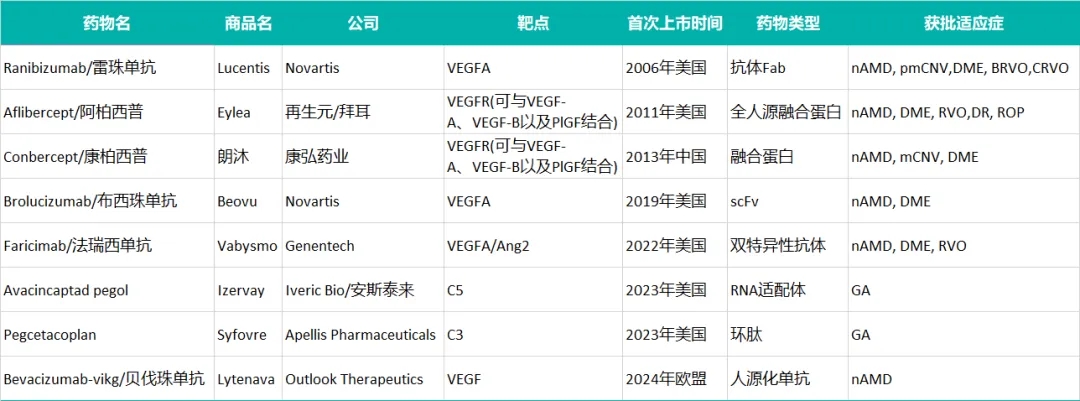
数据来源:Cortellis及公开数据整理
随着雷珠单抗和阿柏西普专利到期,眼科VEGF单抗治疗市场竞争将异常激烈,且部分nAWD患者接受VEGF单药治疗的效果并不理想,双/多靶点药物、基因治疗等新型长效疗法开发及新治疗靶点的选择会是新的潜在市场机会。Adverum公司开发的基因疗法Ixo-vec使用专有载体衣壳AAV.7m8,携带受专有表达盒控制的阿柏西普编码序列,期望一次注射达到长久的疗效,2期LUNA初步结果显示分别有85%和68%的2E11和6E10剂量的患者在26周内没有接受任何补充注射。2024年5月,默沙东以30亿美金收购眼科公司EyeBio,获得其一款三特异性Wnt激动剂抗体,该抗体通过激活Wnt通路来恢复和维持血视网膜屏障,消除视网膜血管疾病的渗漏。国内信达生物布局一款VEGFR/CR1双靶点融合蛋白,处于3期临床阶段,2期结果显示第40周时,IBI302 6.4 mg组与8.0 mg组研究眼BCVA较基线改善值非劣效于阿柏西普2.0 mg组。
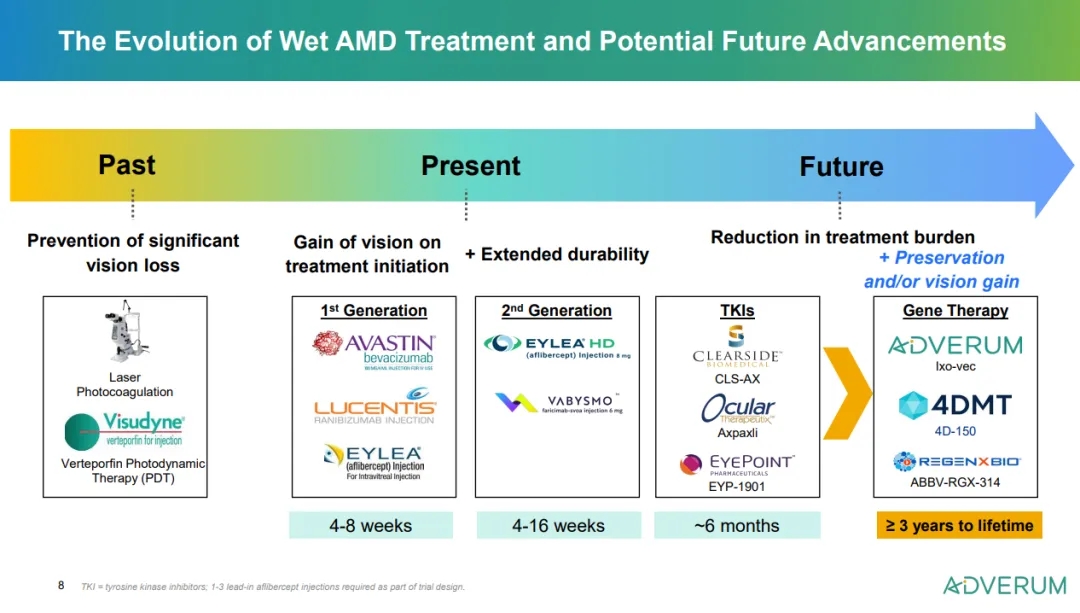
图2. nAMD治疗药物发展及前景(来源:Adverum官网)
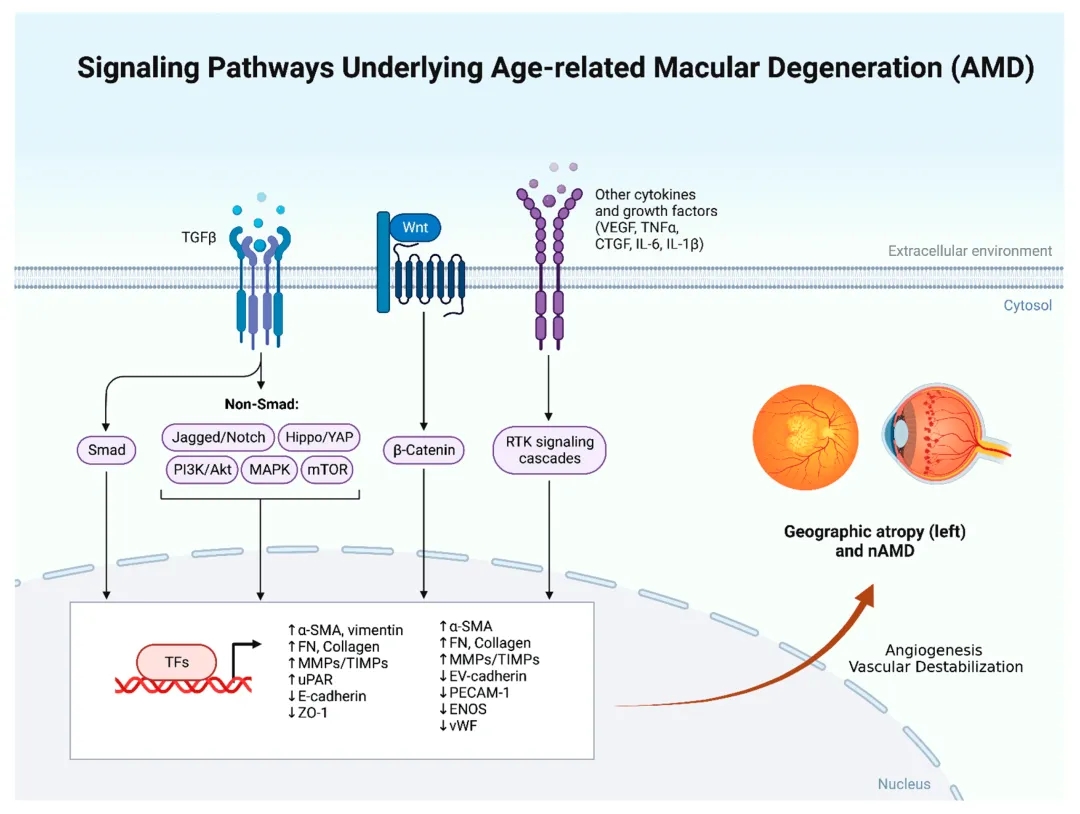
图3. AMD发展所涉及的病理生理机制[4]
AMD靶点人源化小鼠及自发CNV动物模型
百奥动物自主开发了系列AMD及眼科相关靶点人源化小鼠,以及自发wAMD眼病模型,用于相关药物的临床前药理药效研究。
01、VEGFA x ANG2双抗在B-hVEGFA小鼠或B-hANG2小鼠中的体内药效
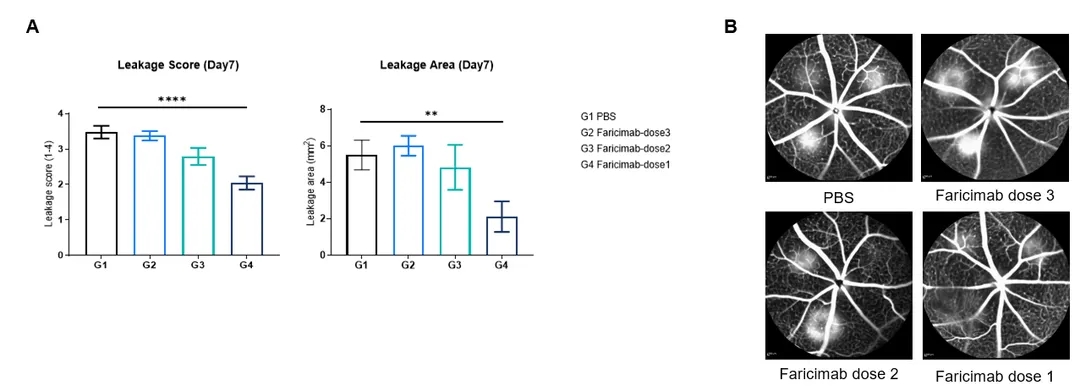
图1.VEGFA x ANG2双抗在B-hVEGFA小鼠中的体内药效。激光诱导B-hVEGFA mice构建脉络膜新生血管(choroidal neovascularization,CNV)模型。CNV是wAMD的主要病理特征。将CNV小鼠分成4组(每组4只小鼠,雌性,6-7周龄)。经眼玻璃体给药不同剂量(intravitreal treatment, IVT)VEGFA x ANG2双抗faricimab或对照PBS。所有小鼠在第7天接受荧光素眼底血管成像造影(fluorescein fundus angiography,FFA)检查并进行评分。(A)治疗后各小鼠的渗漏评分及面积。(B)各小鼠的眼底FFA成像。数值为平均值±SEM。*P < 0.05, **P < 0.01: One-Way ANOVA统计。(客户数据)
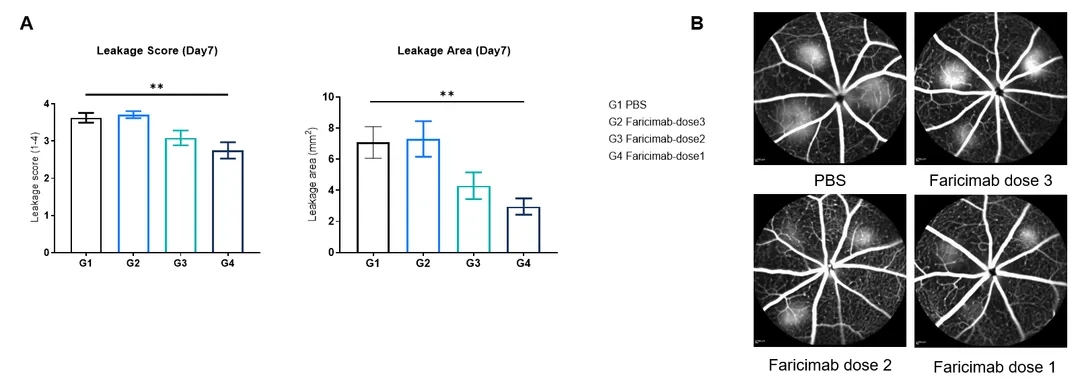
图2.VEGFA x ANG2双抗在B-hANG2小鼠中的体内药效。激光诱导B-hANG2小鼠构建CNV疾病模型,并分成4组(每组4只小鼠,雌性,6-7周龄)。眼内不同剂量注射(intravitreal treatment, IVT)VEGFA x ANG2双抗Faricimab或对照PBS。所有小鼠在第7天接受荧光素眼底血管成像造影(fluorescein fundus angiography,FFA)检查并进行评分。(A)治疗后各小鼠的渗漏评分及面积。(B)各小鼠的眼底FFA成像。数值为平均值±SEM。*P < 0.05, **P < 0.01: One-Way ANOVA统计。(客户数据)
02、使用B-Tg(hVEGFA)小鼠构建自发CNV疾病模型
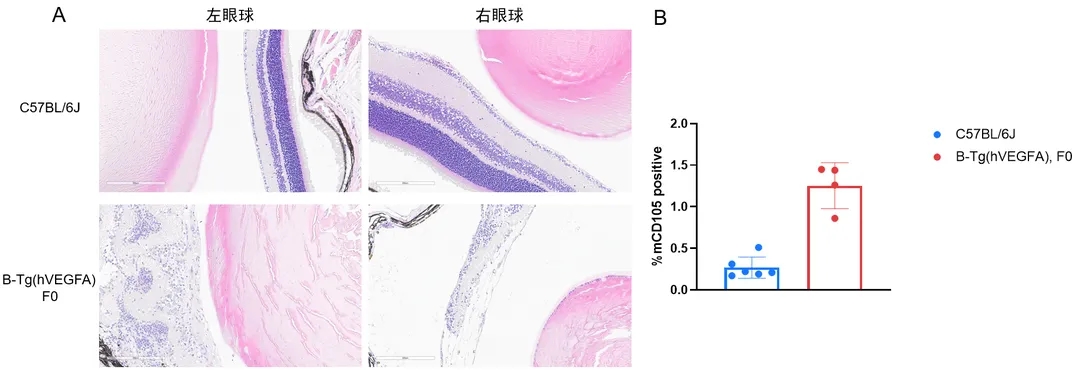
图3.自发CNV模型构建。(A) 野生鼠眼球镜下均未见异常改变。而B-Tg(hVEGFA)小鼠眼球可见不同程度的视网膜层次紊乱,萎缩/变性,外核层、外网层等多层结构消失。部分动物视网膜与脉络膜间疑似内皮细胞、成纤维细胞等细胞增生,部分动物晶状体变性混浊或缺失。(B) CD105属于转化生长因子受体,只表达于处于增殖状态的血管内皮细胞,而正常血管内皮细胞无表达,因此CD105可以很好地用于反映CNV生成情况的变化。根据CD105免疫组化结果统计,野生型小鼠CD105低表达,而B-Tg(hVEGFA)小鼠中CD105表达显著升高。
03、B-hC3小鼠的表达检测及血生化检测
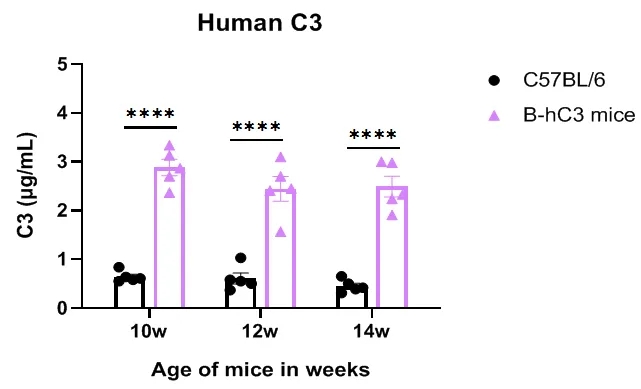
图4.通过ELISA分析纯合B-hC3小鼠中种属特异性C3表达。从不同周龄(包括10、12和14周龄)的纯合B-hC3小鼠(H/H)采集血清,并用物种特异性抗C3抗体通过ELISA进行分析。在纯合B-hC3小鼠中可检测到人C3。人C3的表达不会随着年龄的增长而发生显著变化。(*p<0.05、***p<0.001、****p<0.0001)
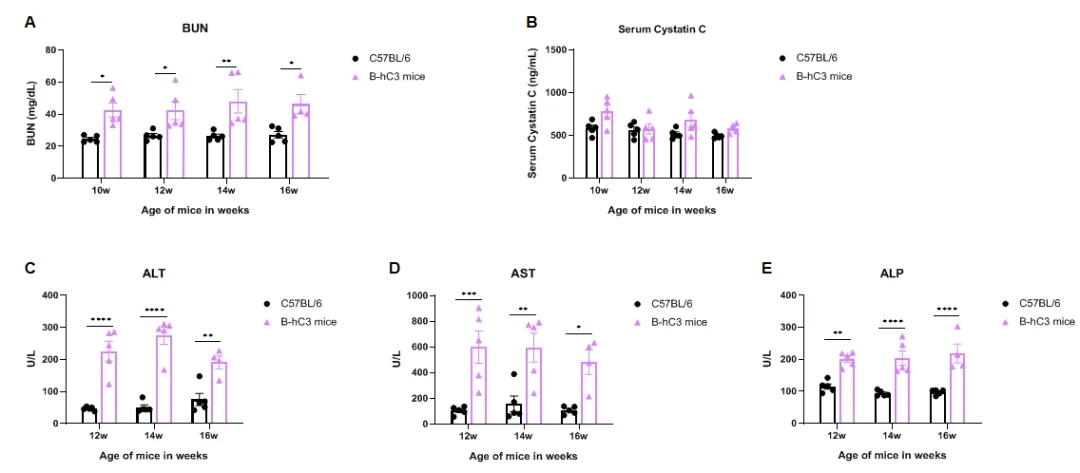
图5.B-hC3小鼠和WT的血液生化分析。从野生型小鼠 (+/+)和纯合B-hC3小鼠 (H/H) 采集血清并进行生化分析。生化分析显示,B-hC3小鼠的BUN和sCysC显著升高(10w和14w)。B-hC3小鼠的肝损伤标志物也显著升高,例如丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶 (AST)和碱性磷酸酶 (ALP)。(*p<0.05,***p<0.001, ****p<0.0001)
04、B-hC5/hC5AR1小鼠的表达检测
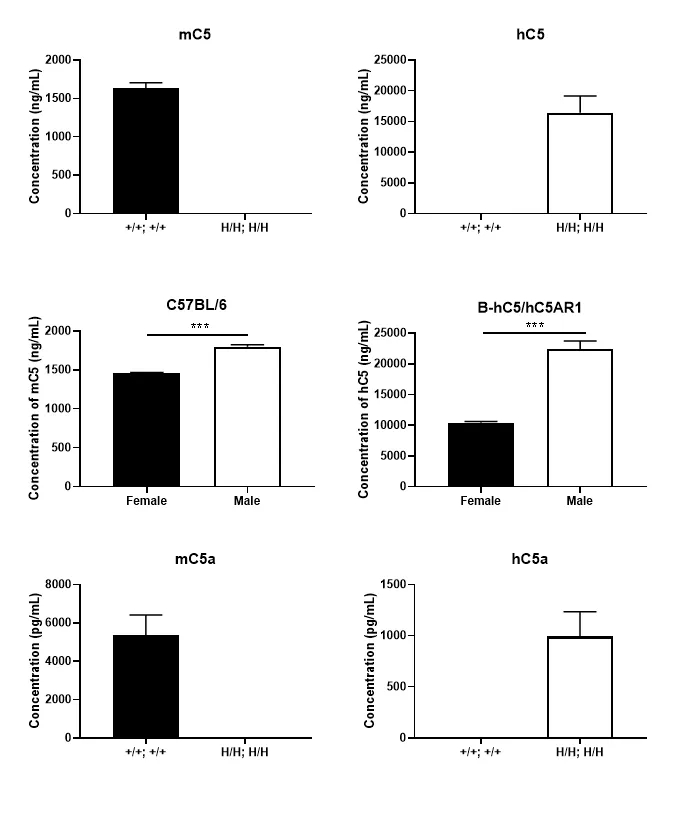
图6.通过ELISA分析纯合B-hC5/hC5AR1小鼠中种属特异性C5和C5a 表达。从野生型 C57BL/6 小鼠 (+/+; +/+)或纯合B-hC5/hC5AR1小鼠 (H/H; H/H) 采集血清,并使用抗C5和抗C5a抗体通过ELISA进行分析。A.在野生型小鼠中可检测到小鼠C5和C5a。人C5 和C5a仅在纯合B-hC5/hC5AR1小鼠中可检测到,但在野生型小鼠中未检测到。B. 雄性小鼠的C5浓度高于雌性小鼠。
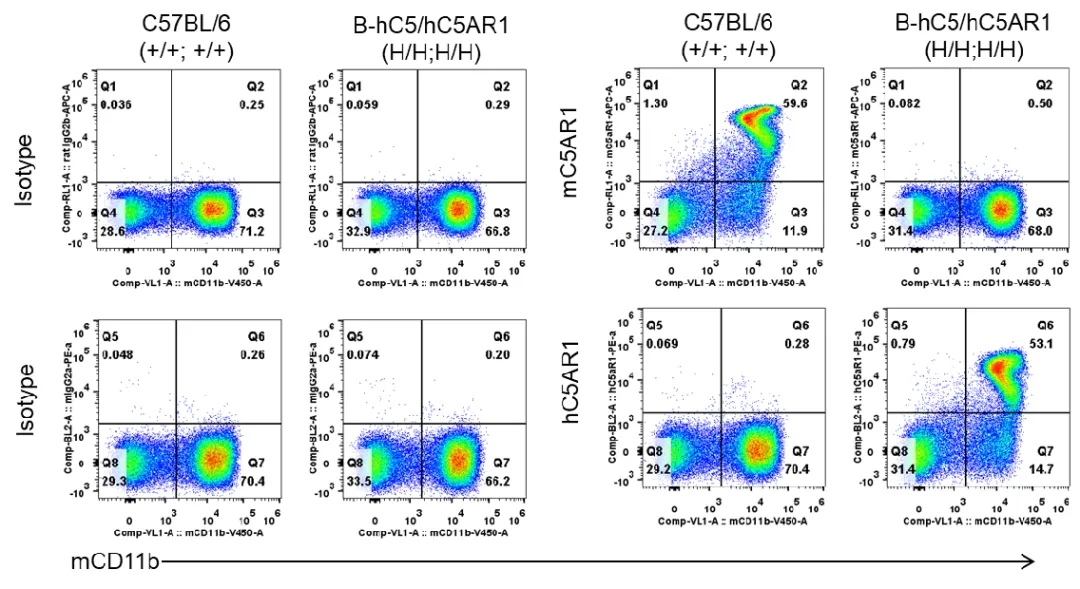
图7.通过FACS分析纯合B-hC5/hC5AR1小鼠中种属特异性C5AR1表达。从野生型C57BL/6 小鼠 (+/+; +/+) 和纯合B-hC5/hC5AR1小鼠 (H/H; H/H) 收集骨髓,并使用抗C5AR1抗体通过FACS进行分析。小鼠C5AR1仅在野生型小鼠中可检测到。人C5AR1仅在纯合B-hC5/hC5AR1小鼠中可检测到,但在野生型小鼠中未检测到。
百奥动物AMD及眼科相关靶点人源化小鼠列表

参考资料
[1] Fabre M, Mateo L, Lamaa D, Baillif S, Pagès G, Demange L, Ronco C, Benhida R. Recent Advances in Age-Related Macular Degeneration Therapies. Molecules. 2022; 27(16):5089.
[2] Qu S, Lin H, Pfeiffer N, Grus FH. Age-Related Macular Degeneration and Mitochondria-Associated Autoantibodies: A Review of the Specific Pathogenesis and Therapeutic Strategies. International Journal of Molecular Sciences. 2024; 25(3):1624.
[3] Thomas, C. N., Sim, D. A., Lee, W. H., Alfahad, N., Dick, A. D., Denniston, A. K., & Hill, L. J. (2022). Emerging therapies and their delivery for treating age-related macular degeneration. British Journal of Pharmacology, 179(9), 1908-1937.
[4] ElSheikh RH, Chauhan MZ, Sallam AB. Current and Novel Therapeutic Approaches for Treatment of Neovascular Age-Related Macular Degeneration. Biomolecules. 2022; 12(11):1629.
[5] 华创证券:AMD医药行业深度研究报告






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号