肾脏疾病已成为全球性的公共卫生问题,通常与高发病率和死亡率相关。肾脏疾病的患病率持续上升,目前全世界约有 8.5 亿人患有各种肾脏疾病[1]。基于疾病持续时间,肾脏疾病通常分为两种不同的综合征:急性肾损伤(AKI)和 慢性肾病(CKD)[2]。在临床上,AKI 和 CKD 密切相关,并且它们共享许多共同的风险因素,例如高龄、糖尿病、高血压等[2-4]。流行病学研究表明,AKI 和 CKD 互为风险因素[5,6]。尽管现在人们认识到 AKI 是导致 CKD 甚至终末期肾病 (ESKD) 的重要风险因素,但 AKI 对 CKD 发病率的贡献程度仍不清楚。AKI 转化为 CKD 或 AKI 与 CKD 并存的病理学,以及许多严重的并发症和共病,给特定综合征的建模、诊断和治疗带来了挑战。
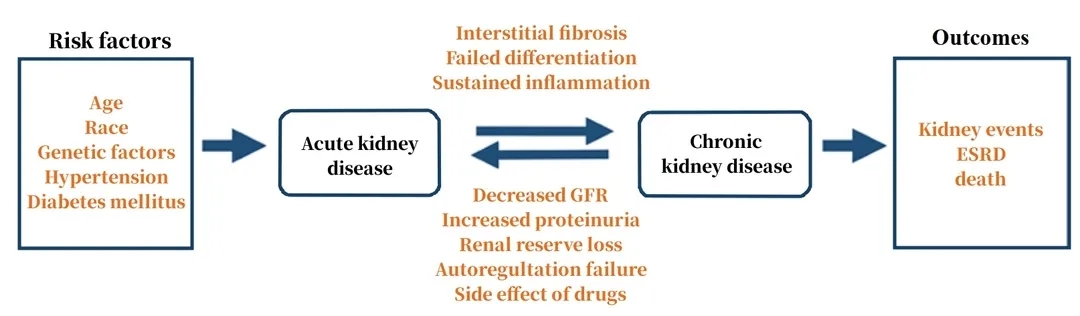
图1 急性肾损伤(AKI)和 慢性肾病(CKD)之间的关系[7]
动物模型对于理解肾脏疾病的病理生理学以及为新的治疗方法提供可靠的测试系统至关重要。迄今为止人们已经开发出许多用于 AKI 和 CKD 的实验动物模型,其中啮齿类动物中的小鼠是最常用的物种。
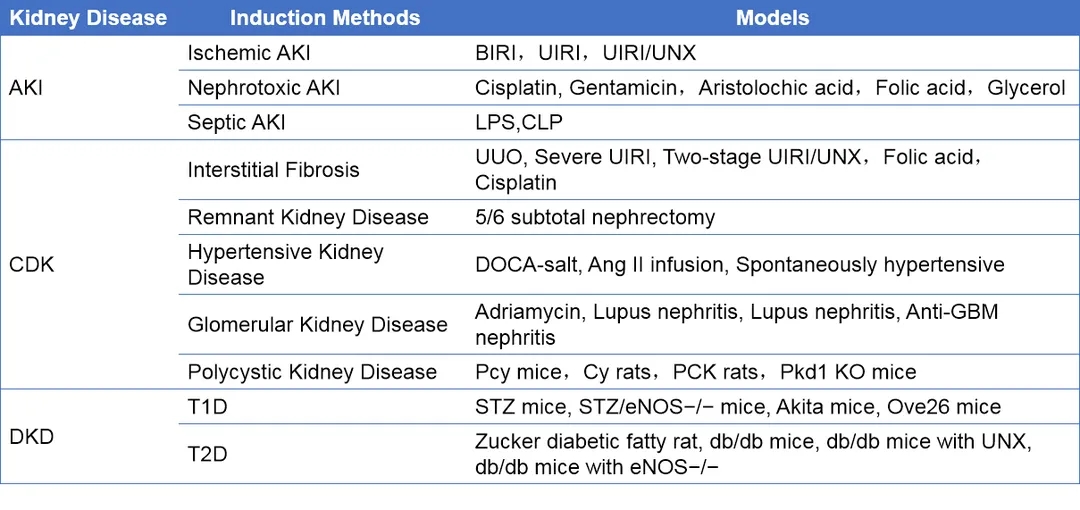
表1 肾脏疾病动物模型列表[8]
百奥赛图目前已经开发出多种肾脏疾病动物模型,包括多种慢性肾病和糖尿病肾病模型。
部分数据展示
5/6肾脏切除诱导慢性肾病模型
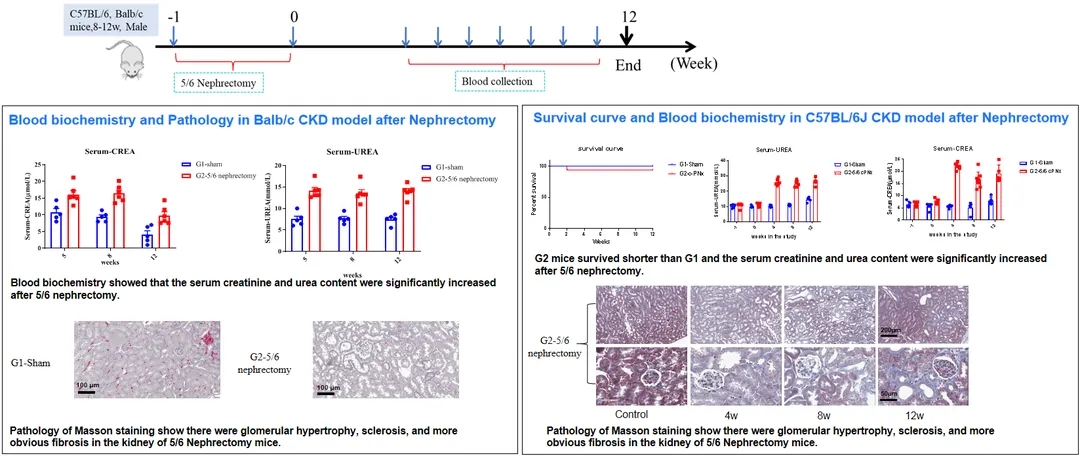
在Balb/c小鼠和C57BL/6小鼠上分别进行5/6肾脏切除手术,造模后小鼠血清肌酐和尿素氮水平显著升高。肾脏病理染色结果显示,造模组小鼠出现肾小球肥大,纤维化明显增多。
草酸盐肾病模型
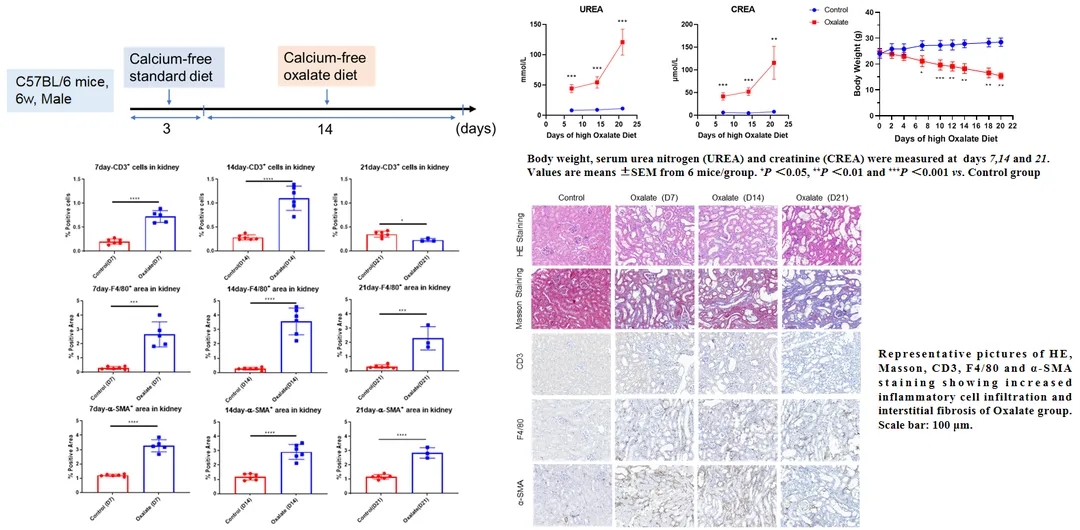
在C57BL/6小鼠上用草酸盐饮食诱导结晶性肾病,造模后小鼠血清肌酐和尿素氮水平显著升高。肾脏病理染色结果显示,造模组小鼠肾小管出现大量结晶,纤维化明显增多,免疫组化染色结果显示,炎症(CD3,F4/80)及纤维化标志物(α-SMA)表达显著上调。
Pristance诱导的SLE模型
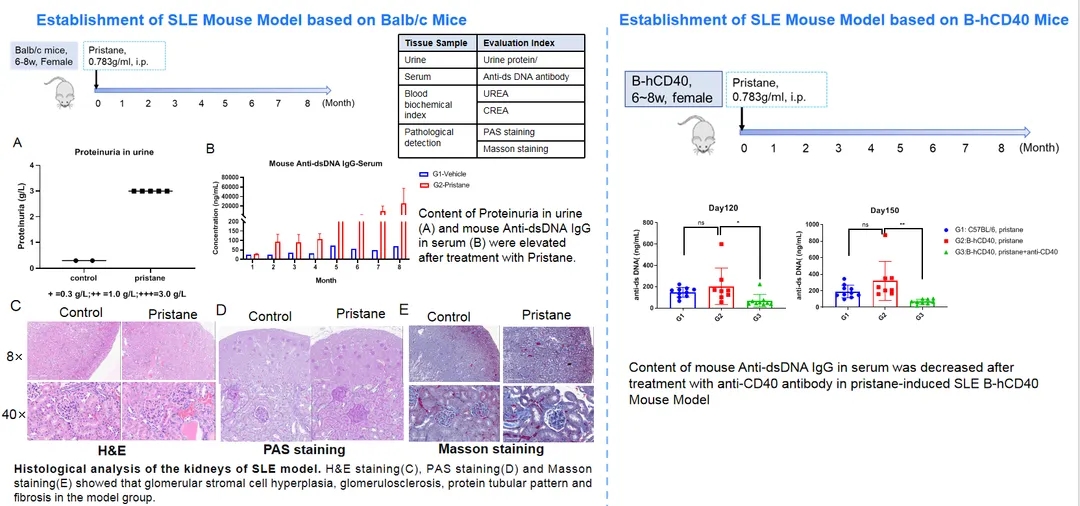
Balb/c小鼠用Pristance诱导后,尿蛋白含量显著升高,血清中anti-dsDNA含量显著升高。肾脏病理染色结果显示,肾小球基质细胞增生,肾小球硬化,纤维化增强。在B-hCD40人源化小鼠中,Pristance诱导造模后,用抗人CD40抗体治疗,可以显著改善血清中的anti-dsDNA含量。
自发型SLE模型
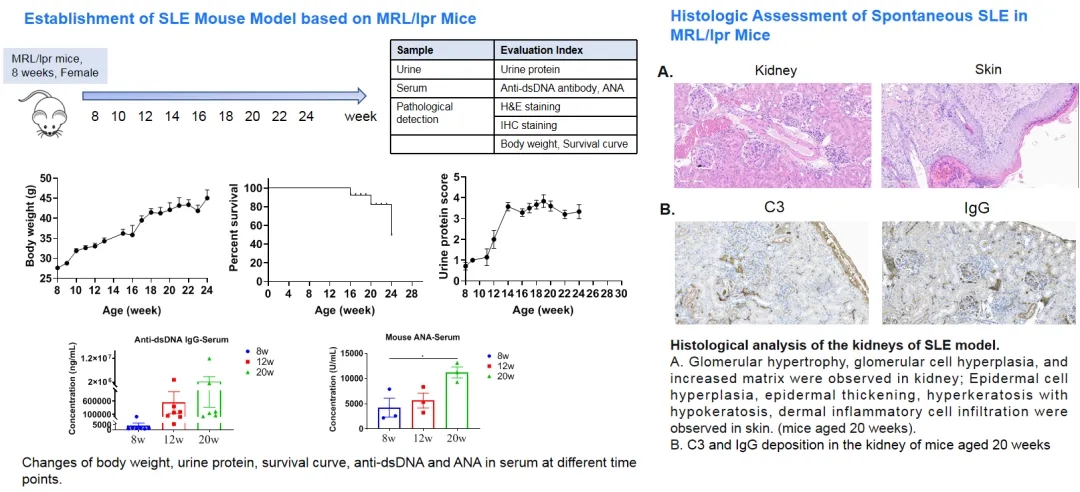
MRL/lpr自发SLE小鼠尿蛋白含量显著升高,血清中anti-dsDNA,抗核抗体含量显著升高。在肾脏中观察到肾小球肥大、肾小球细胞增生和基质增加,以及C3和IgG的沉积;在皮肤中观察到表皮细胞增生、表皮增厚、角化过度伴角化不全、真皮炎性细胞浸润等。
糖尿病肾病模型
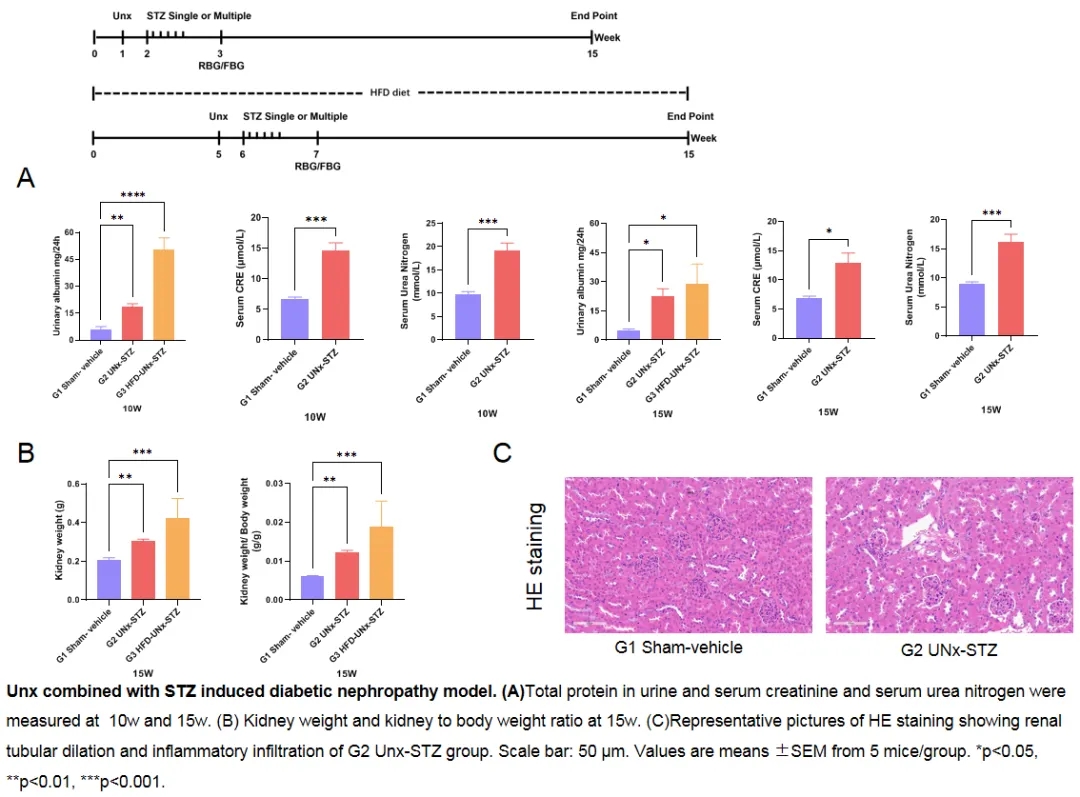
单侧肾切除联合STZ诱导糖尿病肾病模型,造模后可以检测到血清中肌酐和尿素氮水平的升高。收集24小时尿,可以观察到尿蛋白水平显著升高,尿液中肌酐和尿素氮水平显著升高。肾脏病理染色结果可见肾脏肾小管扩张,炎细胞浸润,肾小球肥大等表型。
欢迎联系我们,获取更多实验数据。
参考资料
[1] Foreman, Kyle J et al. “Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for 2016-40 for 195 countries and territories.” Lancet (London, England) vol. 392,10159 (2018): 2052-2090. doi:10.1016/S0140-6736(18)31694-5
[2] Chawla, Lakhmir S et al. “Acute kidney injury and chronic kidney disease as interconnected syndromes.” The New England journal of medicine vol. 371,1 (2014): 58-66. doi:10.1056/NEJMra1214243
[3] Kalantar-Zadeh, Kamyar et al. “Chronic kidney disease.” Lancet (London, England) vol. 398,10302 (2021): 786-802. doi:10.1016/S0140-6736(21)00519-5
[4] Ronco, Claudio et al. “Acute kidney injury.” Lancet (London, England) vol. 394,10212 (2019): 1949-1964. doi:10.1016/S0140-6736(19)32563-2
[5] See, Emily J et al. “Long-term risk of adverse outcomes after acute kidney injury: a systematic review and meta-analysis of cohort studies using consensus definitions of exposure.” Kidney international vol. 95,1 (2019): 160-172. doi:10.1016/j.kint.2018.08.036
[6] Pannu, Neesh. “Bidirectional relationships between acute kidney injury and chronic kidney disease.” Current opinion in nephrology and hypertension vol. 22,3 (2013): 351-6. doi:10.1097/MNH.0b013e32835fe5c5
[7] Bao, Yin-Wu et al. “Kidney disease models: tools to identify mechanisms and potential therapeutic targets.” Zoological research vol. 39,2 (2018): 72-86. doi:10.24272/j.issn.2095-8137.2017.055
[8] Liang, Jianqing, and Youhua Liu. “Animal Models of Kidney Disease: Challenges and Perspectives.” Kidney360 vol. 4,10 (2023): 1479-1493. doi:10.34067/KID.0000000000000227






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号