小核酸药物又称寡核苷酸(oligonucleotide)药物,可以主要分为反义寡核苷酸(ASO)、小干扰RNA(siRNA)、小激活RNA(saRNA)、微小RNA (miRNA)、适配体RNA(Aptamer RNA)、CpG寡核苷酸(CpG oligonucleotide)等,它们通过与核酸(RNA或DNA)相互作用来调节基因表达,从而在遗传或分子水平上起作用,具有显著的特异性、易于设计、开发周期缩短、目标谱系广泛以及药效持久等优点。
近年来,继小分子药物和抗体药物浪潮之后,小核酸药物异军突起,成为当代生物制药研究焦点之一。截至目前,全球范围内有近200个核酸药物处于临床试验阶段,有19款小核酸药物获批上市,其中11款ASO药物、6款siRNA药物和1款核酸适配体药物,治疗领域主要集中在神经系统疾病、心血管疾病、代谢类疾病、眼科疾病等。[1]
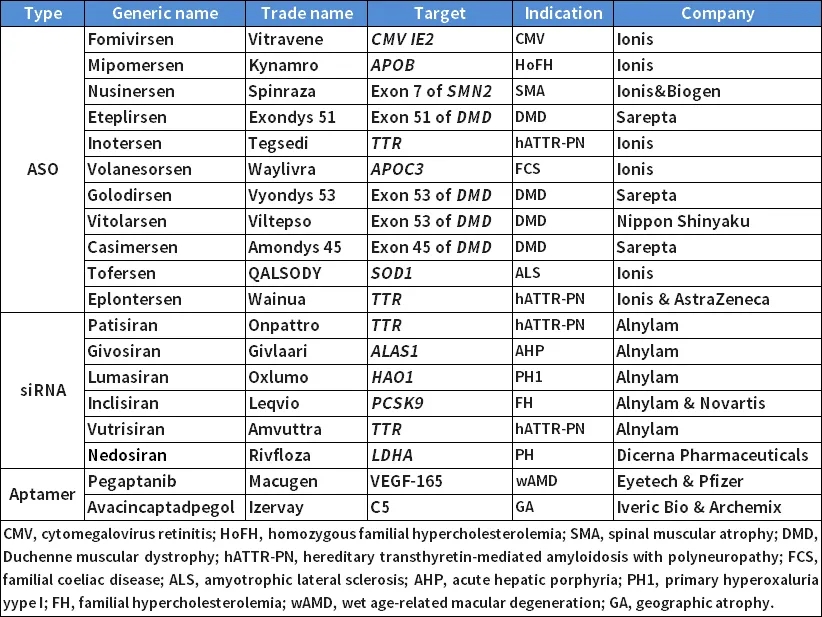
针对小核酸药物临床前研究的特点,百奥动物开发了一系列可适应其药物开发的人源化小鼠,推动更多安全有效的核酸药物研发。
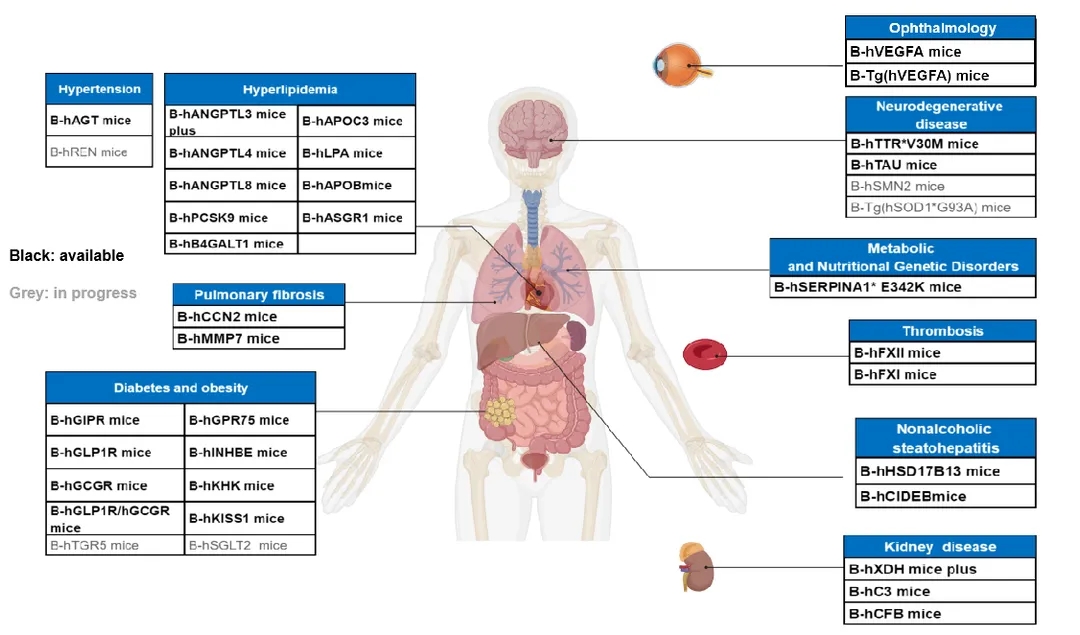
小核酸领域人源化小鼠产品列表
动物模型案例分享
B-hCFB mice
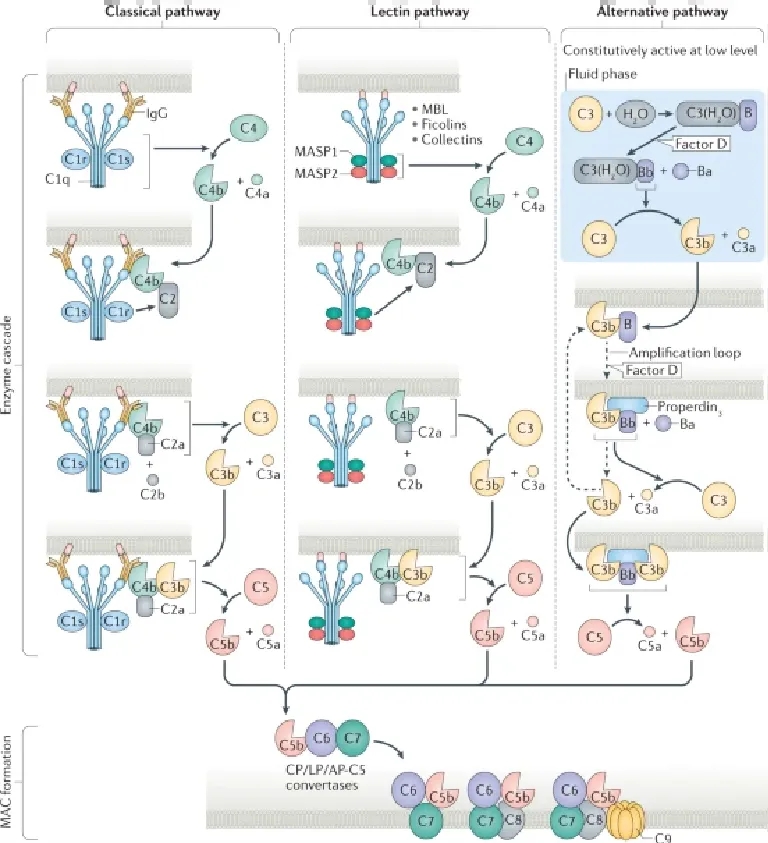
替代途径与经典和凝集素途径的不同之处在于,它会自发且持续地以低速活动,并且其激活可以被放大。该途径涉及因子D,它在正常血液中主要以其活性形式存在,以及唯一已知的补体系统的积极调节器——固定素。替代途径C3转化酶的初始组装效率取决于病原体细胞壁内末端糖的密度或结合C3b微环境内自身末端唾液酸的密度。将额外的C3b与现有的替代途径C3转化酶结合,产生C5转化酶,导致C5a和C5b的产生。[2]
蛋白表达分析
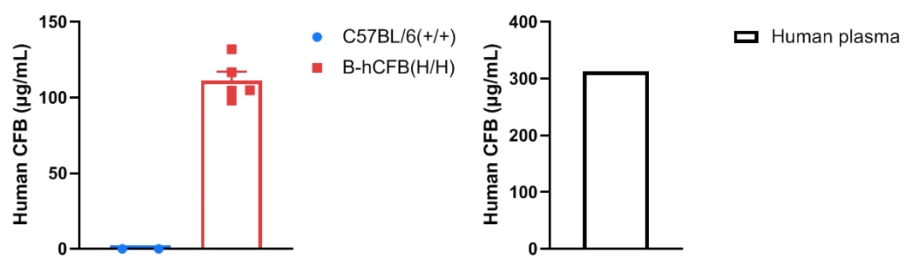
通过ELISA对野生型C57BL/6小鼠和纯合B-hCFB小鼠中的种属特异性CFB表达进行分析。从野生型C57BL/6小鼠和纯合B-hCFB小鼠中分离出血清,并使用种属特异性的CFB ELISA试剂盒(Abcam,ab137973)进行ELISA分析。人的CFB仅在纯合B-hCFB小鼠中可检测到,而在野生型小鼠中则无法检测到。
B-hCFB小鼠血生化
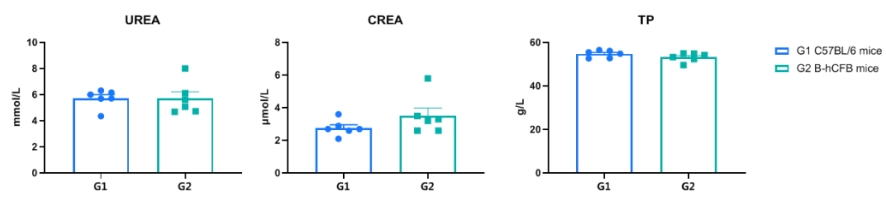
收集雄性C57BL/6和B-hCFB小鼠(n=6,7周龄)的血清,并分析尿素(UREA)、肌酐(CREA)和总蛋白(TP)的水平。在这两种测量值上,C57BL/6和B-hCFB小鼠之间没有差异,表明将hCFB替代其小鼠同源物并不改变尿素、肌酐和总蛋白的水平或者肾脏的健康状况。数值以均值±标准误表示。
核酸药物对CFB表达水平的抑制效果

核酸药物对B-hCFB小鼠中人CFB的抑制效率。将B-hCFB小鼠随机分为三组(每组3只,8周龄,雄性)。根据专利合成的针对人CFB的siRNA类似物(G2 1mpk, G3 3mpk)和G1 PBS分别给予小鼠。在第7天处死小鼠,收集肝组织和血浆以通过qPCR和ELISA检测人CFB mRNA和蛋白质的表达水平。(A)实验处理的示意图。(B)B-hCFB小鼠剩余%的人类CFB蛋白质。(C)肝脏中人类CFB mRNA的表达。治疗组(G2、G3)中的人CFB明显减少与对照组(G1)相比。值表示为平均值±SEM。通过单因素ANOVA测试确定显着性差异。****p<0.0001。
B-hLPA mice
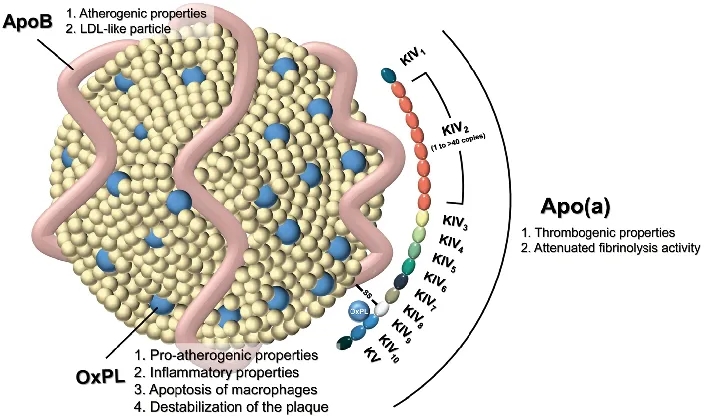
Lp(a)是一种与低密度脂蛋白(LDL)结构相似但更大的高度多态粒子。Lp(a)编码apo(a),在肝脏中高表达。载脂蛋白(a)以非共价和共价结合于载脂蛋白b-100。载脂蛋白(a)具有与纤溶酶原的kringle4结构域(KIV)同源的多个重复序列副本,随后是kringle5-like(KV)结构域和蛋白酶样结构域。[3]
蛋白表达分析
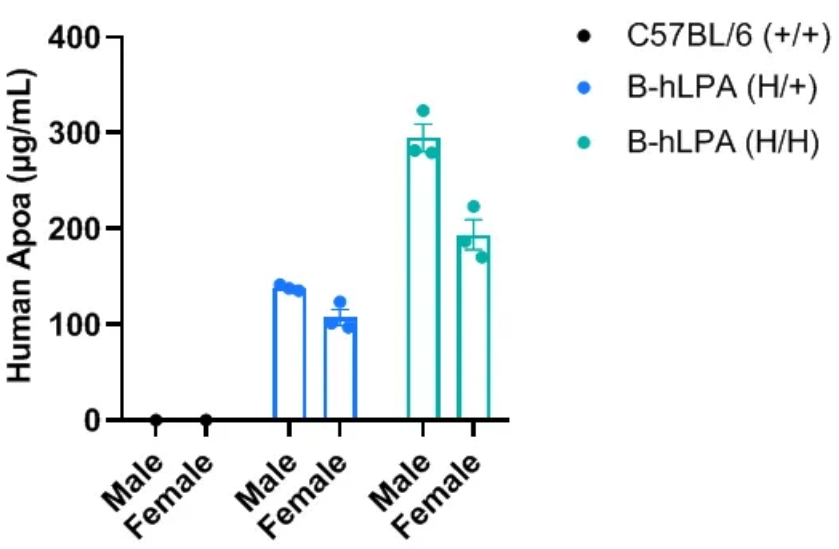
通过ELISA在B-hLPA小鼠中进行特异性Apo(a)蛋白表达分析。收集野生型C57BL/6小鼠、杂合B-hLPA小鼠、纯合B-hLPA小鼠血清,所有小鼠均为7周龄。每种性别的3只B-hLPA小鼠用于检测,每种性别的1只野生型C57BL/6小鼠作为对照。人类Apo(a)仅在杂合和纯合B-hLPA小鼠中可检测到,而在野生型C57BL/6小鼠中则无法检测到。
Olpasiran类似物对小鼠Apo(a)的影响

对异质B-hLPA小鼠在响应olpasiran类似物时血浆Apo(a)水平的变化。Olpasiran类似物(由客户提供)是一种针对脂蛋白(a)能有效降低血浆Lp(a)浓度的双链小干扰RNA(siRNA)。如图所示,Olpasiran类似物降低了杂合B-hlpa小鼠(a)的载脂蛋白(a)浓度,单次给药后比基线(B)降低了80%以上。这些小鼠可用于临床前疗效研究。
B-hAPOC3 mice
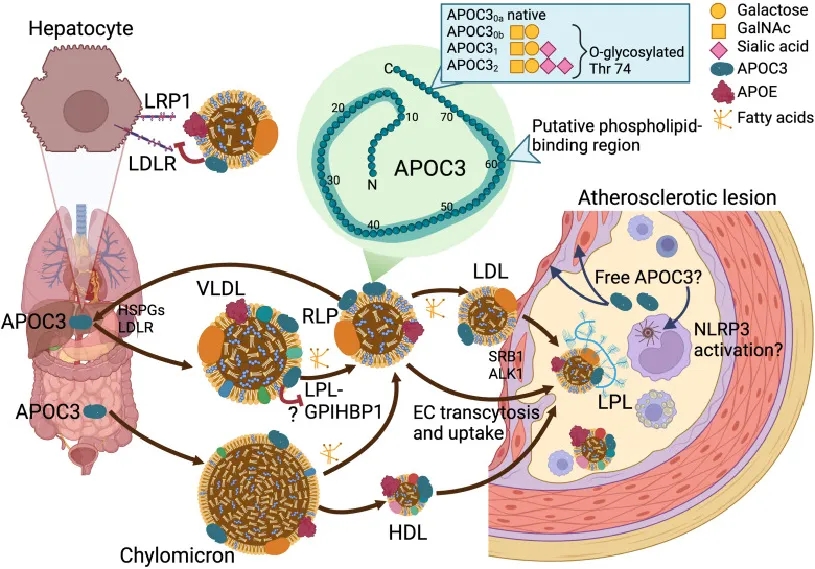
APOC3可通过抑制脂蛋白脂酶(lipoprotein lipase, LPL)活性来增加血浆甘油三酯水平,并通过干扰LDLR和低密度脂蛋白受体相关蛋白1(LDL receptor-related protein1, LRP1)对TRLs及其残余物的清除来增加甘油三酯和胆固醇水平。TRLs清除率的降低与血浆APOC3水平的升高密切相关,APOC3可作为降低血脂异常和CVD风险的新兴治疗靶点。[4]
mRNA表达分析
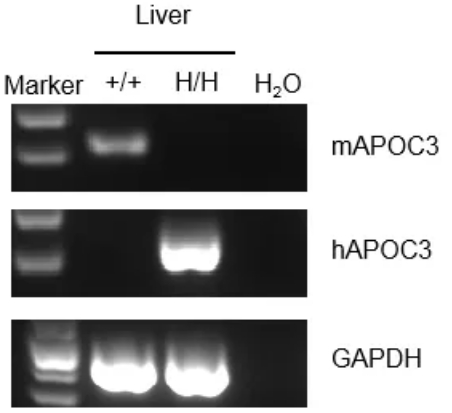
通过RT-PCR对野生型C57BL/6小鼠和B-hAPOC3小鼠中APOC3 mRNA表达进行种属特异性分析。从野生型C57BL/6小鼠和纯合B-hAPOC3小鼠中提取肝RNA,通过反转录合成cDNA文库,使用小鼠或人APOC3引物进行PCR。小鼠Apoc3 mRNA只在野生型C57BL/6小鼠中检测到。人APOC3 mRNA仅在纯合B-hAPOC3小鼠中检测到,而在野生型小鼠中检测不到。
B-hAPOC3小鼠脂质代谢分析
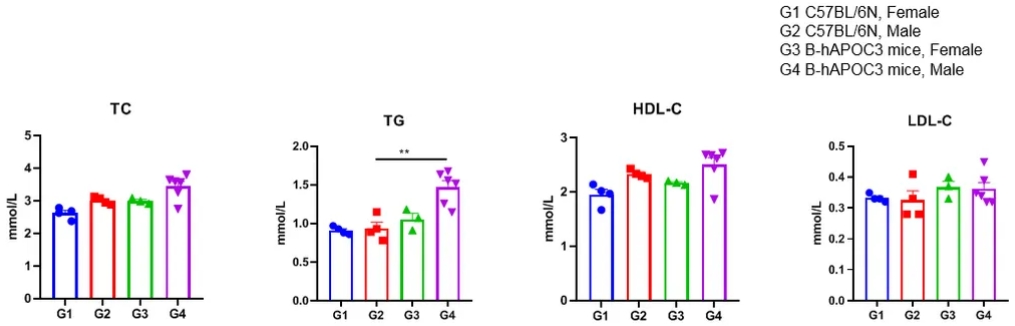
分析B-hAPOC3小鼠和野生型C57BL/6小鼠(5周大)的血浆TG,TC,LDL-C和HDL-C浓度。B-hAPOC3小鼠的TG明显高于野生型C57BL/6小鼠。TG,甘油三酯;TC, 总胆固醇;HDL-C,高密度脂蛋白胆固醇;LDL-C,低密度脂蛋白胆固醇。
核酸药物对人APOC3的抑制效果
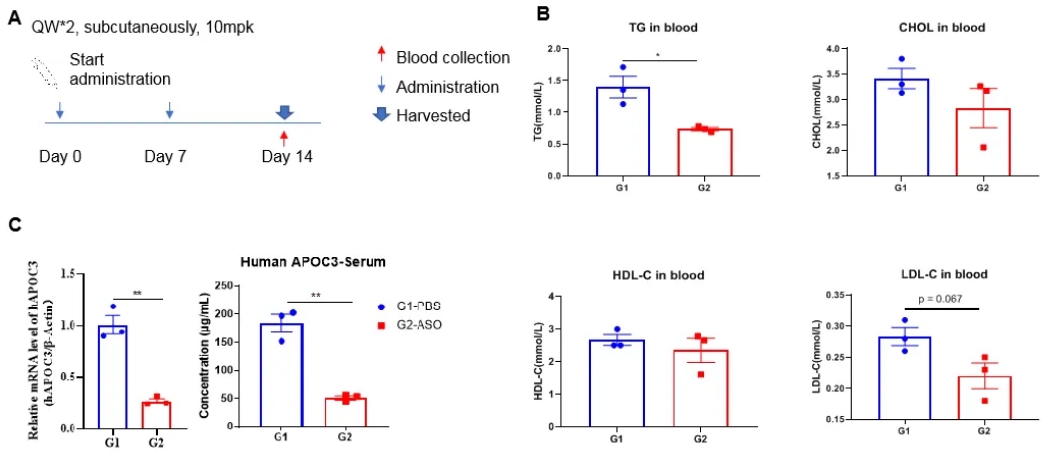
核酸药物对B-hAPOC3小鼠中人APOC3的抑制效率。(A)实验处理示意图。(B)治疗后B-hAPOC3小鼠的血脂水平。与对照组(G1)相比,治疗组(G2)TG明显降低。(C)肝脏中人APOC3 mRNA和血清中人APOC3蛋白表达情况。与对照组(G1)相比,治疗组(G2)中人APOC3 mRNA明显减少,抑制率为73.4%,证明B-hAPOC3小鼠为人APOC3靶向核酸药物的体内评价提供了一个强大的临床前模型。值表示为均值±SEM。
百奥赛图开发了一系列小核酸药物研究相关动物模型,欢迎联系我们获取更多信息。
参考资料
[1] Miao, Yuxi , et al. "Current status and trends in small nucleic acid drug development: Leading the future." Acta Pharmaceutica Sinica B.
[2] Nature Reviews Neurology volume 16, pages601–617 (2020).
[3] Ward NC, et al. J Clin Med. 2019.
[4]J Lipid Res. 2024 Jan;65(1):100475.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号