黏蛋白(Mucins,MUC)是一种上皮细胞产生、分泌的以粘液为主要成分的高分子量、高糖基化蛋白,可保护上皮屏障免受环境损伤,维持体内平衡。黏蛋白参与上皮细胞的分化、更新、调节细胞黏附、细胞信号转导等过程,在肿瘤细胞中会过表达特异性黏蛋白,促进肿瘤扩散和定植到转移部位[1]。
迄今为止,已发现有22种粘蛋白,根据黏蛋白的功能将其分为两类。膜结合型粘蛋白都是 I 型跨膜糖蛋白,包含:MUC1、MUC3A、MUC3B、MUC4、MUC12、MUC13、MUC14、MUC15、MUC16、MUC17、MUC20、MUC21、MUC22;分泌型粘蛋白缺乏跨膜结构域,会分泌到细胞外间隙中,包含:MUC2、MUC5AC、MUC5B、MUC6、MUC7、MUC8、MUC9、MUC19[2]。
黏蛋白在肿瘤的发生发展中发挥重要作用,且因其具有组织特异性和细胞特异性,黏蛋白作为肿瘤免疫治疗和放射免疫治疗靶点拥有巨大潜力[3]。
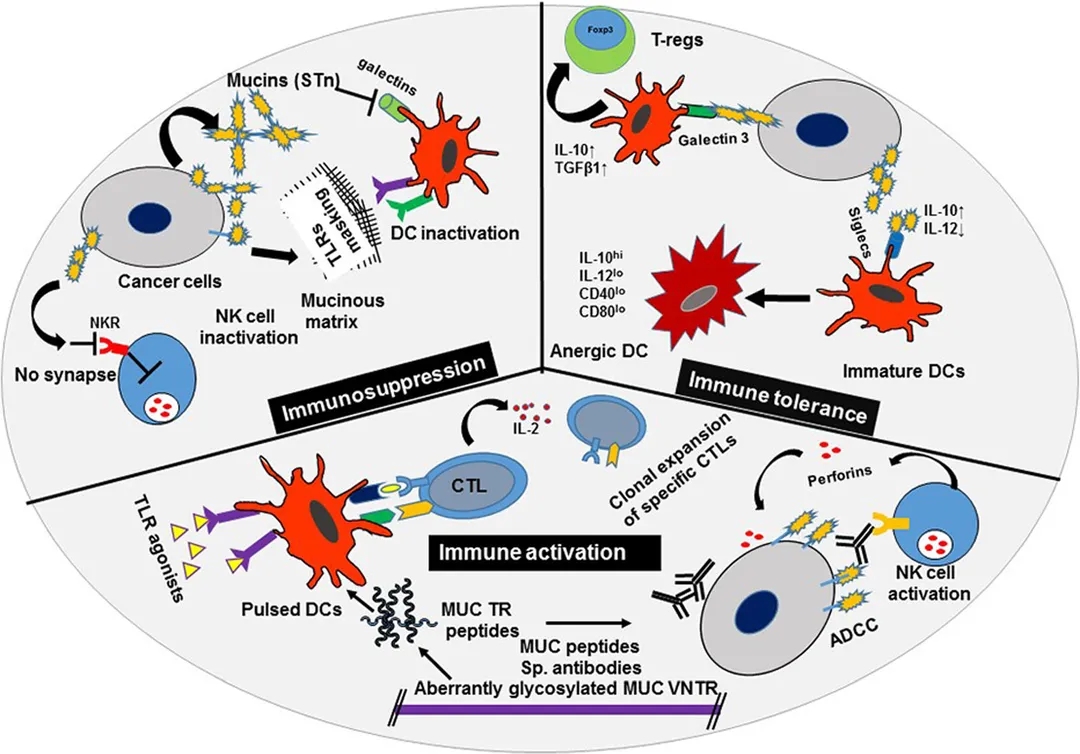
肿瘤相关的MUC免疫调节作用 [1]
MUC1
MUC1 属于膜结合粘蛋白,在几乎所有的呼吸,胃肠,泌尿生殖和肝胆,皮脂腺和唾液腺的上皮组织细胞顶端表面,以及造血细胞和 T 细胞(活化或者未活化,主要是 Treg 细胞)上表达,但没有在皮肤上皮细胞或间充质组织中表达。健康组织中,MUC1在分泌性上皮细胞的顶端表面表达,MUC1-N作为润滑剂、保湿剂及物理屏障保护上皮细胞免受外界环境及污染物、微生物等的影响。此外,当上皮细胞受到外来信号的刺激时,细胞极性可逆性丢失,MUC1在整个细胞表面表达且与位于细胞基地外侧的各种因子作用并参与其下游信号通路、促进细胞的修复与存活。
该基因最早发现在乳腺癌细胞中异常过表达,肺硬化性血管瘤和乳腺导管腺瘤患者血清MUC1 水平极高,在多种恶性肿瘤、胰腺癌、肺癌、胃癌、乳腺癌中高表达。肿瘤细胞中的MUC1高度唾液酸化,引发糖链延伸的提前终止从而形成截短的糖链分支,导致肿瘤相关MUC1(TA-MUC1)糖基化水平降低、肿瘤细胞粘附力下降,从而为肿瘤转移提供了条件。
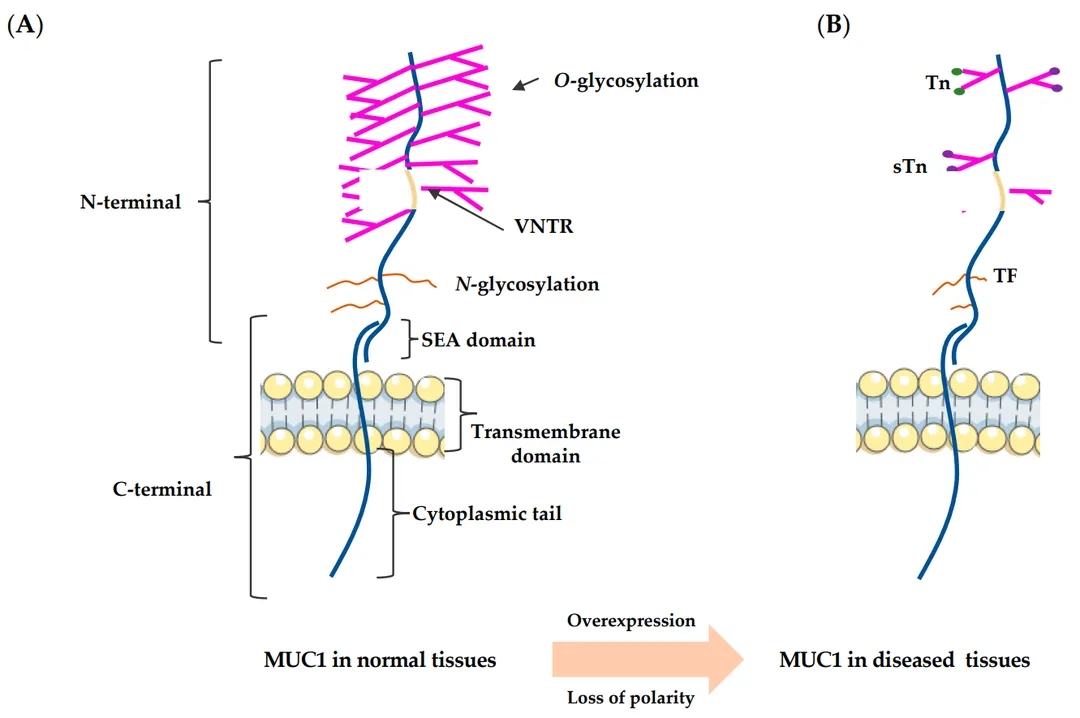
MUC1在正常组织和病变组织中的结构[4]
有研究表明,肿瘤细胞表面的MUC1的表达比正常细胞表面高100多倍,且肿瘤细胞失去了顶点突触极性,低糖基化的MUC1会在整个细胞表面表达,且通常靠近生长因子及其受体并与其相互作用,MUC1-C通过细胞内信号传导及相关生物分子的调节从而参与肿瘤细胞的侵袭、转移及血管生成等。在感染相关癌症中,感染期间,上皮细胞表面的MUC1与入侵的微生物相互作用并根据不同的微生物和细胞类型引发促炎或抗炎反应;在肿瘤中,过表达的MUC1可以抑制NK细胞对肿瘤细胞的杀伤作用,此外,MUC1 高表达还可以抑制CTL的增殖, 甚至可以诱导CTL凋亡[4]。
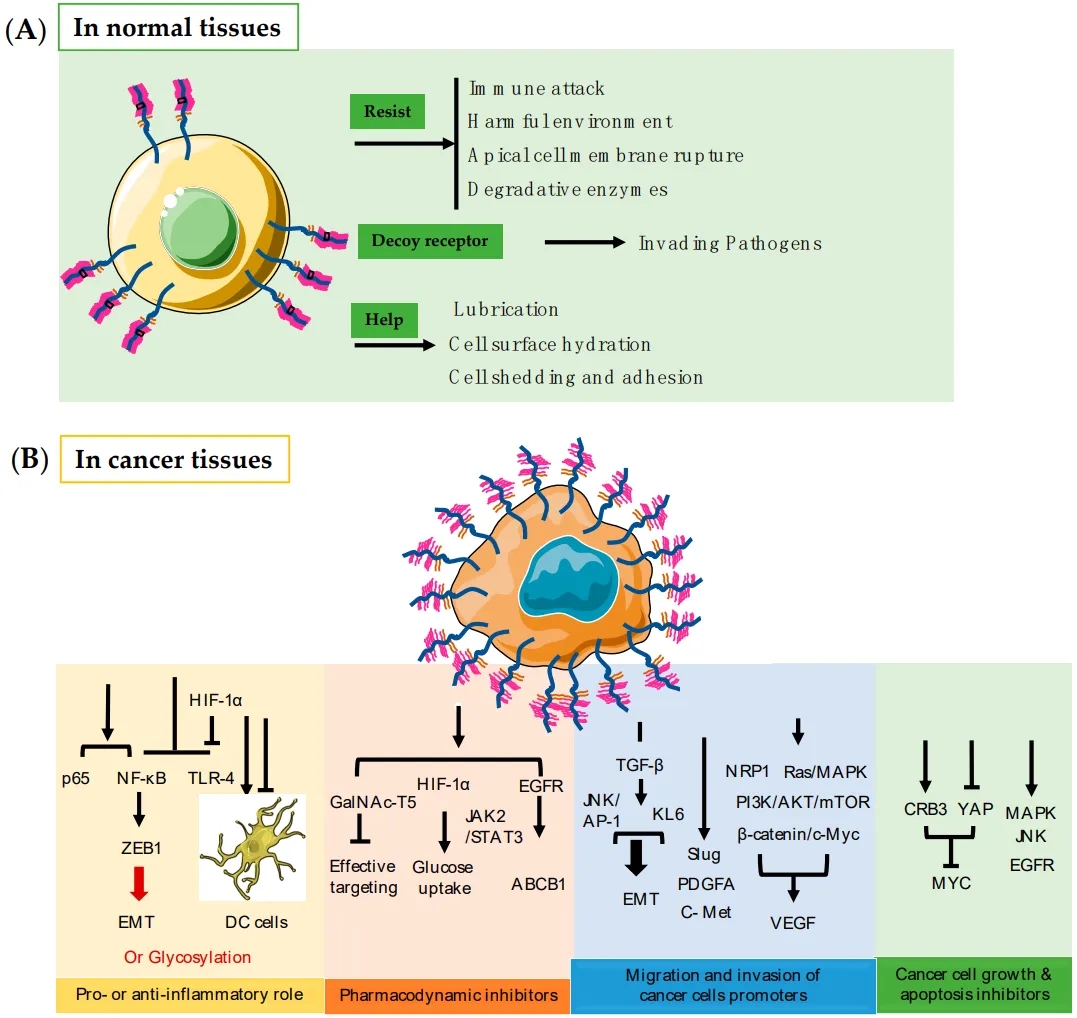
MUC1在健康组织和癌组织中的不同功能[4]
(A) MUC1在正常组织中的功能;(B) MUC1在肿瘤组织中的功能及其主要通路
MUC1在肿瘤细胞中高表达,其可通过调节肿瘤细胞代谢、EMT、抑制肿瘤细胞凋亡等方面促进肿瘤进展、增强肿瘤耐药性。因此,MUC1可能成为未来肿瘤靶向治疗的新靶点。
MUC17
MUC17 属于膜结合黏蛋白, I 型跨膜蛋白,胞外高度糖基化。MUC17 主要表达在肠组织, 其中十二指肠和横结肠表达量最高(占十二指肠表达量的 85%), 胃和胎肾表达量较低,主要定位于肠上皮的成熟吸收细胞。可增强肠道粘液屏障,促进炎症愈合,在上皮细胞中,提供细胞保护,维持管腔结构,提供信号转导,并给予失去极性的癌细胞抗黏附性能,从而使肿瘤细胞失去极性[5]。
肿瘤基因组图谱数据库分析表明 MUC17 在胃癌(GC)标本中表达更高, 在其他多种癌症(如胰腺癌) 中也表达异常。 在炎性肠病和肠道肿瘤中,MUC17 的表达显著被下调,致使细胞降低粘附活性,MUC17 的缺失可作为结肠癌的早期预警。在胃癌中, MUC17 高表达, 炎症因子通过CDX1 诱导 MUC17 表达。作为一个保护因素,MUC17 通过维持 MYH9-p53-RhoA 调节反馈环,然后激活 p38 信号使其失活,从而抑制炎症因子的作用[6]。
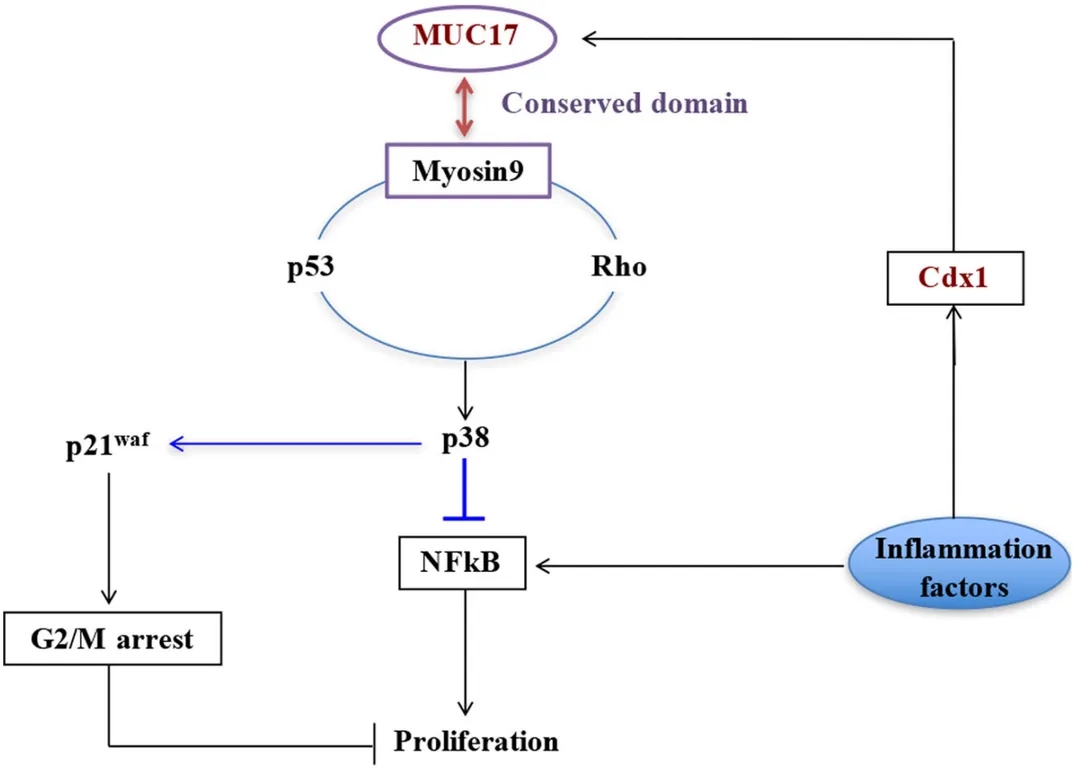
MUC17在胃癌中的作用机制[6]
大多数胃癌与胃粘膜屏障功能障碍有关,这是抵抗病原体和炎症的第一道防线。胃粘膜屏障的损害通常会导致慢性炎症,这是胃癌发生的主要因素。高分子量糖基化蛋白的粘蛋白便是保护胃下皮的粘膜屏障的主要成分之一。基因组学的研究结果显示,胃癌的突变基因与炎性信号转导通路密切相关;在所识别的高频突变基因中,以胃黏膜屏障的主要组成成分-粘蛋白家族的突变频率最高。
研究表明,长期用促炎性细胞因子TNFα刺激诱导炎性状态会导致MUC17的增加,进而保护Caco-2细胞免受肠病原性大肠杆菌的黏附。这个研究结果说明MUC17在炎症中充当第二道防线的功能。
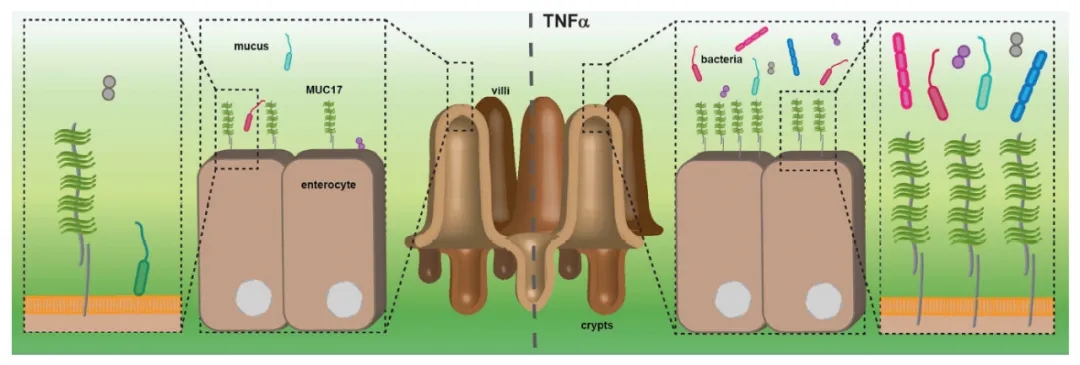
MUC17在炎症中可起到防御作用[7]
中国每年近 50 万人死于胃癌,占全球总数的一半以上,发病率和死亡率远高于全球平均水平。在大多数情况下,手术仍然是治愈性治疗的主要手段。随着靶向治疗的兴起,胃癌发生、发展分子机制研究的不断深入,胃癌的分子靶向和免疫治疗治疗逐渐崭露头角,MUC17 有望成为胃癌免疫治疗热门靶点。
百奥动物自主研发B-hMUC1、B-hMUC17小鼠以及B-hMUC1 MC38、B-hMUC17 MC38细胞系,助力黏蛋白(MUC)相关肿瘤免疫治疗药物临床前研究。
MUC1人源化小鼠及细胞系
基本信息
B-hMUC1 mice

B-hMUC1 MC38

B-hMUC1 MC38细胞系成瘤实验
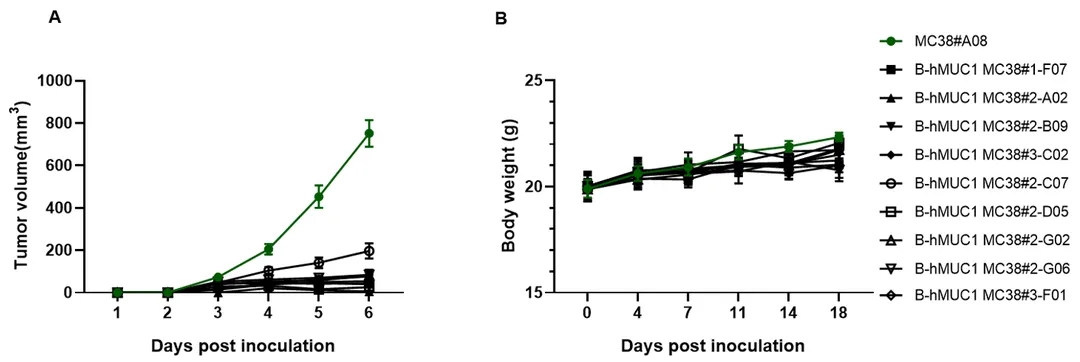
将B-hMUC1 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入野生型C57BL/6小鼠体内(雌性,8周龄,n=6)。每周2次测量肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(Mean±SEM)。体积以mm3表示,公式为:V=0.5×长径×短径2。如A图所示,B-hMUC1 MC38细胞在野生型C57BL/6小鼠体内不能建立肿瘤。
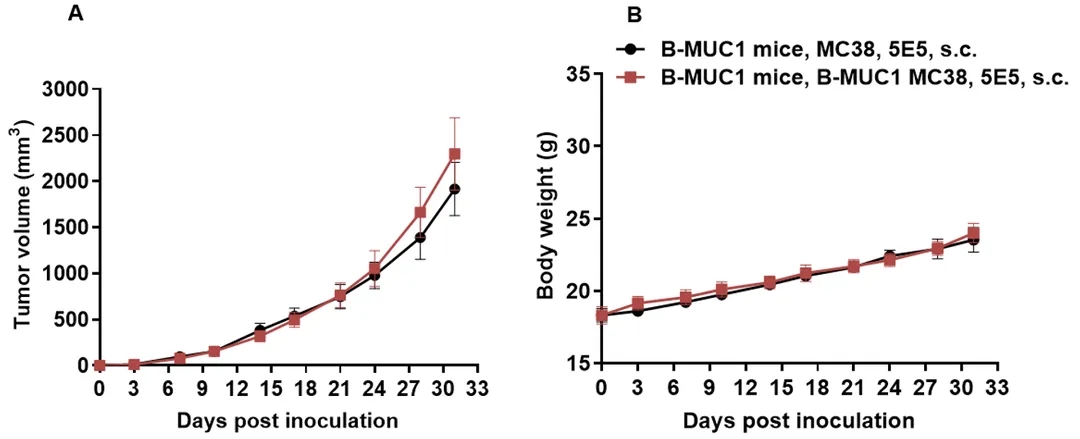
将B-hMUC1 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入B-hMUC1小鼠体内(雌性,8周龄,n=6)。每周2次测量肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(Mean±SEM)。体积以mm3表示,公式为:V=0.5×长径×短径2。如A图所示,B-hMUC1 MC38细胞能够在B-hMUC1小鼠体内形成肿瘤,可用于临床前药效研究。
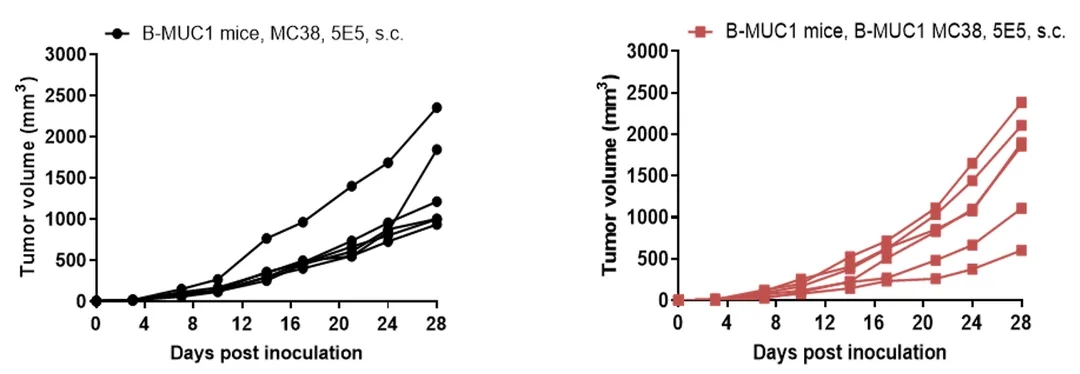
将B-hMUC1 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入B-hMUC1小鼠(雌性,8周龄,n=6)。如图所示,B-hMUC1 MC38细胞能够在体内形成肿瘤,可用于临床前药效研究。
MUC17人源化小鼠及细胞系
基本信息
B-hMUC17 mice

B-hMUC17 MC38

蛋白表达分析
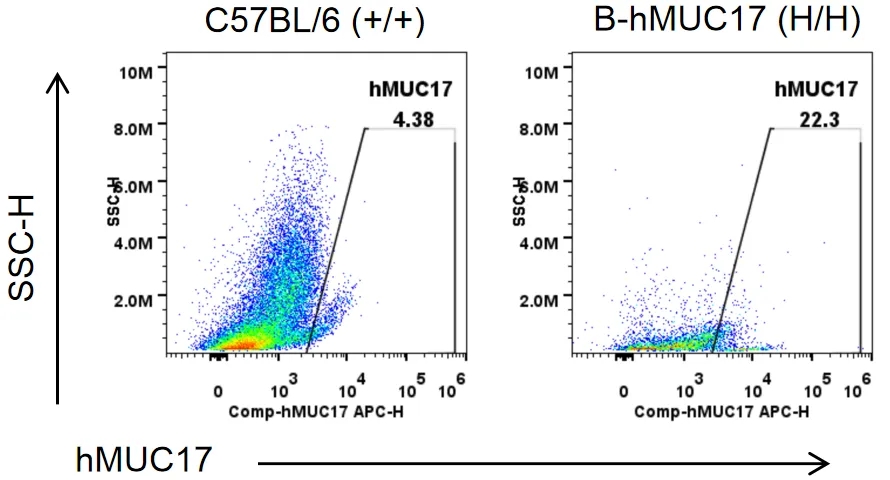
流式细胞术分析纯合子B-hMUC17小鼠种属特异性MUC17的表达。从野生型小鼠(+/+)和纯合子B-hMUC17小鼠(H/H)肠道组织匀浆中获得单细胞悬液,用抗人MUC17抗体流式细胞术进行分析。结果显示:人MUC17仅在纯合子B-hMUC17小鼠中检测到(H/H),而在野生型小鼠中检测不到(+/+)。
B-MUC17 MC38细胞系成瘤实验
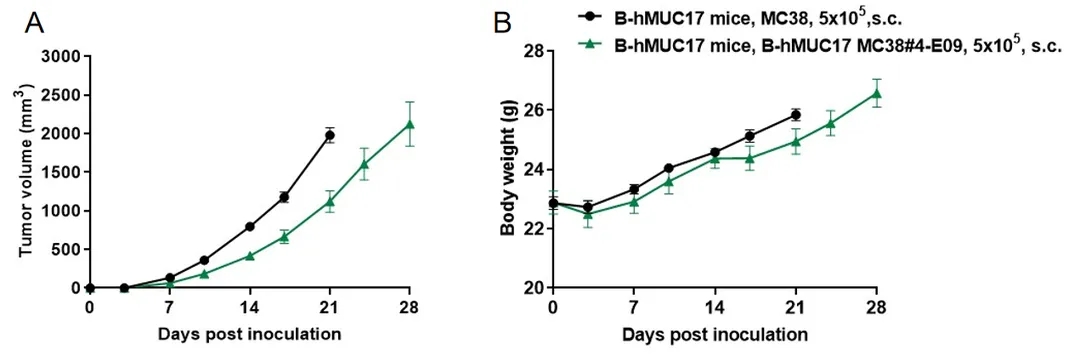
将B-hMUC17 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入杂合子B-hMUC17小鼠(雄性,8周龄,n=6)。每周2次测量肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(Mean±SEM)。体积以mm3表示,公式为:V=0.5×长径×短径2。如A图所示,B-hMUC17 MC38细胞在杂合子B-hMUC17小鼠体内能够形成肿瘤,可用于临床前药效研究。
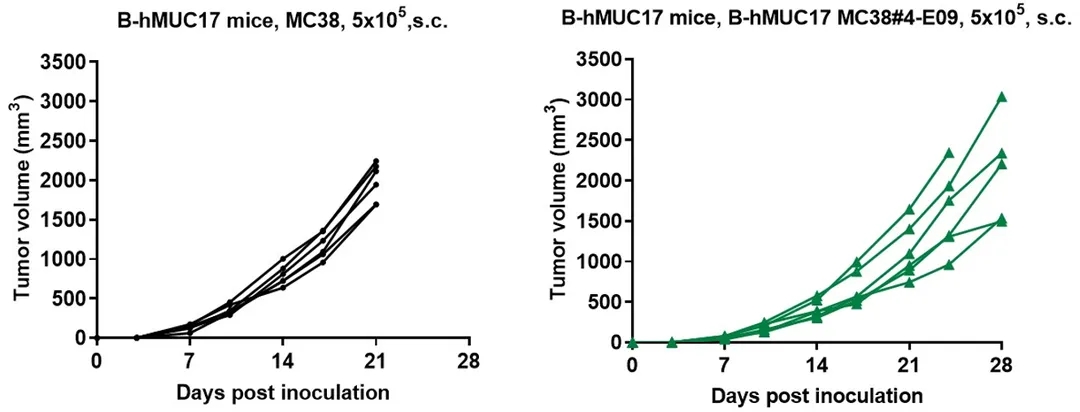
将B-hMUC17 MC38细胞(5x105)和野生型MC38细胞(5x105)皮下植入杂合子B-hMUC17小鼠(雄性,8周龄,n=6)。如图所示,B-hMUC17 MC38细胞能够在体内形成肿瘤,可用于临床前药效研究。
参考资料
[1]Bhatia R, Gautam SK, Cannon A, et al. Cancer-associated mucins: role in immune modulation and metastasis. Cancer Metastasis Rev. 2019;38(1-2):223-236.
[2]https://zhuanlan.zhihu.com/p/596425852
[3]Brockhausen, Inka, and Jacob Melamed. "Mucins as anti-cancer targets: Perspectives of the glycobiologist." Glycoconjugate Journal 38.4 (2021): 459-474.
[4]Chen W, Zhang Z, Zhang S, Zhu P, Ko JK, Yung KK. MUC1: Structure, Function, and Clinic Application in Epithelial Cancers. Int J Mol Sci. 2021;22(12):6567. Published 2021 Jun 18. doi:10.3390/ijms22126567.
[5]Gum Jr, James R., et al. "MUC17, a novel membrane-tethered mucin." Biochemical and biophysical research communications 291.3 (2002): 466-475.
[6]Yang B, Wu A, Hu Y, Tao C, Wang JM, Lu Y, Xing R. Mucin 17 inhibits the progression of human gastric cancer by limiting inflammatory responses through a MYH9-p53-RhoA regulatory feedback loop. J Exp Clin Cancer Res. 2019 Jul1;38(1):283
[7]Schneider, H., Berger, E., Dolan, B. et al. The human transmembrane mucin MUC17 responds to TNFα by increased presentation at the plasma membrane. BIOCHEM J 476, 16 (2019).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号