肿瘤疫苗是一种免疫治疗方法,主要利用肿瘤相关抗原(TAAs)和肿瘤特异性抗原(TSA)激活患者的免疫系统,激发特异性细胞免疫和体液免疫反应,杀伤肿瘤细胞,抑制肿瘤生长。目前大多数肿瘤疫苗仍处于临床前和临床研究阶段,与传统疫苗诱导体液免疫不同的是,CD8+细胞毒性T细胞介导的细胞免疫反应对于肿瘤疫苗药效更为关键。
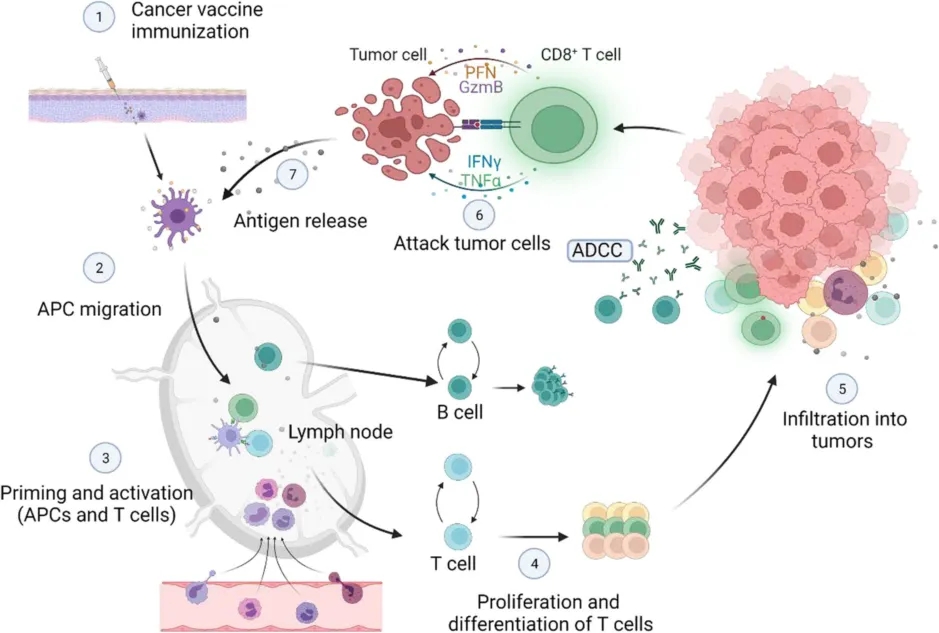
图1 肿瘤疫苗诱导的肿瘤免疫周期[1]
肿瘤疫苗根据制备方法的不同,可以分为四类:细胞疫苗、病毒疫苗、多肽疫苗和核酸疫苗。其中,抗原选择是肿瘤疫苗设计的最关键环节之一。T淋巴细胞识别的肿瘤抗原是肿瘤疫苗有效性的核心,理想的癌症疫苗抗原应具有高度免疫原性,明确表达于所有癌细胞(而非正常细胞),并且是癌症细胞生存所必需的抗原。
肿瘤抗原
肿瘤抗原可分为TAAs和TSA。TAAs也被称为肿瘤共享抗原,包括分化抗原、过表达抗原、癌症-睾丸抗原等自身抗原,也有病毒来源的非自身抗原。过度表达的肿瘤抗原有人表皮生长因子受体2 (HER2)和人端粒酶逆转录酶;组织分化抗原由肿瘤细胞和与肿瘤细胞具有相同组织来源的正常细胞表达,如前列腺和前列腺癌中表达的前列腺特异性抗原(PSA)、正常黑素细胞表达的黑色素瘤抗原酪氨酸酶等。
TAAs类的疫苗适用性更广,可应用于不同患者,因此受到早期癌症疫苗研发的青睐。但由于胸腺的中枢免疫耐受机制,识别TAAs的活化T细胞可能在发育过程中已经被清除,从而影响疫苗的效力。此外,TAAs也在正常组织中也有表达,也增加了疫苗诱发自身免疫毒性的风险。
TSA是在肿瘤细胞中特异性表达的蛋白质,也被称为新抗原,是由肿瘤细胞突变产生的个体特异性非自体蛋白。新抗原仅由肿瘤细胞表达,能触发有效的肿瘤特异性T细胞免疫反应,降低了非肿瘤靶向毒性(On-target off-tumor)。与TAAs相比,新抗原具有更强的免疫原性和更高的主要组织相容性复合体亲和力,而且不受中枢免疫耐受的影响。但是新抗原鉴定主要来自对肿瘤和正常组织的高通量测序和生物学分析,预测新抗原目前成功率较低,可能会错过具有诱导较强抗肿瘤免疫作用的重要新抗原。此外,肿瘤类型和个体差异也限制了新抗原靶点的肿瘤疫苗应用。
筛选新抗原一般会参考以下指标:
与人类白细胞抗原(HLA)结合亲和力;
与野生型相比应具有高度的异型性;
它们可以在大多数肿瘤细胞中表达;
这些突变的新抗原对于肿瘤细胞生存有重要影响。

图2 用于制备靶向新抗原的个性化多肽疫苗(PPVs)的范例[2]
肿瘤疫苗的类型
在治疗性癌症疫苗领域,疫苗的递送是一个关键因素。目前不同的疫苗类型有着不同的递送策略和指标方法。
细胞疫苗
细胞疫苗是最初的癌症疫苗形式。以细胞为基础的癌症疫苗通常由整个细胞或细胞片段制备而成,几乎包含所有肿瘤相关抗原,从而诱导更广泛的抗原性免疫应答。树突状细胞(DC)疫苗是细胞疫苗的一个重要分支,目前基于DC的个体化新抗原肿瘤疫苗在临床上显示出良好的抗肿瘤疗效。
病毒疫苗
病毒具有天然的免疫原性,可通过基因编辑方法被改造编码肿瘤抗原。重组病毒,如腺病毒等,可作为载体感染免疫细胞。此外还可以作为溶瘤病毒载体使用,除了提供肿瘤抗原外,病毒本身还可溶解肿瘤细胞,释放更多肿瘤抗原,从而进一步提高疫苗效力并产生持久的免疫记忆。
基于多肽的亚单位疫苗
基于多肽的亚单位疫苗包括化学或生物合成的预测或已知特异性肿瘤抗原,可诱导针对特定肿瘤抗原表位的免疫应答。但单独多肽免疫原性一般较弱,联合佐剂可有效激发特异性免疫反应。
核酸疫苗
核酸疫苗包括DNA疫苗和RNA疫苗,可诱导强烈的主要组织相容性复合体I类分子介导的CD8+T细胞应答。核酸疫苗可同时递送多种抗原,触发体液和细胞免疫应答。此外,核酸疫苗能够编码全长肿瘤抗原,使抗原呈递细胞能够交叉呈递不同的抗原表位或同时呈递多种抗原。
影响肿瘤疫苗药效因素
影响肿瘤疫苗药效的因素分为内源性耐药和外源性耐药。
效应T细胞相关的耐药属于内源性,包括肿瘤免疫的信号通路突变、肿瘤抗原表达下调或缺失、抗原处理途径改变或HLA表达缺失,均可能导致免疫细胞对肿瘤细胞识别能力下降。
肿瘤疫苗外源性耐药主要是因为免疫微环境中的免疫抑制细胞,包括髓源性抑制细胞(MDSCs)、肿瘤相关巨噬细胞(TAMs)、T调节性细胞(Tregs)、促肿瘤N2中性粒细胞和肿瘤相关成纤维细胞(CAFs)等。免疫抑制性细胞能通过释放细胞因子干扰T细胞的活化和增殖,还能够抑制DC功能;CAFs通过重塑细胞外基质构建致密纤维基质抑制DC增殖和迁移,募集MDSCs,抑制T细胞侵袭;M2型巨噬细胞可以促进肿瘤相关血管生成,同时也促进肿瘤细胞的侵袭和转移。
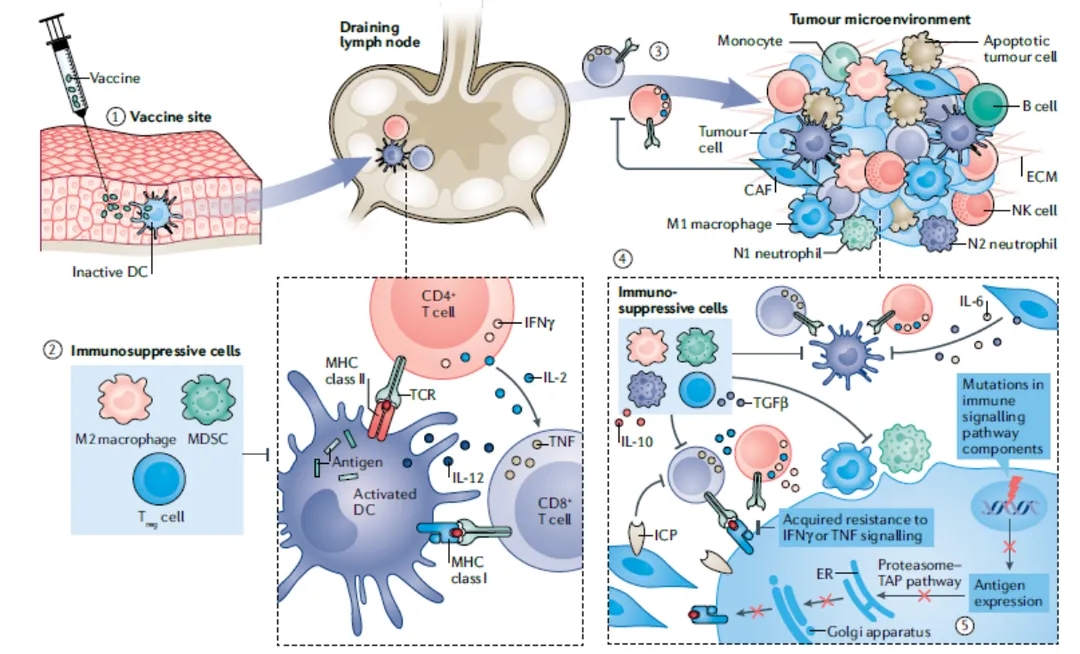
图3 肿瘤疫苗的耐药机制[3]
总而言之,新兴技术大幅提升了肿瘤疫苗的可行性。但肿瘤疫苗效果仍受肿瘤微环境及固有免疫逃逸机制的影响,往往需要与其他免疫治疗(如免疫检查点抑制剂)联合使用以提高疗效。但肿瘤疫苗为癌症免疫治疗开辟了新的可能性。
肿瘤疫苗临床前评价一站式服务
在疫苗进入临床试验阶段之前,它需要像治疗性药物一样,通过临床前药效评价和动物安全性评价来考察其有效性和安全性。百奥赛图拥有丰富的小鼠模型资源和完善的临床前药效评价平台,能够提供一站式肿瘤疫苗临床前评价服务,包括小鼠免疫原性评估、肿瘤药效测试等,全面评估疫苗诱导的抗肿瘤免疫反应,确保疫苗的有效性和安全性,为后续临床试验做好充分准备。

百奥赛图基于HLA人源化小鼠和HLA人源化肿瘤细胞系,建立了多种免疫原性评价和肿瘤药效动物模型,小鼠APC能呈递和识别与人类相似或相同的多肽表位,可助力肿瘤疫苗领域的研发。
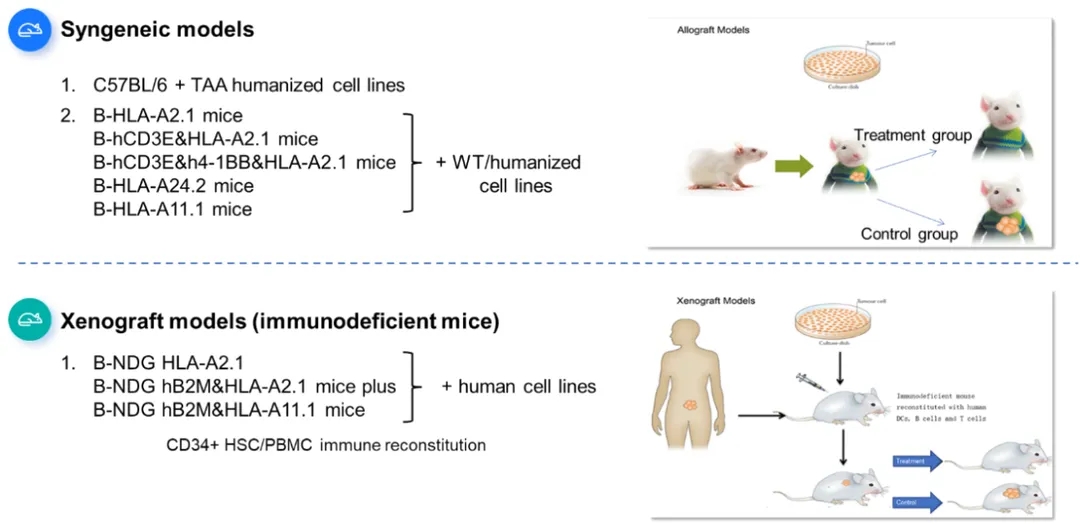
图4 同源肿瘤模型和异种移植肿瘤模型
免疫原性测试
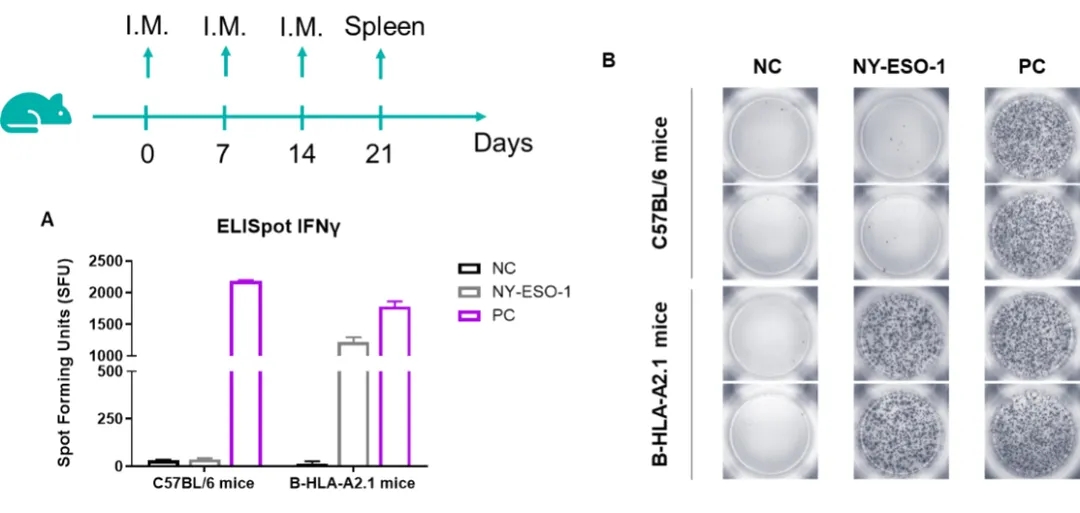
图5 多肽疫苗在B-HLA-A2.1小鼠中的免疫原性测试
IFN-γ ELISpot检测B-HLA-A2.1小鼠免疫应答。9 ~ 10周龄雄性B-HLA-A2.1小鼠分别在双下肢内侧肌肉免疫PBS和NY-ESO-1多肽(n = 3),末次免疫7天后进行ELISpot检测。
多肽疫苗抗肿瘤活性
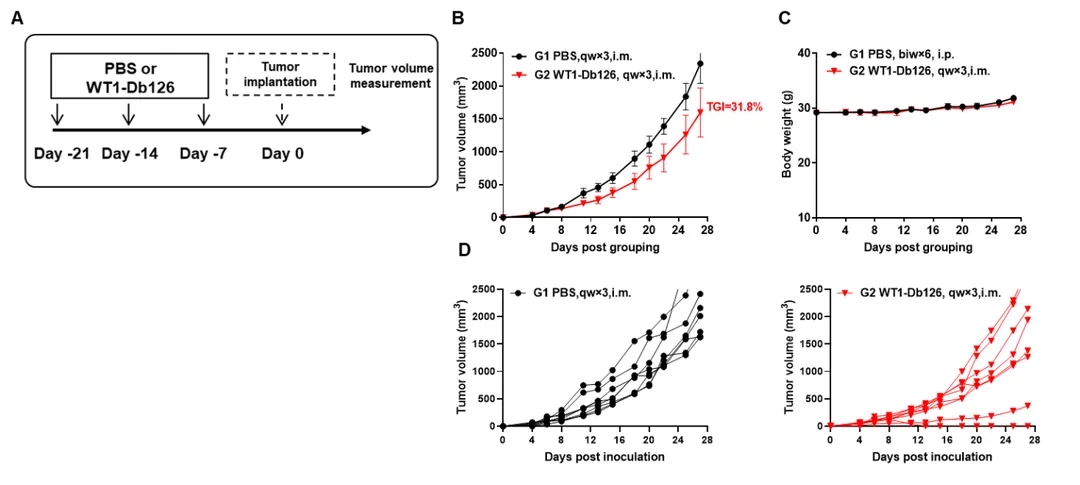
图6 多肽疫苗WT1- db126对B-HLA-A2.1/WT1 MC38细胞的抗肿瘤作用
(A) 实验方案。(B) WT1-Db126预防性治疗的抗肿瘤活性。B-HLA-A2.1小鼠(每组8只)根据A中所示方案,分别用WT1-Db126疫苗(150μg)或PBS免疫接种。最后一次免疫后一周,将B-HLA-A2.1/WT1 MC38细胞接种于小鼠右侧背部。(C) 治疗期间小鼠体重变化。D) 不同组别个体肿瘤生长曲线。WT1-Db126多肽疫苗能够控制B-HLA-A2.1小鼠的肿瘤生长,证明B-HLA-A2.1小鼠是评价疫苗体内活性的良好临床前模型。
疫苗诱导的免疫应答
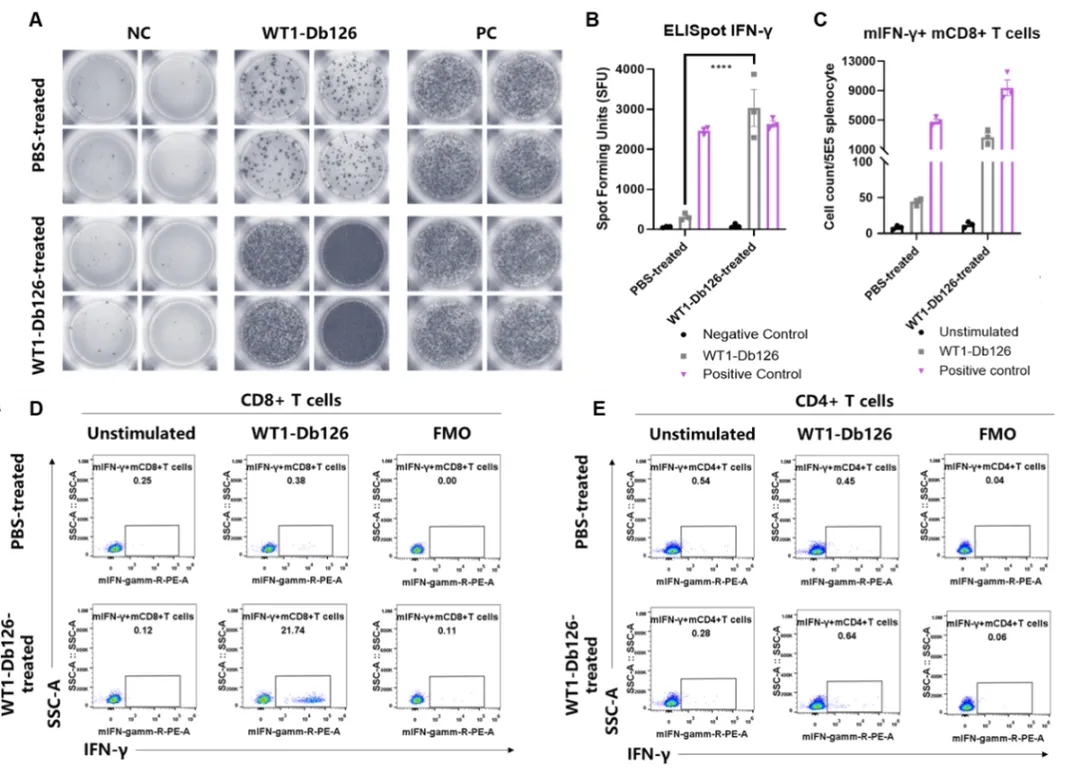
图7 B-HLA-A2.1小鼠中疫苗诱导的免疫应答
(A) 免疫后小鼠脾细胞ELISpot结果的代表性图像,(B) ELISpot实验定量分析结果,(C-E) B-HLA-A2.1小鼠中WT1-Db126特异性的CD4+和CD8+T细胞。这些结果证明B-HLA-A2.1小鼠可以作为肿瘤药效的临床前模型,用于评价肿瘤疫苗活性。
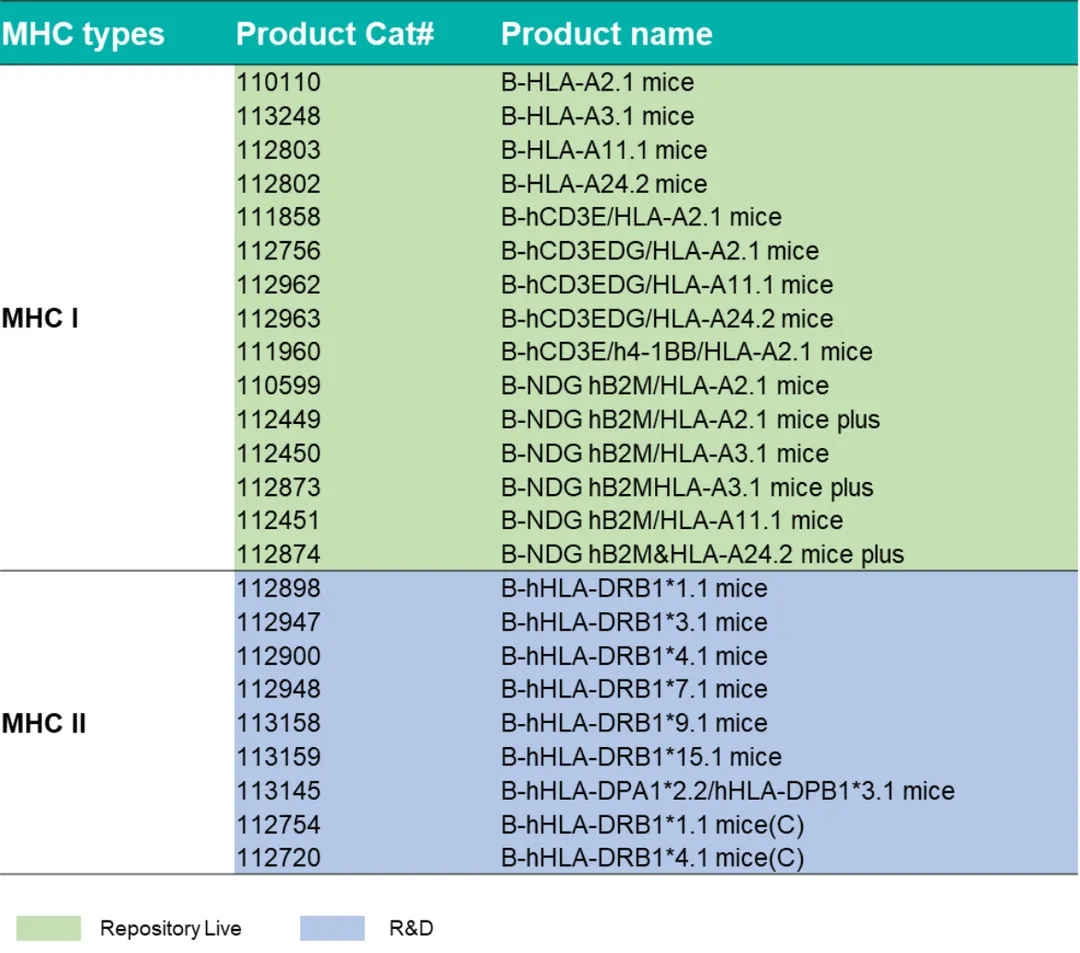
HLA人源化小鼠列表
参考资料:
[1] Liu J, Fu M, Wang M, Wan D, Wei Y, Wei X. Cancer vaccines as promising immuno-therapeutics: platforms and current progress. J Hematol Oncol. 2022 Mar 18;15(1):28. doi: 10.1186/s13045-022-01247-x. PMID: 35303904; PMCID: PMC8931585.
[2] Ma M, Liu J, Jin S, Wang L. Development of tumour peptide vaccines: From universalization to personalization. Scand J Immunol. 2020 Jun;91(6):e12875. doi: 10.1111/sji.12875. Epub 2020 Mar 10. PMID: 32090366.
[3] Saxena M, van der Burg SH, Melief CJM, Bhardwaj N. Therapeutic cancer vaccines. Nat Rev Cancer. 2021 Jun;21(6):360-378. doi: 10.1038/s41568-021-00346-0. Epub 2021 Apr 27. PMID: 33907315.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号