春天万物复苏,百花齐放,人们外出赏花郊游,享受着春意盎然。但对哮喘患者来说,春季却是一年之中发病频率最高的季节。尤其是每年的3-6月份,都要接受“毛毛雨”的洗礼,哮喘患者更是苦不堪言。
2024年5月7日是第26个世界哮喘日,哮喘(Asthma)对我们大部分人来说并不陌生,它是一种以慢性气道炎症和气道高反应性为特征的异质性疾病。近年来,全球患哮喘人数将近3亿,不同国家哮喘患病率差异较大;哮喘患病率以每10年20%~50% 的比例增长,中国20岁及以上人群哮喘患病率4.2%,患病人数达到4570万。
背景概述
哮喘是一种严重威胁人类健康的常见呼吸道疾病,是一种非特异的气道慢性变态反应性炎症,以嗜酸性粒细胞聚集、活化及其高毒性阳离子蛋白的释放、肥大细胞反应为主,并伴随多种炎症细胞、炎症介质及细胞因子的参与的一种慢性炎症性疾病。不同的病理改变由气道上皮细胞、嗜酸性粒细胞和T淋巴细胞亚群等多种参与免疫应答的细胞介导[1]。
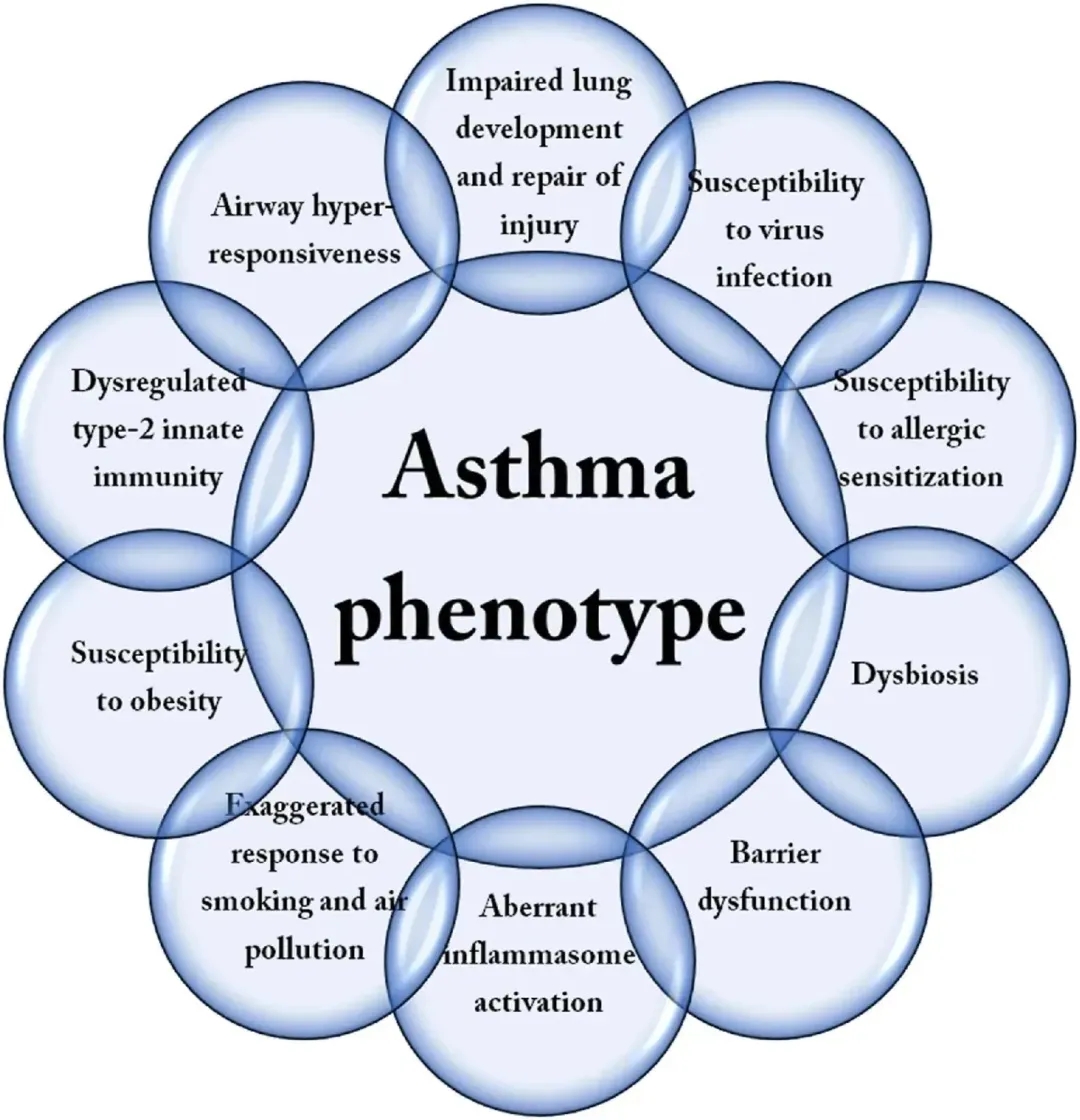
图1. 哮喘表型的内型[1]
哮喘的发病是由遗传、表观遗传和环境因素之间的复杂相互作用引起的,其诱发因素包括过敏原、病毒感染、刺激物、运动等。 对哮喘分子发病机制的了解有助于疾病干预治疗新靶点的发现和创新药物的研制。
哮喘的症状主要是由于气道炎症导致的,炎症引起的过程包括粘液产生、气道壁重塑和支气管高反应性。气道壁重塑和气道粘液堵塞导致的持续性气道阻塞是目前临床治疗哮喘未满足的迫切医疗需求之一[2]。
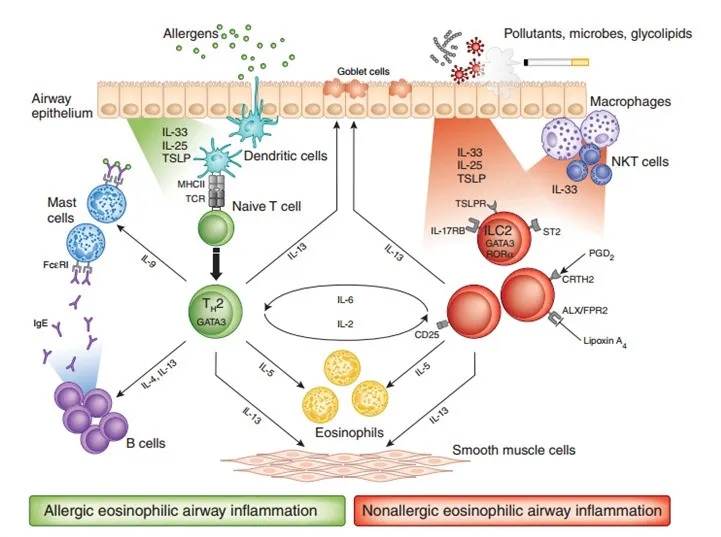
哮喘疾病信号通路[3]
哮喘通常在幼年发病(早发型哮喘),但也有些在成年发病(晚发型哮喘)。晚发型哮喘比早发型哮喘更严重,但与过敏的关系更小,过敏性哮喘往往始于幼年时期,与辅助T细胞2 (Th2)反应有关[4],其病理特点为Th2淋巴细胞免疫反应强, IL-4、 IL-5、 IL-13增强,导致嗜酸性粒细胞浸润增多、粘液分泌增多、支气管高反应性(BHR)、 免疫球蛋白E (IgE)合成和组织重塑。 哮喘的临床表现主要为反复发作的喘息、气急、胸闷或咳嗽,通常与广泛但可变的气流阻塞有关,多数患者可自行缓解或经治疗后缓解。因此建立可靠的哮喘动物模型对于探究哮喘的发病机制,发现药物作用靶点具有重要意义。
优质的哮喘疾病模型是药物评价的良好工具,常用的造模方式是采用屋尘螨提取物(HDM)、卵清蛋白(OVA)等构建小鼠哮喘模型。经典的小鼠哮喘模型是卵清蛋白诱导的气道炎症模型。小鼠经多次腹腔注射卵清蛋白致敏,雾化吸入卵清蛋白后激发。哮喘小鼠模型中IgE和嗜酸性粒细胞水平较高,组织切片染色显示气道粘液增多,炎症性白细胞浸润增多。
BioMice百奥动物利用基因编辑技术自主开发了一系列哮喘相关靶点人源化小鼠,同时基于靶点人源化小鼠和野生型小鼠构建了哮喘模型并且在不同品系中进行了验证,可用于药效评估,助力该疾病药物的临床前研究。
表1. 哮喘相关靶点人源化小鼠
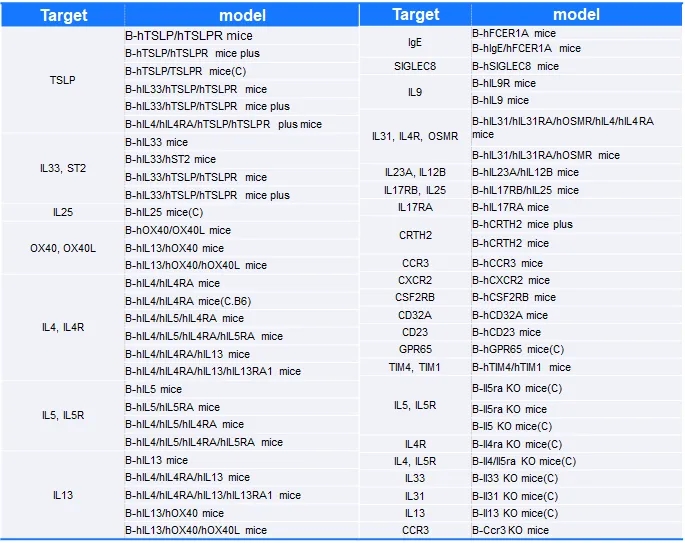
表2. 药理药效服务内容

OVA诱导的急性哮喘模型的构建及验证
抗人TSLP抗体在一种新型哮喘模型中的体内疗效
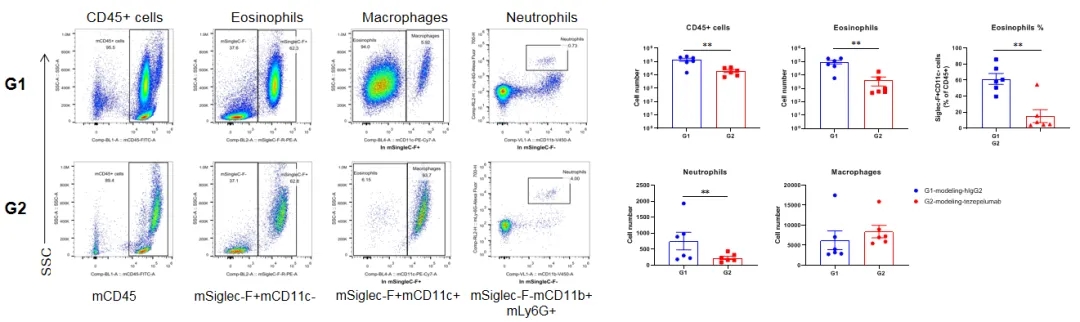
在B-hTSLP/hTSLPR mice plus中诱导小鼠哮喘模型,并用抗人TSLP抗体(tezepelumab,内部合成)处理。在实验结束时收集BALF以检测肺组织中浸润的炎症细胞。结果显示,用抗人TSLP抗体处理的组(G2)中的CD45+细胞、嗜酸性粒细胞和中性粒细胞与用同型对照抗体处理的对照组(G1)相比显著减少。数值表示为平均值±SEM。
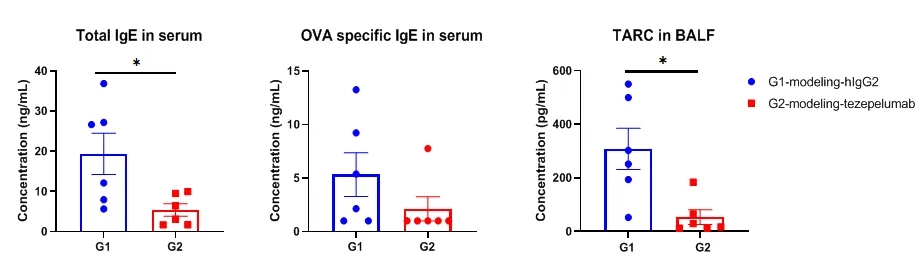
在用抗TSLP抗体治疗的小鼠哮喘模型中,血清中的OVA特异性IgE和BALF中的TARC显著降低。在研究终点采集血清。通过ELISA分析IgE和TARC水平。结果显示,用zepelumab(内部)治疗的小鼠的OVA特异性IgE和TARC水平低于未治疗的小鼠。数值表示为平均值±SEM。TARC:胸腺和活化调节趋化因子,也称为CCL17(C-C基序趋化因子配体17)。
B-hTSLP/hTSLPR mice plue哮喘样模型的H&E染色
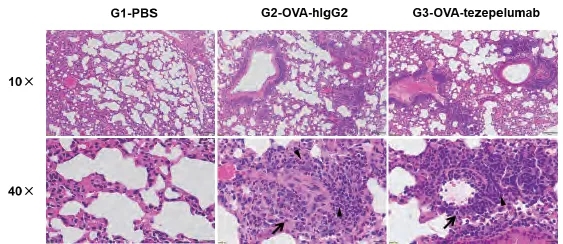
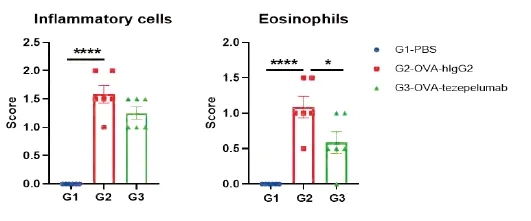
在研究终点收集肺组织,并用H&E染色进行分析。结果显示,与未治疗组(G1)相比,用zepelumab(内部)治疗的小鼠组肺组织中的炎症浸润和粘液分泌显著减少,表明B-hTSLP/hTSLPR mice plus加成物为体内评估抗人TSLP抗体提供了强大的临床前模型。黑箭头:炎症细胞;黑三角:嗜酸性粒细胞;星号:粘液。数值表示为平均值±SEM。
B-hTSLP/hTSLPR mice plue哮喘样模型的PAS染色
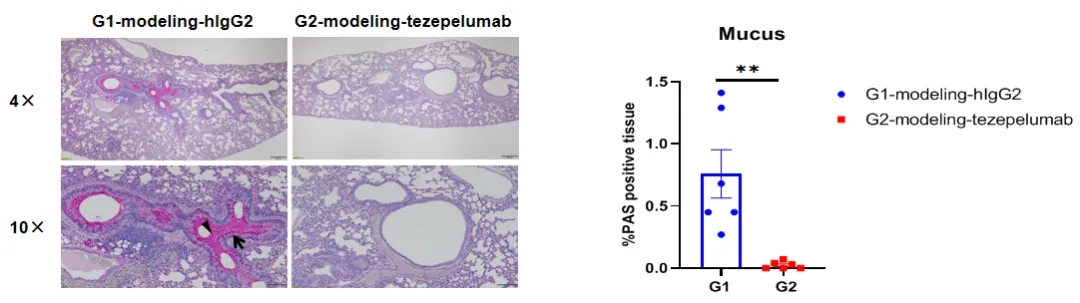
在研究终点收集肺组织,并用PAS染色进行分析。与未治疗组(G1)相比,用zepelumab治疗的小鼠组(内部)肺组织粘液分泌显著减少。箭头:杯状细胞;三角形:粘液。数值表示为平均值±SEM。
HDM诱导的急性哮喘模型的构建及验证
哮喘小鼠模型的建立
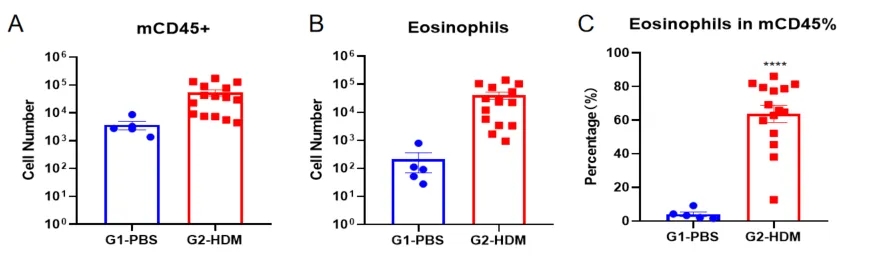
哮喘小鼠模型肺泡灌洗液(BALF)中免疫细胞的数量
哮喘小鼠模型血清中IgE水平
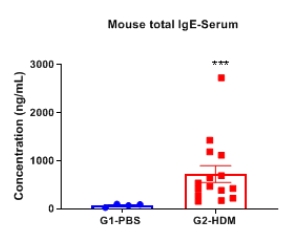
与对照组相比,HDM诱导的小鼠血清中IgE水平升高。实验终点取血清,ELISA法测定总IgE浓度。
H&E染色病理分析
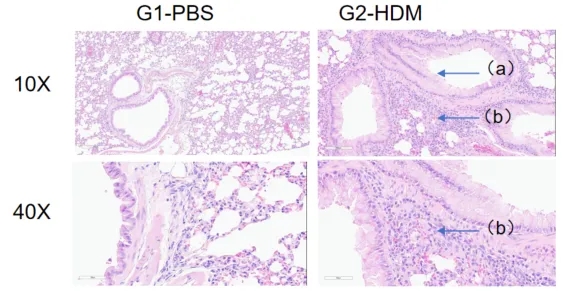
哮喘小鼠肺部H&E染色分析。与G1组相比,HDM处理后的G2模型动物出现哮喘相关病变,部分支气管血管和支气管周围混合炎性细胞浸润(b)、黏液形成(a)。以上结果表明,HDM可成功诱导野生型C57BL/6小鼠哮喘。
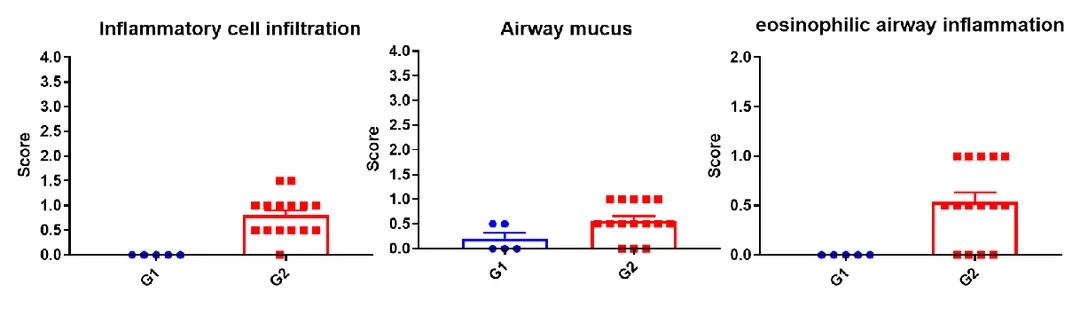
Dupilumab(抗人IL4RA抗体药物)在人源化B-hIL4/hIL4RA哮喘小鼠中的药效评估
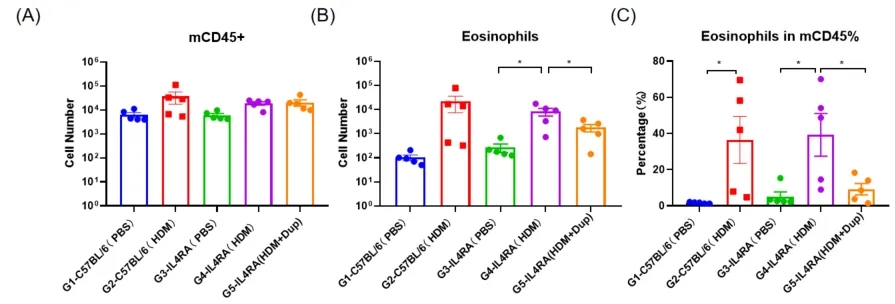
采用HDM法建立B-hIL4/hIL4RA小鼠哮喘模型。(A) BALF中CD45 +细胞的数量。(B) BALF中嗜酸性粒细胞的数量。(C)嗜酸性粒细胞占CD45 +细胞的比例。结果显示,经HDM致敏和激发后,G4模型组小鼠白细胞浸润较G3对照组明显增加,嗜酸性粒细胞含量明显增加,提示模型建立成功。给药25mg/kg dupilumab(内部合成)后,CD45 +细胞和嗜酸性粒细胞数量明显低于G3模型组。
哮喘小鼠模型血清中IgE水平
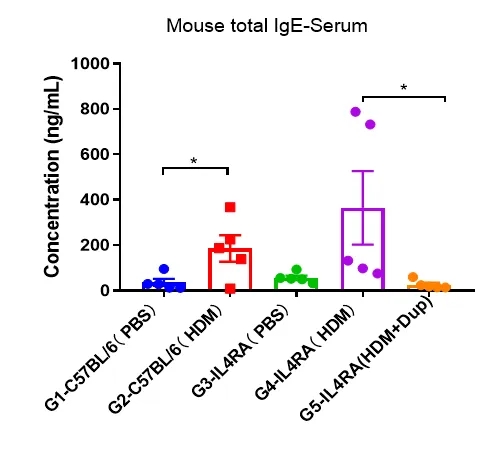
实验终点取血清,采用ELISA法测定血清总IgE水平。结果显示,与G3对照组相比,G4模型组大鼠总IgE水平明显升高,表明造模成功。与G5模型组相比,给药dupilumab(内部合成)后总IgE水平显著降低。
ALT诱导的小鼠哮喘模型的构建及验证
哮喘小鼠模型建立
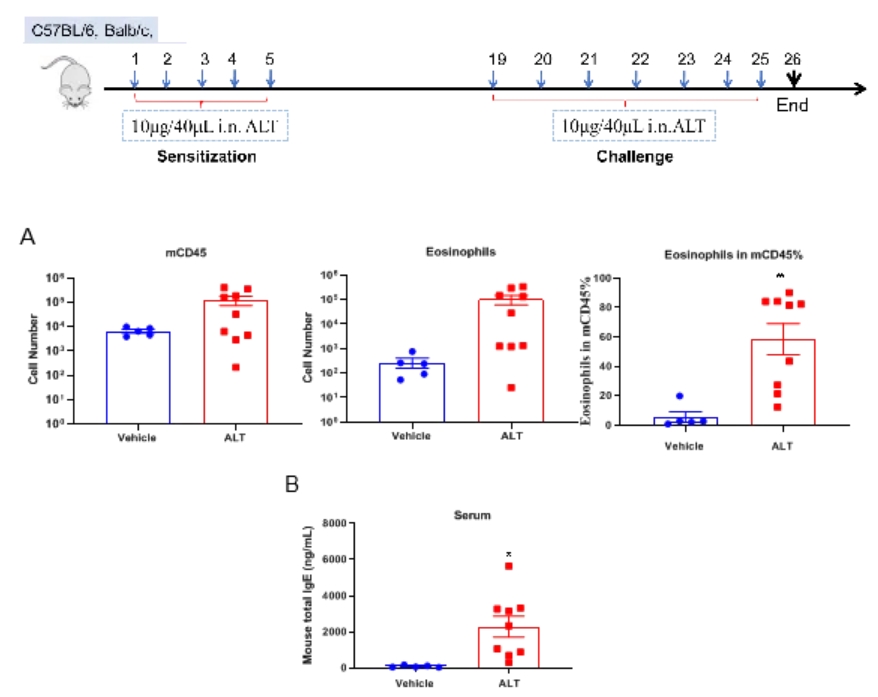
基于C57BL/6小鼠的ALT诱导的哮喘小鼠模型的BALF中免疫细胞的定量和血清中总IgE水平。(A) 在用ALT致敏和激发后,CD45+细胞群中CD45+的细胞数、嗜酸细胞和嗜酸细胞比例。(B)在实验终点采集血清,并使用ELISA测量总IgE的浓度。数值表示为平均值±SEM。*p<0.05,**p<0.01。
哮喘小鼠模型肺组织组织学评价
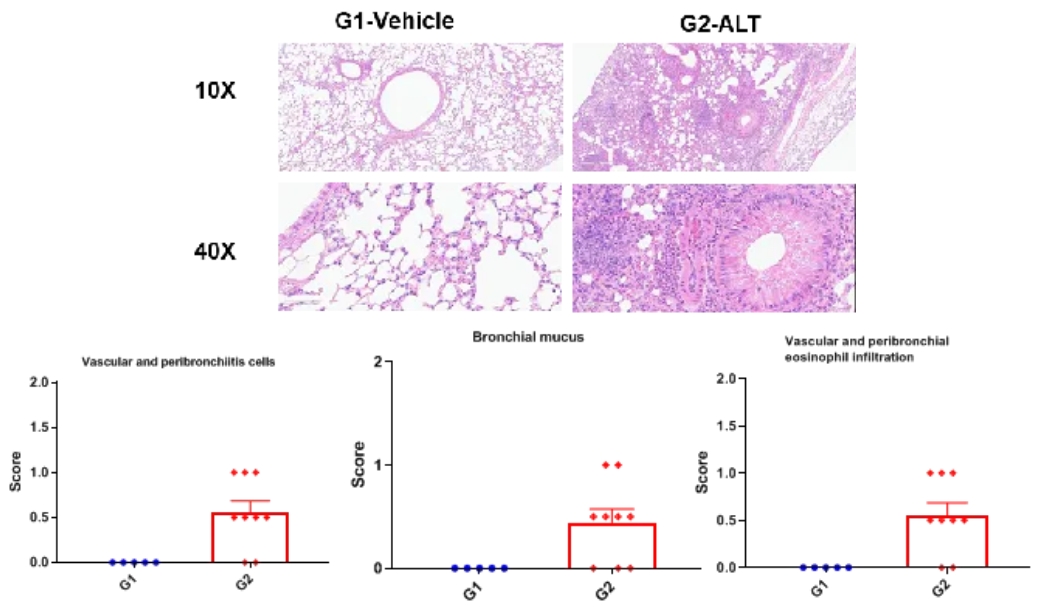
支气管哮喘小鼠肺组织H&E染色。ALT诱导的哮喘模型动物出现哮喘相关的病理改变,表现为血管和支气管周围混合性炎症细胞浸润,部分支气管出现黏液形成。ALT治疗后细胞评分、血管和支气管周围嗜酸性粒细胞浸润增加。
参考文献
[1]doi:10.1038/nrdp.2017.74
[2]https://doi.org/10.1183/16000617.0067-2021
[3]Brusselle GG, Maes T, Bracke KR. Eosinophils in the spotlight: Eosinophilic airway inflammation in nonallergic asthma. Nat Med. 2013;19(8):977-979. doi:10.1038/nm.3300
[4]Durrant, D.M.and D.W.Metzger,Emerging roles of T helper subsets in the pathogenesis of asthma. Immunol Invest, 2010.39(4-5):p.526-49.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号