百奥动物明星产品重度免疫缺陷B-NDG小鼠缺乏成熟的T、B和NK细胞,适合人源细胞或组织移植,可以构建CDX、PDX和人免疫系统重建等模型。同时,为了解决B-NDG小鼠进行PBMC重建后的GvHD反应,进行CD34+ HSC重建后的NK细胞和髓系细胞重建比例不足等问题,我们开发了系列B-NDG二代小鼠,以满足特定细胞功能研究和相应靶点药物评价的需求。
如今,B-NDG小鼠家族已广泛应用于科学研究和药物评价中,频现各大学术期刊,截止2023年底客户发表文章240+,影响因子累计2400+。让我们一起看看B-NDG家族如何助力高分文章吧!

发表文章期刊封面(来源:期刊官网)
01、B-NDG家族在肿瘤转移机制研究中的应用
2023年2月13日,四川大学华西医院生物治疗国家重点实验室石虎兵课题组联合四川大学华西医院马学磊课题组在Cancer Cell发表研究论文《Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance》。
目前对于原发或转移性肿瘤中的免疫检查点正在开展很多研究,但对循环中的肿瘤细胞(CTC)如何逃避免疫监视很大程度是未知的。本研究中,作者经过体外和体内细胞相互作用分析和功能研究表明CTC和NK细胞通过免疫检查点分子对HLA-E:CD94-NKG2A相互作用。通过阻断NKG2A或敲低HLA-E表达可增强NK介导的体外肿瘤细胞杀伤作用,并防止体内肿瘤转移。机制研究表明,血小板来源的RGS18通过AKT-GSK3b-CREB信号传导促进HLA-E的表达,并且RGS18的过度表达促进胰腺肿瘤肝转移。总之,血小板衍生的RGS18通过参与免疫检查点HLA-E:CD94-NKG2A来保护CTC免受NK介导的免疫监视,可通过免疫消除CTC,阻断这一抑制信号传导,来防止体内肿瘤转移。
本文中研究者利用B-NDG hIL15小鼠进行NK细胞移植实验,发现RGS18的促转移功能取决于NK细胞的存在。
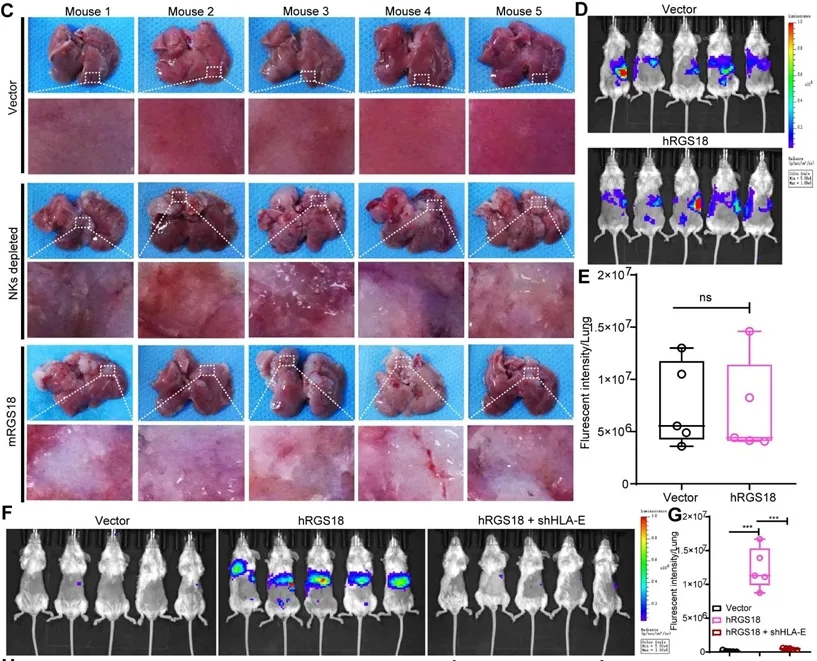
图1.利用SU86.86肝转移模型评估NK细胞在预防肿瘤转移中的重要作用
(D, E) 采用hIL15-B-NDG mice(不移植NK细胞)通过半脾接种SU86.86-Luc(有或没有RGS18过表达)建立肝转移模型。肿瘤接种后14天,通过生物发光成像系统对肝转移进行可视化(D)和定量(E)。
(F, G) 注射SU86.86-Luc细胞的B-NDG hIL15小鼠进行肝转移的生物发光图像(F)和定量(G)。B-NDG hIL15小鼠经静脉内预移植人NK。然后将小鼠半脾接种有或没有RGS18过表达的SU86.86-Luc细胞或具有HLA-E敲低的RGS18-SU86.86-Luc细胞。
2024年2月14日,中国医学科学院基础医学研究所王冬来课题组在Nature Communications发表研究论文《Oncoprotein SET-associated transcription factor ZBTB11 triggers lung cancer metastasis》。
转移是肺癌相关死亡的主要原因,但控制肺癌转移的机制仍未完全阐明。SE易位 (SET) 在肺癌中过度表达,并与不良预后相关。本研究中,作者发现 SET 相关转录因子、锌指和 BTB 结构域蛋白11 (ZBTB11) 是肺癌中的促转移调节剂。SET与ZBTB11相互作用并协同作用,促进肺癌细胞迁移和侵袭,主要通过SET-ZBTB11复合物介导的基质金属蛋白酶 9 (MMP9) 转录激活。此外,独立于SET-ZBTB11复合物,ZBTB11通过转录抑制富含脯氨酸的Gla蛋白2 (PRRG2),连接Yes相关蛋白1 (YAP1)的激活。
本文中研究者利用B-NDG小鼠和不同H1299改造的细胞建立皮下移植肺癌模型,数据表明SET-ZBTB11复合物在调节肺癌细胞转移方面发挥着关键作用,MMP9 是 SET-ZBTB11 复合物介导调节肿瘤转移的关键下游效应物之一,PRRG2是ZBTB11的直接靶点有助于ZBTB11而非SET介导的肿瘤转移调控。
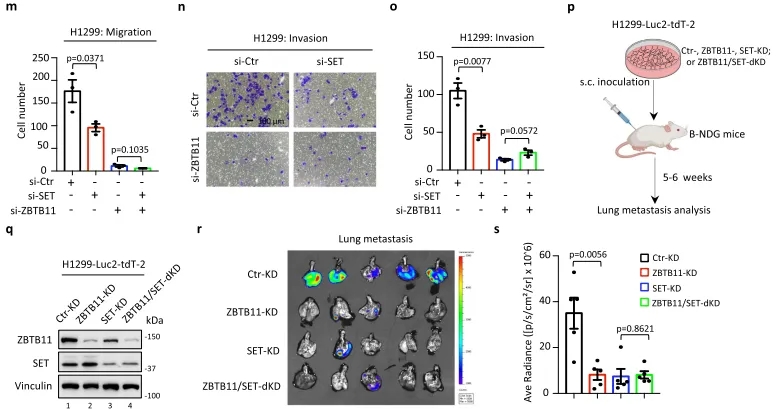
图2.p.分析体内肿瘤转移的实验流程示意图。q. H1299-Luc2-tdT-2细胞中转染shRNA的WB分析。r.在小鼠模型中,将有或没有 SET/ZBTB11 敲低的H1299-Luc2-tdT-2细胞皮下接种到免疫缺陷B-NDG小鼠侧腹中,原发性肿瘤肺转移的生物发光图像。s.基于(r)对肺部癌细胞转移的定量分析。
02、B-NDG小鼠在药物耐药机制研究中的应用
2023年4月5日,中国科学院上海药物研究所李佳课题组联合上海长海医院杨建民课题组在Nature communications发表研究论文《Targeting C/EBPα overcomes primary resistance and improves the efficacy of FLT3 inhibitors in acute myeloid leukaemia》。
自FLT3抑制剂 (FLT3i) 获批以来,FLT3-ITD急性髓系白血病 (AML)的治疗结果有所改善。然而,大约30-50%的患者对FLT3i表现出原发性耐药 (primary resistance, PR),且机制不明确,这带来了迫切的临床未满足需求。本研究中,作者通过分析Vizome中原发性 AML 患者样本的数据,确定CCAAT增强子结合蛋白-α(C/EBPα)激活是PR的主要特征。C/EBPα激活限制了FLT3i的功效,而其失活则协同增强了FLT3i在细胞和动物模型中的作用。此外,作者发现胍法辛(Guanfacine)在体外和体内与FLT3i发挥协同作用,是潜力的联用治疗方案。
本文中研究者利用B-NDG小鼠分别移植MV-4-11、MOLM -13细胞,发现C/EBPα过表达显著降低FLT3i处理组的AML小鼠生存期,C/EBPα活性下调可以提升AML荷瘤小鼠生存期。胍法辛作为α2去甲肾上腺素受体激动剂具有抑制C/EBPα转录调控作用,联合用药能够显著提升FLT3i的抗AML活性,提升荷瘤小鼠生存期。
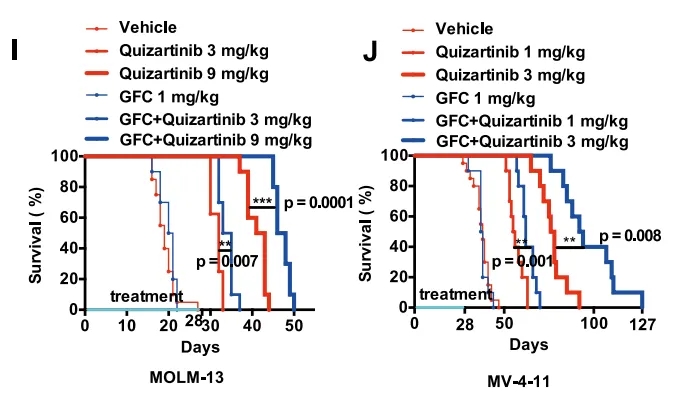
图3. I. 用对照(22% Beta-CD,n=20)、Quizartinib(3 或 9 mg/kg,n=10)、GFC(1 mg/kg,n=10)或联合(n=10)处理的B-NDG小鼠播散性异种移植MOLM-13细胞模型的存活曲线。J.用对照(22% Beta-CD,n=20)、Quizartinib(1或3 mg/kg,n=10)、GFC(1 mg/kg,n=10)或联合(n=10)处理的B-NDG小鼠播散性异种移植MV-4-11细胞模型的存活曲线。
03、B-NDG小鼠在细胞基因疗法研究中的应用
2023年1月17日,深圳大学刘宇辰课题组联合梅红兵在Genome Biology发表研究论文《Enhanced RNA knockdown efficiency with engineered fusion guide RNAs that function with both CRISPR-CasRx and hammerhead ribozyme》。
CRISPR-Cas13是一种新兴的RNA敲除技术,可与RNAi相媲美。在Cas13的所有成员中,CasRx能够高精度、高效地降解人体细胞中的RNA。然而,目前尚不清楚该技术的效率是否可以进一步提高并应用于基因治疗。本研究中,作者将CasRx crRNA与反义核酶融合,构建了一种合成的融合引导RNA,它可以与CasRx蛋白和核酶相互作用,并测试了这种方法在RNA敲低和癌症基因治疗中的能力。研究证明,CasRx-crRNA-核酶系统(CCRS)对于mRNA和非编码RNA的RNA敲低比传统方法更有效。同时,作者使用膀胱癌作为模型来评估CCRS 靶向多个基因的体外和体内抗癌效果。CCRS显示出比传统方法更高的抗癌效果,表明CCRS扩展了Cas13技术的设计思路和RNA敲除能力,并具有用于疾病治疗的潜力。
本文中研究者利用B-NDG小鼠构建了T24膀胱癌模型,发现CCRS在体内抑制肿瘤生长方面优于CasRx 和shRNA,并且可以显著抑制肺转移肿瘤的生长。
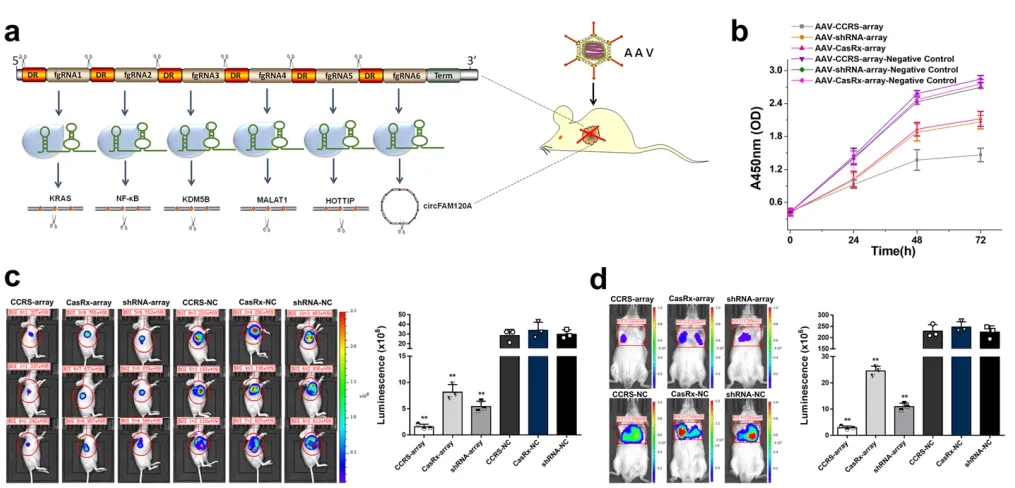
图4. CCRS在肿瘤细胞中的多基因靶向和腺相关病毒 (AAV) 递送。a. AAV递送的CCRS示意图,通过靶向多种癌基因有效抑制肿瘤。b.采用CCRS和其他现有技术处理的膀胱癌 T24 细胞的生长曲线。c. AAV-CCRS有效抑制体内肿瘤生长。d.转移模型生物发光成像的定量。
2023年3月8日,上海科技大学王皞鹏课题组与复旦大学附属眼耳鼻喉科医院吴海涛课题组、中科院分子细胞科学卓越创新中心许琛琦课题组,及上海市第一人民医院宋献民课题组联合在Cell Research上发表研究论文《Tuning charge density of chimeric antigen receptor optimizes tonic signaling and CAR-T cell fitness》。
嵌合抗原受体(CAR)的强直信号传导,即在没有肿瘤抗原刺激的情况下自发的CAR激活,被认为是控制CAR-T功效的关键事件。然而,自发CAR信号的分子机制仍然难以捉摸。本研究中,作者揭示了CAR抗原结合域表面的带正电荷的斑块 (PCP)介导CAR聚集并导致CAR强直信号传导。对于具有高强直信号的CAR(例如 GD2.CAR 和 CSPG4.CAR),减少CAR上的PCP或提高培养基离子强度可最大限度地减少自发 CAR 激活并缓解CAR-T细胞耗竭。相反,将PCP引入具有弱强直信号的CAR,例如CD19.CAR,可提高体内持久性和卓越的抗肿瘤功能。结果表明,CAR强直信号传导是由 PCP 介导的 CAR 聚集诱导和维持的,合理调整PCP以优化CAR-T细胞的强直信号传导和体内适应性是下一代CAR的一种有前景的设计策略。
本文中研究者利用B-NDG小鼠建立CHLA-255神经母细胞瘤模型,测试GD2F4.CAR-T细胞在体内的药效,发现GD2+肿瘤细胞被有效清除,而GD2WT.CAR-T细胞转移的小鼠表现出无法控制的肿瘤进展和缩短的生存期。
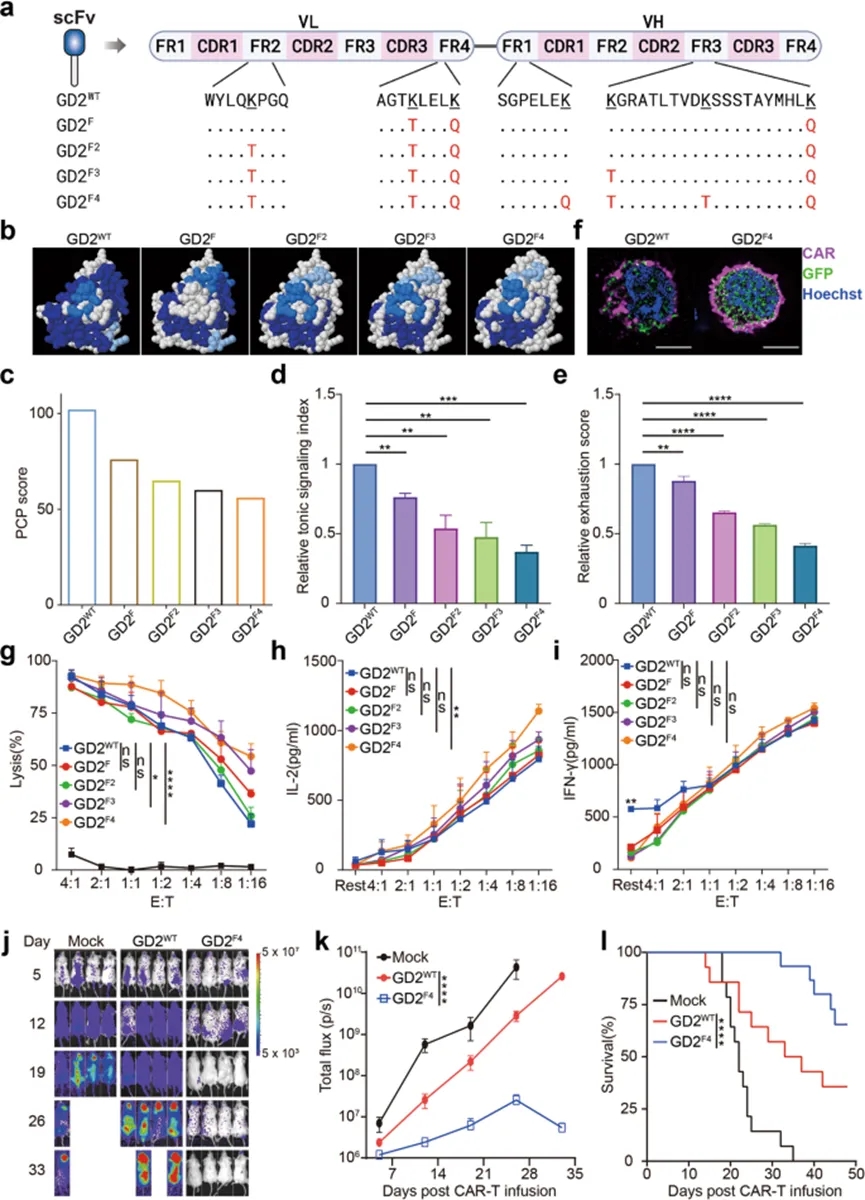
图5. 减少CAR表面的PCP可减轻高CAR信号引起的T细胞耗竭。a.优化的GD2.CAR变体的序列。b.优化的 GD2.CAR scFv 表面上前三个最大的 PCP。c.计算优化的GD2.CAR scFvs的PCP分数。d.计算优化的GD2.CAR scFvs的相对紧张信号指数。e.计算优化的GD2.CAR scFvs的相对衰竭分数。f. GD2WT和GD2F4.CAR-T细胞上CAR聚类的成像分析。g.针对WT和突变的GD2.CAR-T细胞的GD2+神经母细胞瘤细胞系 CHLA-255的体外杀伤试验。h,i.激活后CAR-T细胞的细胞因子检测。j.GD2WT和GD2F4.CAR-T输注后随时间推移的肿瘤负荷代表性生物发光图像。k.使用IVIS系统对j中所示每只小鼠的荧光素酶强度(反映肿瘤负荷)进行量化。l. j中所示小鼠的生存曲线。
04、B-NDG小鼠在联合免疫疗法研究中的应用
2023年4月10日,陆军军医大学第一附属医院刘新东、卞修武、王岩课题组和第二附属医院吕胜青课题组联合在Cancer Cell上发表研究论文《Neutralizing IL-8 potentiates immune checkpoint blockade efficacy for glioma》。
恶性胶质瘤对免疫检查点阻断疗法大多具有耐药性。本研究中为了探索潜在的免疫调节剂,作者检测了胶质瘤中的微环境,发现肿瘤浸润性T细胞主要局限于血管周围,并表达高水平CCR5、CXCR3 和PD-1。T细胞聚集与TCR克隆扩增的综合分析表明,潜在的肿瘤杀伤性T细胞主要分为耗竭前、耗竭和效应CD8+ T亚群,以及细胞毒性 CD4+ T亚群。CD4+ T细胞的一个独特亚群表现出先天性特征,优先表达IL-8。产生IL-8的 CD4+ T、髓系和肿瘤细胞协调髓系来源的抑制细胞浸润和血管生成,从而增强肿瘤生长降低ICB疗效。抗体介导的IL-8阻断或其受体 CXCR1/2的抑制可释放抗 PD-1 介导的抗肿瘤免疫。研究结果表明IL-8 是神经胶质瘤联合免疫治疗靶点。
本文中研究者利用B-NDG小鼠构建U373-Luc原位神经胶质瘤模型,接受IL-8+CD4+ T细胞的小鼠显示出显著的肿瘤生长。肿瘤浸润免疫细胞的体外分析表明,IL-8+CD4+ T接受组的CD45+CD11b+Gr1+髓系细胞大大增加。研究表明IL-8+ CD4+ T细胞在肿瘤中具有促肿瘤、骨髓白细胞趋化性和促血管生成等功能。
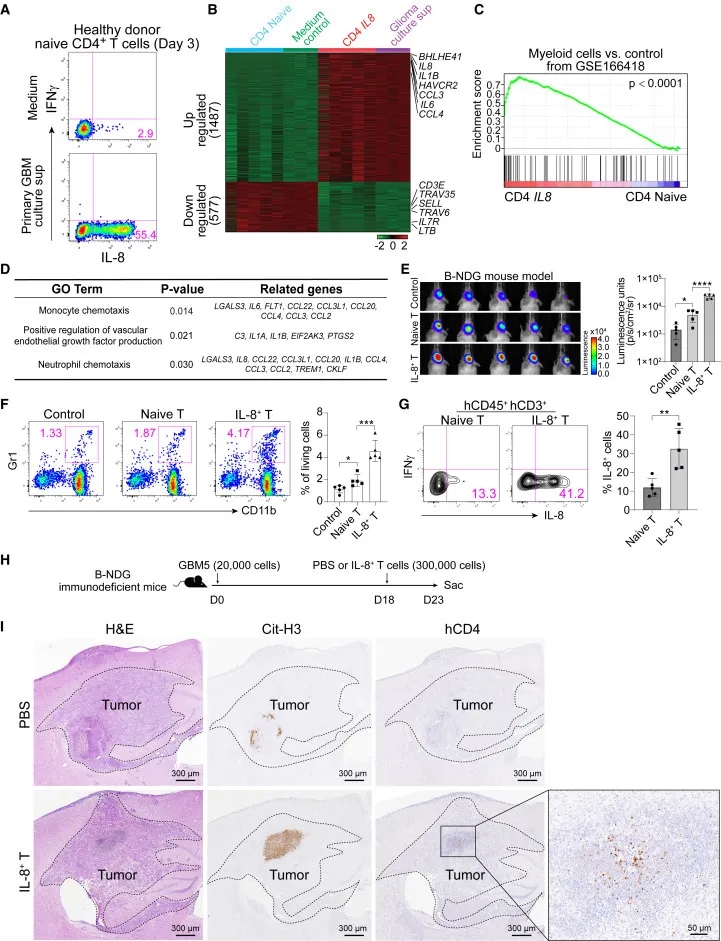
图 6. IL-8+ T 细胞的转录和功能鉴定。(A)将初始CD4+ T细胞与对照培养基或原代胶质瘤细胞上清液共同培养3天,通过流式细胞术测量IL-8表达。(B)热图显示对照CD4+ T 细胞(培养基对照)、胶质瘤培养上清液极化CD4+ T细胞(胶质瘤培养上清液对照)以及 scRNA-seq 数据的CD4-Naive和 CD4-IL8的转录评估。(C)基因集富集分析 (GSEA) 测量了CD4-Naive和CD4-IL8簇中髓系细胞相关基因的富集。(D)体外胶质瘤培养上清液极化CD4+ T细胞和体内CD4-IL8簇中上调基因的基因本体论(GO)分析。(E)荷瘤小鼠的体内生物发光成像。(F)流式细胞术分析(E)中肿瘤的髓系细胞百分比。(G)流式细胞术分析T细胞中IL-8的表达。(H)实验方法示意图。(I)使用抗瓜氨酸化组蛋白H3 (Cit-H3)和肿瘤组织人CD4的抗体进行H&E或IHC染色。
B-NDG系列小鼠列表







 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号