高尿酸血症是一种常见的由嘌呤代谢障碍引起代谢性疾病,众所周知,高尿酸血症是导致痛风和泌尿结石的危险因素。甚至有报道称,霸王龙可能患有痛风[1]。近年来我国高尿酸血症发病人数呈上升趋势,且发病人群趋于年轻化。
靶点概述
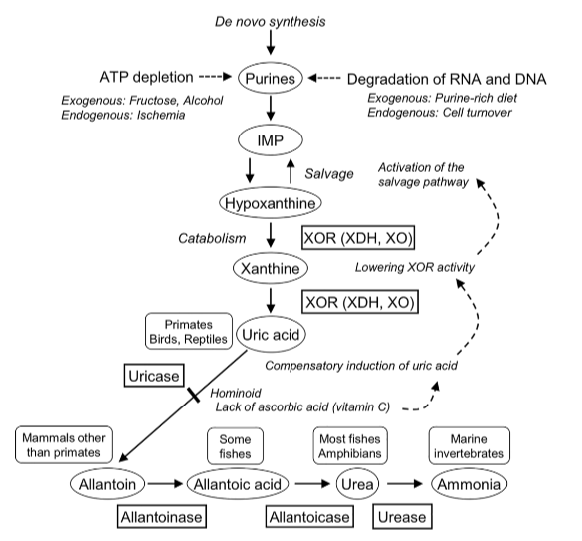
图1. 动物体内嘌呤代谢进化[2]
XDH全称Xanthine dehydrogenase(黄嘌呤脱氢酶),属于钼-黄素酶家族,是一类参与嘌呤氧化代谢的含钼羟化酶,又名XAN1。能够催化次黄嘌呤氧化为黄嘌呤再氧化为尿酸,同时产生活性氧。XDH可以通过可逆的巯基氧化或不可逆的蛋白水解修饰转化为XO(Xanthine oxidase),两者合称XOR(xanthine oxidoreductase),都能以黄嘌呤或者次黄嘌呤为底物,但所使用的辅因子不同,最终产生 NADH或者O2。
哺乳动物中XDH在多种组织中表达,具体组织分布有物种差异性,在人和小鼠中表达最高的器官是肝脏和小肠[3]。XDH主要位于胞浆,过氧化物酶体中也有存在。此外,血浆及奶汁中也可以检测到。血浆中的XDH 主要源于肝细胞更新中死亡细胞的释放,多以XO的形式存在。在一些病理条件下,血浆XO 含量显著提升,例如病毒性肝炎,感染性单核血球病,风湿病和自身免疫性疾病等。
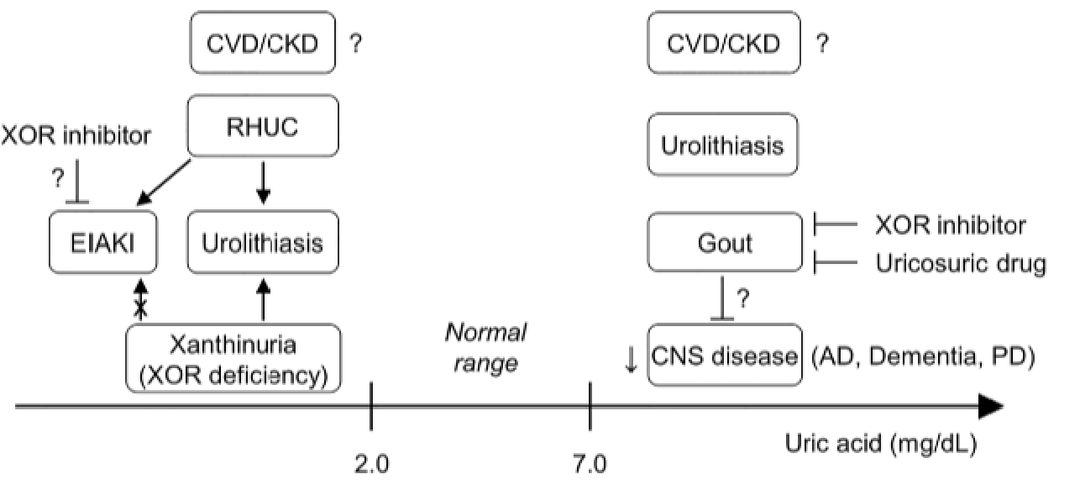
图2. 由高尿酸血症和低尿酸血症引起的尿酸相关疾病[2]
黄嘌呤脱氢酶缺陷可引起黄嘌呤尿症,可能导致成人呼吸应激综合征,并可能通过氧代谢物依赖机制增强流感感染。人类和灵长类动物的嘌呤代谢途径中缺乏尿酸氧化酶,不能将尿酸降解成极易溶于水的尿囊素,只能经肾脏排泄绝大部分尿酸。临床上,尿酸水平>7 mg/dL尿酸过多或排泄不足会导致血清中尿酸水平升高,被称为高尿酸血症。高尿酸血症与痛风有明确的因果关系,同时也是高血压、糖尿病、心血管疾病以及肾脏等疾病的危险因素。
新药研究进展
截至目前,全球以XDH为靶点的在研药物共790 项,其中大多数为小分子药物,少量核酸或蛋白多肽类药物。已上市药物9项,III期1项,II期6项,I期4项,临床前 113项。目前活跃在研抗体类药物,仅有1项,处于生物测试阶段,原研单位为中国药科大学。核酸类药物6项,均为SiRNA,原研单位包括Alnylam、Arrowhead以及苏州瑞博生物。目前进度最快的处于I/II期临床,为Alnylam的ALN-XDH。
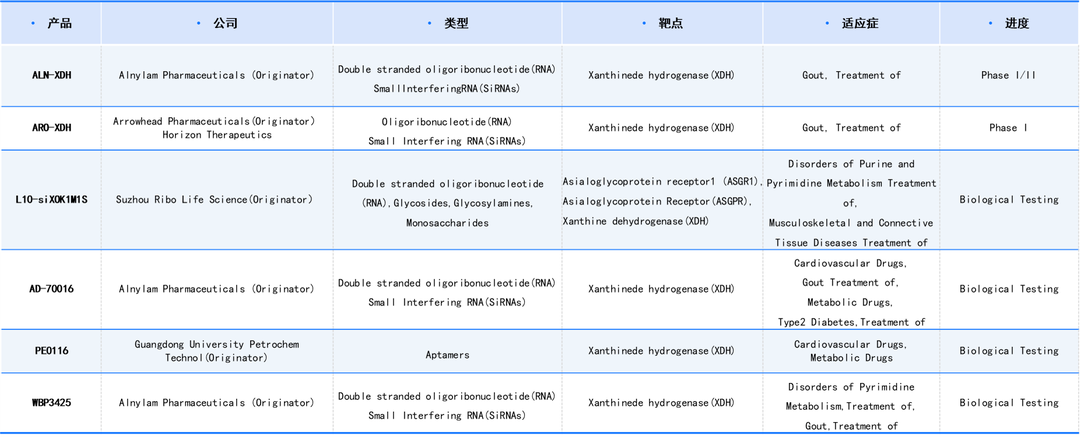
数据来源于科睿唯安
B-hXDH mice plus
百奥动物建立了稳定的B-hXDH小鼠模型。B-hXDH plus小鼠XDH基因的外显子1替换为人XDH CDS以及人5'UTR和人3'UTR区域。因此,B-hXDH plus小鼠可用于对靶向基因调节区域的核酸药物进行药理药效评价,助力高尿酸血症、痛风等疾病的药物临床前研究。
蛋白表达分析

Western blot分析纯合B-hXDH plus小鼠中种属特异性XDH的表达。收集野生型C57BL/6小鼠和纯合B-hXDH plus小鼠的组织,使用已知交叉反应性抗XDH抗体进行Western blot分析。XDH蛋白在野生型C57BL/6小鼠和纯合B-hXDH plus小鼠中均能检测到。
mRNA表达检测
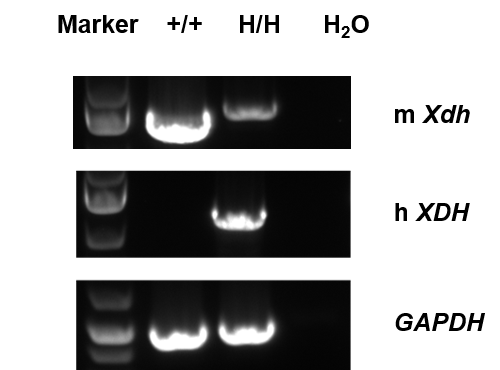
通过RT-PCR对野生型C57BL/6小鼠和B-hXDH plus小鼠的XDH基因表达进行种属特异性分析。小鼠XDH mRNA在C57BL/6小鼠和纯合B-hXDH plus小鼠中均可检测到。人XDH mRNA仅在纯合B-hXDH plus小鼠中检测到,而在野生型小鼠中检测不到。测序结果显示,纯合B-hXDH plus小鼠中存在小鼠XDH mRNA。
核酸药物对XDH表达水平的抑制效果

核酸类药物对B-hXDH plus小鼠肝组织中人XDH mRNA的抑制效果。B-hXDH plus小鼠随机分为3组(每组n=3,8周龄)。小鼠分别给予人XDH靶向核酸药物(根据专利合成)和PBS。核酸药物以PBS水溶液形式给药。G1组仅用PBS水溶液处理。根据动物体重计算给药剂量。第7天处死小鼠并收集肝脏组织,通过qPCR检测人XDH mRNA表达水平。A. 实验处理示意图。B. 治疗后肝脏中人XDH mRNA的表达。治疗组抑制率为83.4%,说明B-hXDH plus小鼠为人XDH靶向核酸药物的体内评价提供了强有力的临床前模型。数值以平均值±SEM表示。
本期分享到此结束,如果您对相关小鼠模型有需求,欢迎随时与我们联系。
参考文献
1.Rothschild BM, Tanke D, Carpenter K. Tyrannosaurs suffered from gout. Nature 387: 357, 1997. doi:10.1038/387357a0
2. Furuhashi M. New insights into purine metabolism in metabolic diseases: role of xanthine oxidoreductase activity. Am J Physiol Endocrinol Metab. 2020 Nov 1;319(5):E827-E834. doi: 10.1152/ajpendo.00378.2020. Epub 2020 Sep 7. PMID:32893671.
3. Battelli MG, Bolognesi A, Polito L. Pathophysiology of circulating xanthine oxidoreductase: new emerging roles for a multi-tasking enzyme. Biochim Biophys Acta. 2014 Sep;1842(9):1502-17. doi: 10.1016/j.bbadis.2014.05.022. Epub 2014 May29. PMID: 24882753.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号