中文
世界过敏性疾病日 | 远离过敏,趁早预防,对因治疗是关键!
来源:BioMice百奥动物
时间:2023-07-07
导读
近30年来,过敏性疾病的发生概率至少增加了3倍,目前全球总患病率已达22%。预计在20年后,工业化国家50%的人口将患上过敏性疾病。
过敏,常常被误认为是皮肤或是呼吸道的一种反应,实际上,过敏轻则影响日常生活,重则危及生命健康,今年是第19个世界过敏性疾病日,已被世界卫生组织(WHO)列为21世纪重点防治的三大疾病之一。
背景概述
过敏性疾病是一种常见病、多发病和潜在的致命疾病,又称变态反应性疾病,是因为病人敏感性过高,在血液中产生一种对某种特殊的过敏原过敏的特异性免疫球蛋白E抗体(IgE),这种病人有遗传倾向。
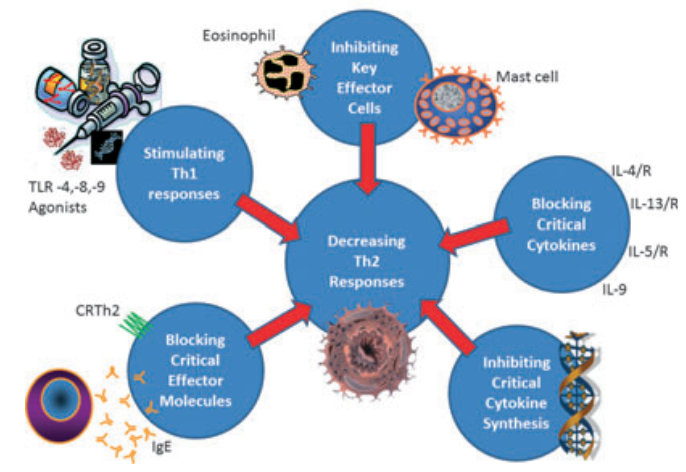
图1 过敏性疾病的免疫调节策略[1]
IgE敏感可导致以下几种典型的过敏性疾病:哮喘、特应性皮炎(AD)、过敏性鼻炎和食物过敏、药物过敏和过敏性休克等,最常见的是由花粉、尘螨、真菌和宠物等致敏因素引起的过敏性鼻炎和过敏性哮喘。
其中哮喘发病机制复杂,众多细胞因子(TSLP、 IL-33、IL4等)参与其中,阻断某一个细胞因子治疗哮喘只能达到部分效果,药物联合使用将是治疗该病的发展趋势。TSLP (thymic stromal lymphopoietin) 最早从小鼠胸腺基质细胞系中发现,主要表达于活化的肺和肠表皮细胞,也被成为“警报素”(alarmin)。其受体为由TSLPR和IL-7Ra组成的异源二聚体。TSLP可诱导II类免疫反应,也可直接作用于感觉神经元引起瘙痒。IL-33是另一种警报素,与TSLP一起加强II类炎症反应。
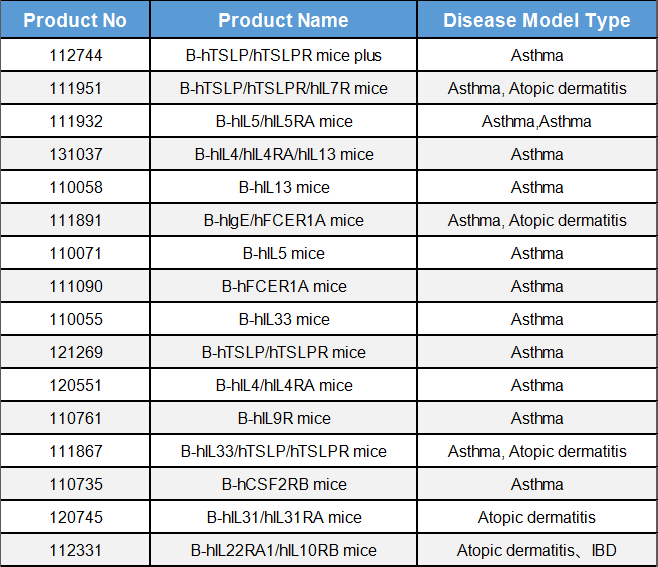
BioMice百奥动物自主开发了一系列哮喘(Asthma)模型及特应性皮炎(AD)模型相关靶点人源化小鼠,同时基于靶点人源化小鼠和野生型小鼠构建了相关疾病模型可用于药效评估,助力该疾病药物的临床前研究。部分模型数据如下:
B-hTSLP/hTSLPR mice plus
TSLP(Thymic Stromal Lymphopoietin, 胸腺基质淋巴细胞生成素)编码造血细胞因子,通过结合TSLP受体和IL-7Rα链的异二聚体受体复合物传递信号。主要影响髓系细胞,诱导单核细胞释放T细胞吸引趋化因子,促进CD11c(+)树突状细胞的成熟。该蛋白促进2型辅助性T细胞(TH2)反应,参与各种炎症性疾病中的免疫反应,包括哮喘、过敏性炎症和慢性阻塞性肺疾病。因此TSLP被认为是治疗这类疾病的潜在治疗靶点。
过敏原、细胞因子、病毒、细菌等多种触发因素可以激活肺和肠上皮细胞及角质形成细胞释放TSLP,并携带正电荷,TSLP与携带负电荷的TSLPR快速结合,然后与IL17Rα形成三元复合物,激活STAT3、STAT5和JAK2通路,启动促炎信号。
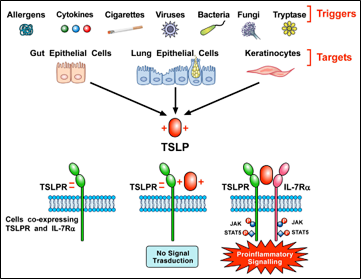
图2 TSLP的产生及信号转导[2]
hTSLPR在骨髓cDC1中的蛋白表达分析
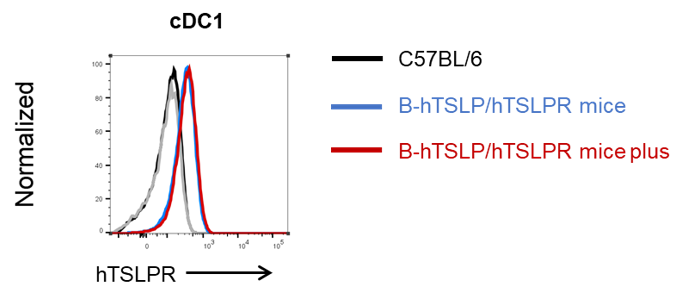
人TSLPR在来自骨髓的cDC1中的表达分析。收集野生型C57BL/6小鼠、纯合B-hTSLP/hTSLPR小鼠和B-hTSLP/hTSLPR plus小鼠骨髓。用种属特异性抗体通过流式细胞术分析在cDC1上表达的人TSLPR。人TSLPR在B-hTSLP/hTSLPR小鼠和B-hTSLP/hTSLPR plus小鼠的cDC1上高表达。
利用B-hTSLP/hTSLPR mice plus 构建哮喘小鼠模型
抗人TSLP抗体在哮喘小鼠模型中的体内药效
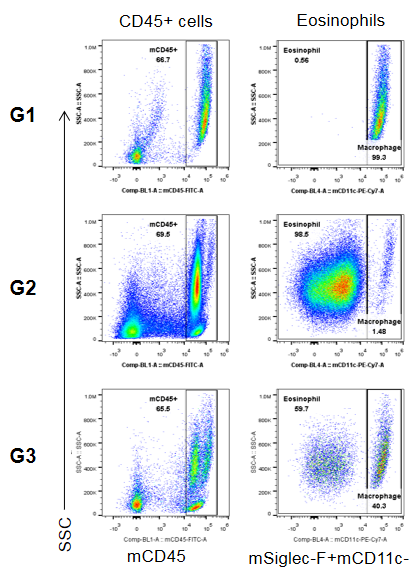
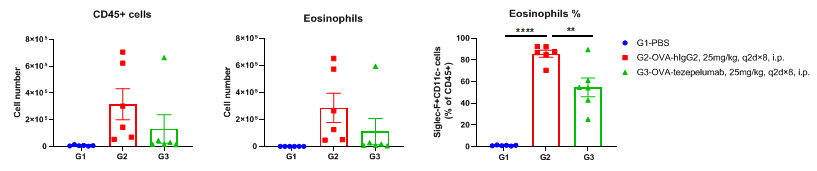
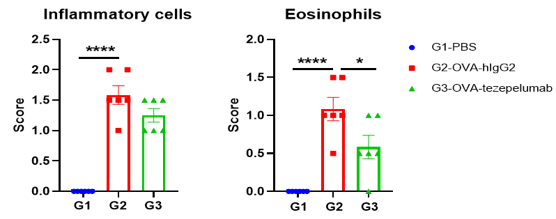
流式细胞术分析BALF中的免疫细胞。雄性B-hTSLP/hTSLPR plus小鼠用OVA免疫诱导建立小鼠哮喘模型(n=6)。在致敏阶段给予抗人TSLP抗体(Tezepelumab,内部合成)。实验结束后收集BALF,检测肺组织浸润炎性细胞。结果显示,嗜酸性粒细胞在OVA诱导但未处理组(G2)的比例显著高于非诱导组(G1),而处理组(G3)与G2组相比,嗜酸性粒细胞比例显著降低。G3组CD45+细胞和嗜酸性粒细胞数量也有下降趋势。结果表明,抗人TSLP抗体能有效降低经OVA诱导的B-hTSLP/hTSLPR plus小鼠嗜酸性粒细胞的数量和比例。
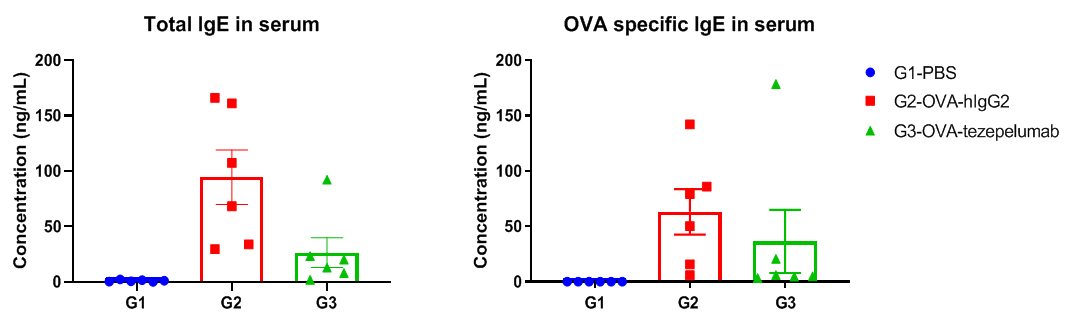
哮喘小鼠模型血清中OVA特异性IgE的产生水平。在实验终点收集血清,分析OVA特异性抗体反应的IgE水平。结果显示,接受tezepelumab治疗的小鼠体内IgE水平低于未接受治疗的小鼠。
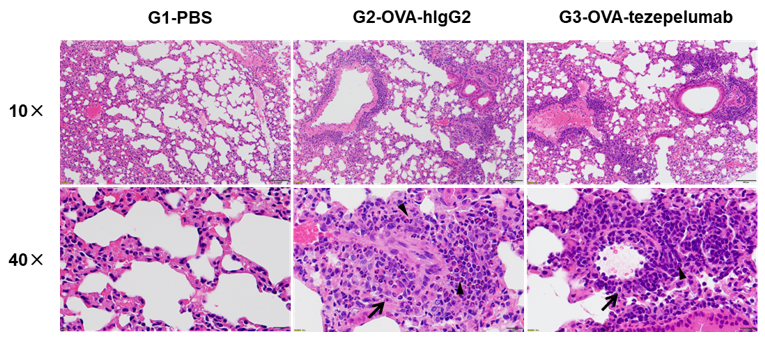
哮喘小鼠模型H&E染色。在实验终点收集肺组织,H&E染色结果显示接受PBS气雾剂的B-hTSLP/hTSLPR plus小鼠肺组织无任何炎症反应。接受OVA的B-hTSLP/hTSLPR plus小鼠支气管周和血管周炎症显著增加。在给予tezepelumab治疗的小鼠中观察到嗜酸性粒细胞浸润显著减少。黑色箭头:炎症细胞;黑色三角形:嗜酸性粒细胞。
B-hIL33 mice
白细胞介素33(IL33)属于IL1细胞因子超家族的成员,主要通过刺激Th2型细胞以及各种免疫细胞包括嗜碱性粒细胞、肥大细胞、嗜酸性粒细胞和天然辅助细胞 (natural helper,NH) 等表达ST2并产生Th2细胞因子(如IL4、IL5、IL13和趋化因子等),在各种过敏性炎症中发挥关键作用[3]。当IL33、ST2和IL1RAcP组成受体复合物可以作为细胞因子的“警报素”,将信息转移至胞内。
ST2和IL1RAcP组成的受体复合物在细胞损伤或机械损伤期间释放到细胞外,接收细胞外IL33信号导致Myd88、IRAK1/4和TRAF6募集,进一步促进转录因子NF-kB、JNK1/2和ERK1/2活化,引起炎症反应。IL-33已经进化出多种复杂的调控机制来控制其活性,包括核隔离和蛋白水解过程。它涉及许多疾病,包括过敏性、炎症性和感染性疾病,是治疗严重哮喘的一个有前景的靶点。
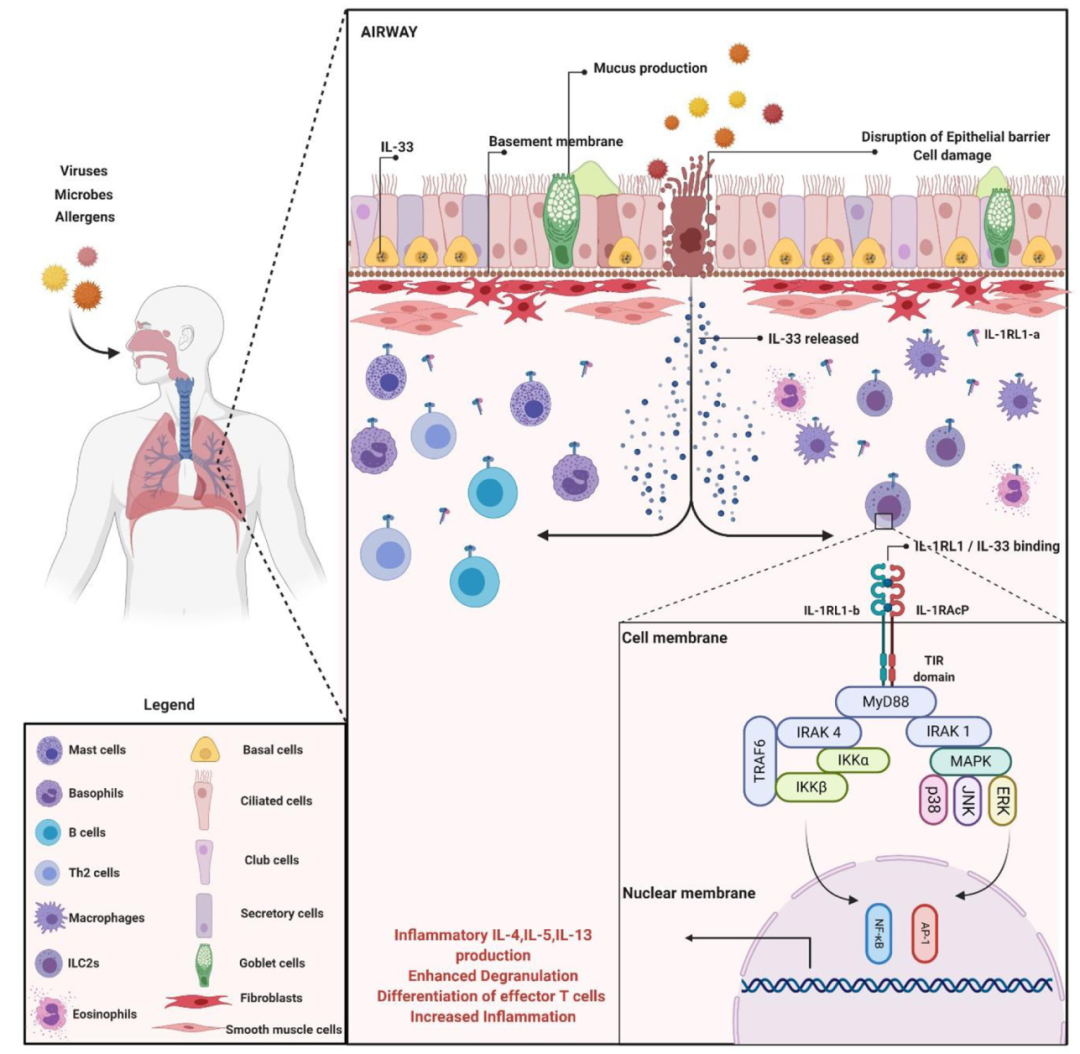
图3 IL-33/ST2在过敏性炎症中的信号通路[4]
利用B-hIL33 mice构建哮喘小鼠模型

急性哮喘小鼠模型中BALF免疫细胞的数量
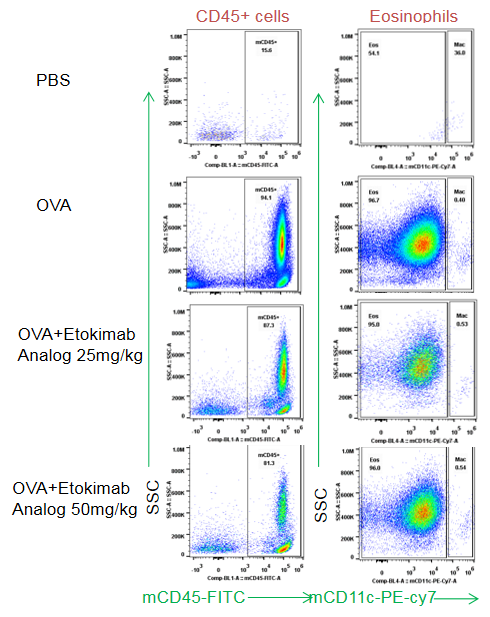

分离B-hIL33小鼠BALF免疫细胞(n=5)。在用或不用Etokimab类似物治疗的急性哮喘小鼠中,通过流式细胞术分析CD45+细胞和嗜酸性粒细胞的数量。与未经治疗的小鼠相比,接受Etokimab类似物的治疗可以减少纯合B-hIL33小鼠的炎症细胞。
B-hIL33小鼠哮喘模型中IgE的产生
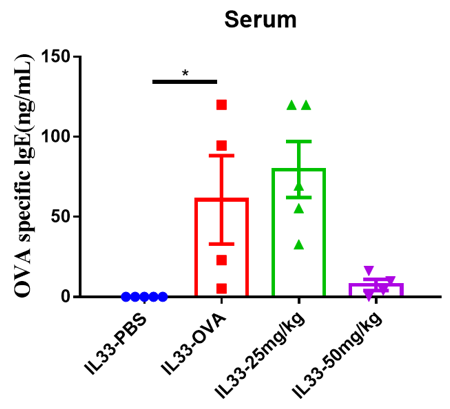
在研究终点采集血清。分析对OVA特异性抗体有反应的IgE水平,结果表明,接受Etokimab治疗的小鼠的IgE水平远低于未治疗的小鼠。
B-hIL33小鼠哮喘模型的H&E染色

在研究终点采集肺组织。H&E染色结果显示,暴露于PBS气溶胶的B-hIL33小鼠的气道未显示任何炎症。暴露于OVA导致B-hIL33小鼠支气管周围和血管周围炎症明显增加,粘液分泌水平增加。在接受Etokimab类似物治疗的小鼠中观察到炎症浸润和粘液分泌的减少。
表1. 过敏性疾病相关靶点人源化小鼠
过敏无小事,对于过敏,请大家平时多多注意预防。在明确过敏原后,我们应该尽可能地远离过敏原,规避过敏发生的可能。如果出现了过敏反应,也不要慌张,理性应对,及早就医,规范治疗。
参考文献
[1] Immunol Rev . 2011 Jul;242(1):258-71. doi: 10.1111/j.1600-065X.2011.01034.x.
[2] Varricchi G, Pecoraro A, Marone G, Criscuolo G, Spadaro G, Genovese A, Marone G. Thymic Stromal Lymphopoietin Isoforms, Inflammatory Disorders, and Cancer. Front Immunol. 2018 Jul 13;9:1595. doi:
[3] Yasuda K , Muto T , Kawagoe T , et al. Contribution of IL-33-activated type II innate lymphoid cells to pulmonary eosinophilia in intestinal nematode-infected mice[J].Proceedings of the National Academy of Sciences, 2012, 109(9):3451-3456.
[4] 10.3389/fimmu.2018.01595. PMID: 30057581; PMCID: PMC6053489.Kakkar, R., Lee, R. The IL-33/ST2 pathway: therapeutic targetand novel biomarker. Nat Rev Drug Discov.2008, 7: 827–840.https://doi.org/10.1038/nrd2660






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号