骨质疏松症被定义为一种全身性骨骼疾病,其特征是骨量低,骨组织微结构恶化,从而导致骨脆性增加,易发生骨折[1]。骨质疏松症的基本发病机制是骨形成和骨吸收的失调。
据统计,目前全世界大约2亿人患骨质疏松症,跃居各种常见病的第7位。据悉,2015~2019年全球骨质疏松症药物市场相对稳定,伴有小幅增长,2019年全球销售额为97.09亿美元。从TOP20的产品看,以RANKL抑制剂、甲状旁腺激素类似物、双膦酸盐类药物、钙剂与维生素D、选择性雌激素受体调节剂这五大类药物为主[2]。
骨质疏松症新药研究进展
进军骨质疏松症市场的两个新秀为地舒单抗和罗莫单抗,其中地舒单抗是首个且唯一获批的靶向RANKL单克隆抗体,通过阻断RANK和RANKL的结合来抑制破骨细胞的活性,在抑制成熟破骨细胞功能的同时,还可以抑制破骨前体细胞成熟,减少骨质吸收、促进骨重建,从而延迟和减少骨相关事件发生。值得一提的是,地舒单抗虽然获批较晚,但却是目前骨质疏松症药物市场的佼佼者。而罗莫单抗是一种人源化单克隆抗体(IgG2),可以抑制骨硬化蛋白(SOST)的活性,在加速骨形成的同时减少骨吸收,增加骨密度。
除此之外,骨质疏松症治疗新靶点也在不断被挖掘,目前全球还有多款在研治疗骨质疏松症的药物,部分在研新药详情见下表:
百奥动物骨质疏松症模型
卵巢切除(OVX)小鼠是一种公认的人类绝经后骨质疏松症(PMOP)的体内模型。采用骨矿物质密度(BMD)测量、Micro-CT分析和组织形态学分析对卵巢切除小鼠进行评价[3,4]。
百奥动物建立了稳定的卵巢切除术诱导的C57BL/6小鼠骨质疏松症模型,可用于骨质疏松症的临床前研究和药理药效学评价。
骨质疏松症模型构建及验证
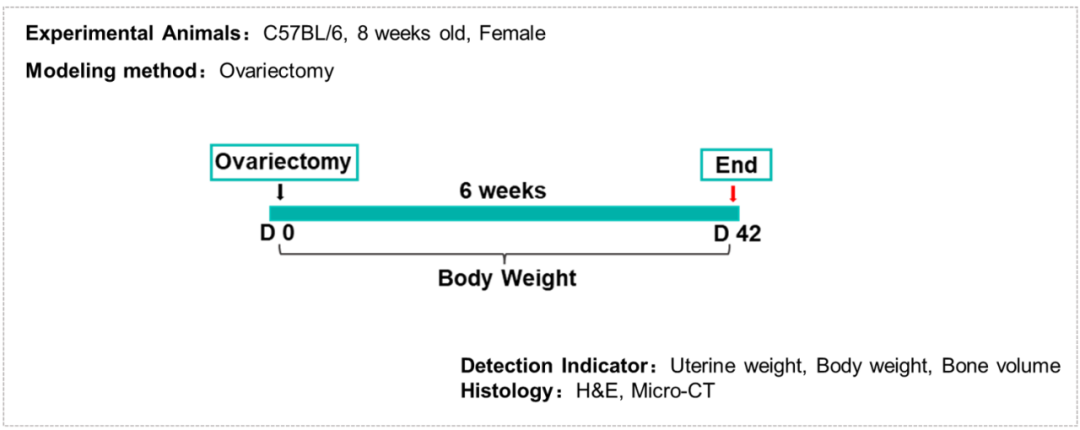
骨质疏松症小鼠模型的构建
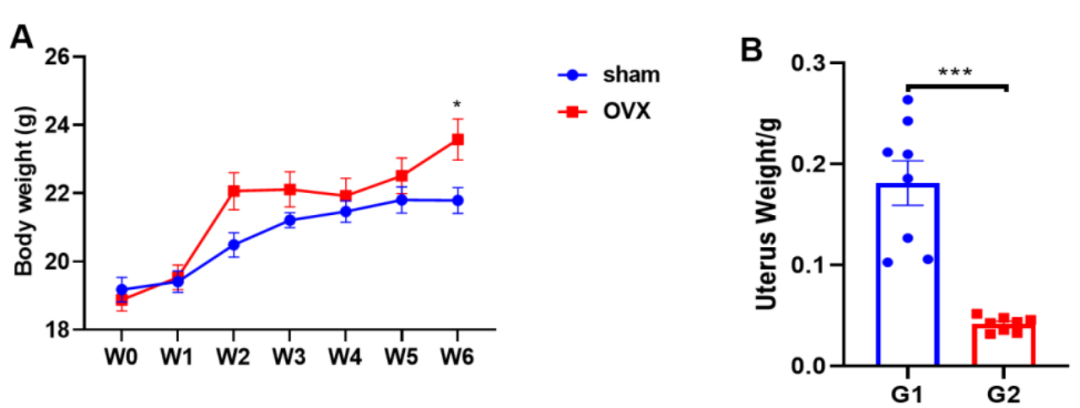
卵巢切除诱导小鼠体重增加,子宫重量减轻

卵巢切除诱导小鼠骨质流失(Micro-CT)
C57BL/6小鼠在第0天切除卵巢。手术后6周,取出骨头(C)和子宫(B)进行检测。每周记录体重(A),实验终点记录子宫重量 (B)。实验结果表明,卵巢切除术导致小鼠体重增加,子宫重量减轻且骨质流失。数值以平均值±标准误表示。


卵巢切除诱导骨质疏松症的病理分析
卵巢切除6周后进行病理分析。实验结果表明,接受卵巢切除手术的小鼠骨小梁面积减少。数值以平均值±标准误表示。
骨质疏松症模型可提供的检测项目

骨质疏松症靶点人源化小鼠模型

百奥动物针对骨质疏松症相关靶点开发了系列人源化小鼠模型,助力相关药物研发进程。
参考资料:
[1]. Eastell R, O‘Neill TW , Hofbauer LC et al. Postmenopausal osteoporosis. Nat Rev Dis Primers. 2016, 2:16069.
[2]. https://mp.weixin.qq.com/s/E7M_lJc4gjaY3cHjoMG7xA
[3]. Wang HC, Zhou KF, Xiao FZ et al. Identification of circRNA-associated ceRNA network in BMSCs of OVX models for postmenopausal osteoporosis. Sci Rep. 2020, 10(1):10896.
[4]. Chen K, Qiu PC, Yuan Y et al. Pseurotin A Inhibits Osteoclastogenesis and Prevents Ovariectomized-Induced Bone Loss by Suppressing Reactive Oxygen Species. Theranostics. 2019, 9(6):1634-1650.
 苏公网安备:32068402320845号
网站建设:北京分形科技
苏公网安备:32068402320845号
网站建设:北京分形科技






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn