导读
近日,CDE官网显示苏州泽璟生物制药股份有限公司I类新药「注射用盐酸ZG0895」在国内获批临床,有望成为一个全新的晚期实体瘤治疗新药,并可与肿瘤免疫治疗药物等其它药物联合增强抗肿瘤药效,从而改善患者的生活质量和延长寿命。
ZG0895是泽璟制药自主研发的一种新型的高活性、高选择性的Toll样受体8(TLR8)激动剂,在多种体内模型中具有优异的抗肿瘤活性,可以导致肿瘤消退。
今年AACR年会上公布的临床前研究数据中显示,ZG0895具有独特的结构,皮下注射后会展现出独特的药代动力学特性,可以降低药物进入循环系统后可能带来的全身性免疫系统持续激活的风险,具备良好的安全性,同时可以剂量依赖性的显著抑制肿瘤生长,相比以往的TLR8激动剂有望具有更好的临床用药安全性。
背景概述
Toll样受体家族(TLRs)是一类模式识别受体,可以识别PAMPs(病原体相关分子模式,Pathogen-associated molecular pattern),引发人体复杂的级联免疫反应;不但表达于免疫细胞上,还在各种肿瘤细胞中表达,参与肿瘤免疫监视,同时在炎症、免疫细胞调控、和增殖方面也发挥着关键作用。人和小鼠共13种TLRs,其中TLR10为人独有,TLR11/12/13为小鼠独有,TLR1、TLR2、TLR4、TLR5和TLR6是位于细胞表面的受体,相反TLR3、TLR7、TLR 8、TLR9位于内涵体中。
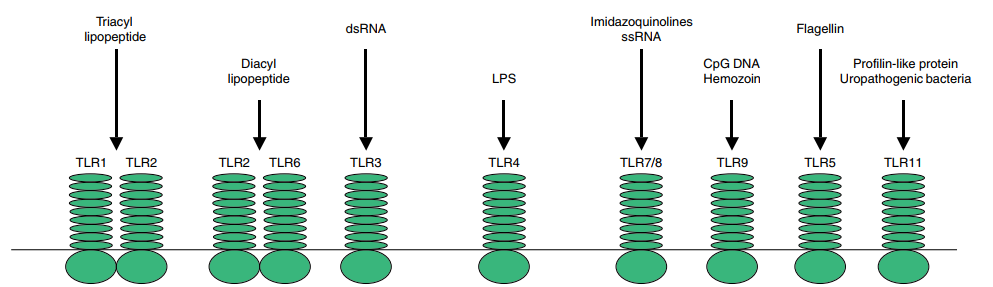
图1 TRLs受体及其配体[1]
相较于其它TLRs成员,TLR8 在多种免疫细胞表达,可以激活髓样树突状细胞来逆转Treg 细胞的免疫抑制功能,从而抑制肿瘤[2]。TLR7和TLR8信号通路共有接头蛋白MyD88,TLR7激活后通过形成复合物MyD88-IRF7促进炎症细胞因子表达[3]。当TLR8与其配体包括GU-rich ssRNA,short dsRNA,寡核苷酸和多种合成的化学激动剂结合时,其空间构象发生改变,形成同源二聚体,通过下游MyD88/IRAKs激活IRF7及NF-κB通路,诱导多种炎性细胞因子、IFNs、趋化因子的产生,抵抗细菌和病毒感染,也参与到多种疾病发生发展过程中[4];另外TLR8还可以通过激活IRF3/7通路诱导IFN-b表达。
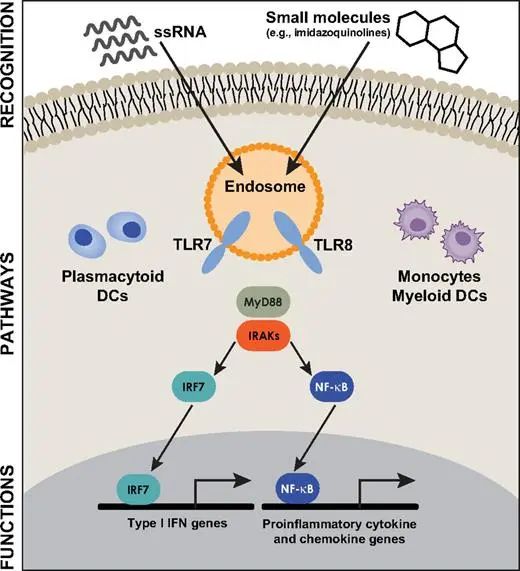
图2 TLR8信号通路[4]
TLR8药物靶点布局
目前,全球尚未有TLR8 激动剂获批上市,但已出现多款在研药物。药物类型上,TLR8激动剂包括小分子化药和抗体偶联药物;适应症方面,在研TLR8激动剂还被开发用于治疗晚期实体瘤和慢性乙型肝炎。在这个领域研究进度比较领先的公司是吉利德,其中GS-9688是一款可口服使用的选择性TLR8小分子激动剂,用于治疗慢性乙型肝炎。另外上海迪诺医药科技有限公司的DN1508052-01是国内首款获批临床的小分子TLR8激动剂,用于治疗标准治疗后疾病进展或无标准治疗的晚期实体肿瘤。
表1. 部分药物研究进展
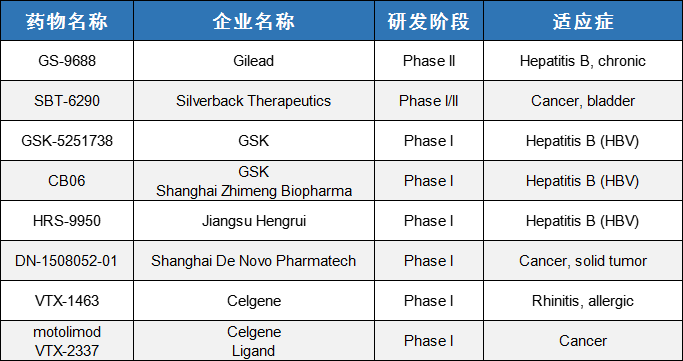
数据来源于科睿唯安及公开信息整理
TLR8 作为一种已被证实的肿瘤靶点,具有广阔的肿瘤治疗临床应用潜力。BioMice百奥动物开发了一种新型TLR8人源化小鼠模型,助力相关药物的临床前药效评估,为TLR8激动剂的安全性评价提供了有力工具。部分数据展示如下:
B-hTLR8 mice
基本信息
DC细胞中TLR8蛋白表达分析
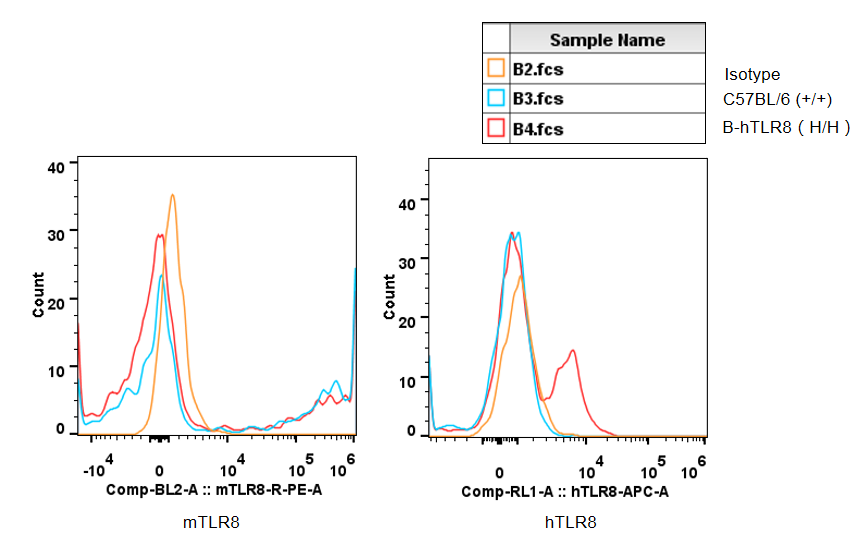
采集野生和纯合B-hTLR8 (H/H)小鼠的脾细胞,用种属特异性抗TLR8抗体进行流式细胞术分析。由于抗小鼠TLR8抗体与人TLR8的交叉反应,在野生小鼠和纯合B-hTLR8中检测到小鼠TLR8。人TLR8仅能在纯合B-hTLR8中检测到,而不能在野生小鼠中检测到。
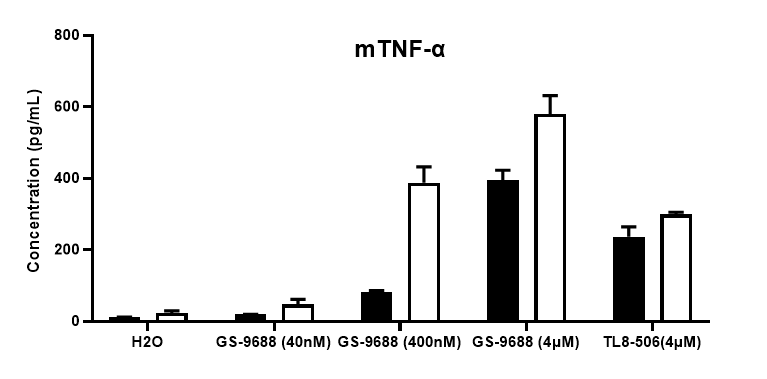
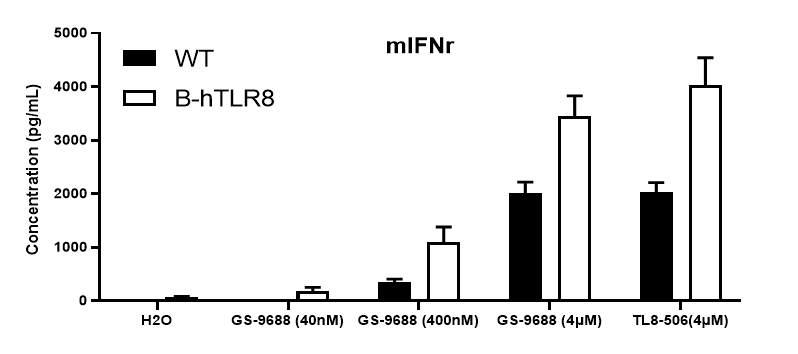
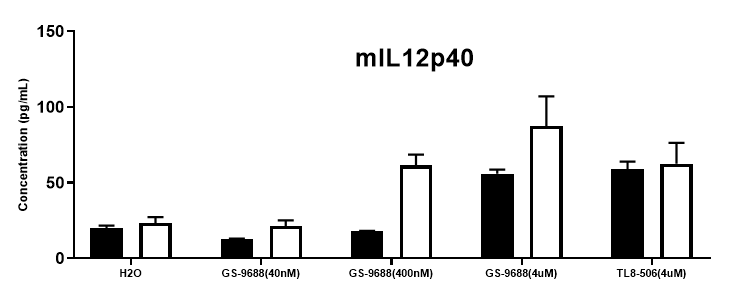
采集野生型小鼠和纯合B-hTLR8 (H/H)小鼠脾细胞,用TLR8激动剂TLR8-506和GS-9688 (Selgantolimod)刺激,ELISA对小鼠TNFα、IFNγ和IL12p40进行检测。与野生型相比,纯合B-hTLR8小鼠的TNFα、IFNγ和IL12p40分泌增加,这是由于B-hTLR8 mice与人TLR8有选择性的高亲和力结合,并且刺激与GS-9688浓度呈剂量依赖性。
脾脏中白细胞亚群分析
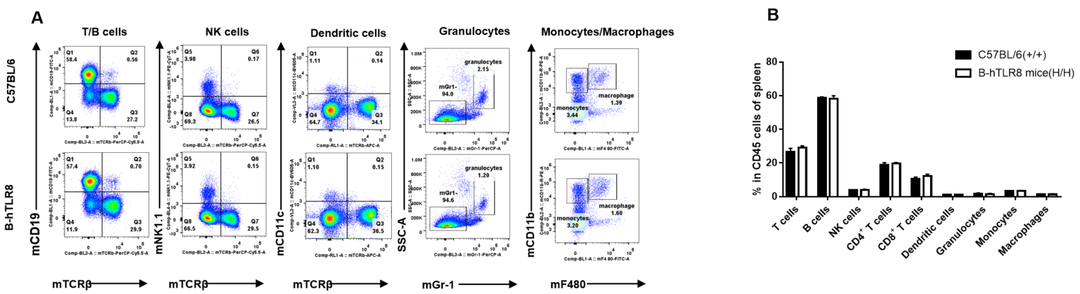
用流式细胞术分析从雌性C57BL/6和B-hTLR8小鼠(n= 3,6周龄)中分离的脾细胞以评估白细胞亚群。A.具有代表性的FACS图。B. FACS分析结果。纯合B- hTLR8小鼠的T细胞、B细胞、NK细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分比与C57BL/6小鼠相似,表明TLR8人源化不会改变这些细胞类型在脾脏的整体发育、分化或分布。
药效实验
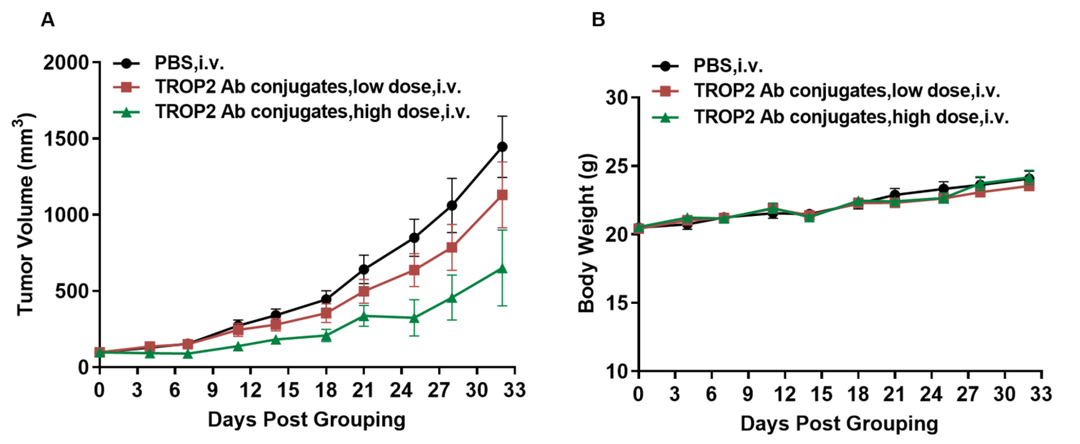
靶向TROP2的抗体偶联TLR8小分子激动剂药物抗肿瘤药效。(A)抗人TROP2抗体偶联TLR8小分子激动剂抑制B-hTLR8小鼠MC38肿瘤生长。小鼠结肠癌B-hTROP2 MC38细胞皮下接种到纯合B-hTLR8小鼠(雌性,9周龄,n=8)。小鼠按体重差异分组,分别用不同剂量的抗体偶联药物治疗。(B)治疗期间体重变化。如图A所示,抗人TROP2抗体偶联TLR8激动剂对B-hTLR8小鼠肿瘤生长的控制有效,表明B-hTLR8小鼠模型是临床前体内研究中评估抗体偶联TLR8激动剂的理想模型。
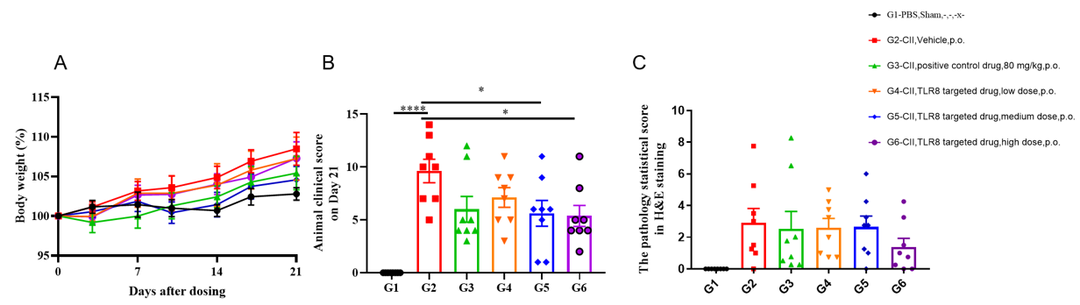
TLR8靶向药物在B-hTLR8胶原诱导的关节炎模型中的体内疗效。96只动物按体重随机分为2组,A组8只,B组88只。第0天,A组皮下注射PBS;B组动物注射CⅡ型乳剂。当B组动物的平均临床评分大于0时,再次分组,将这些动物分为5组,每组8只,分别标记为G2~G6。G1组为为非CIA对照组。G2为载体组(模型组),G3为80mg/kg阳性对照药物组,G4为低剂量TLR8靶向药物组,G5为中剂量TLR8靶向药物,G6为高剂量TLR8靶向药物。
(A) 重量变化。与第0天相比,每天动物体重变化的百分比;(B) 给药后第21天的动物临床评分。作为供试品组,观察到G3-G6的平均得分低于载体治疗组(G2)。特别是G3和G6与G2表现出显著差异;(C) H&E染色病理统计评分。镜下G1组未见病变。G2组观察到不同程度的皮下混合性炎症细胞浸润、关节滑膜炎和/或滑膜形成、踝关节和/或指关节软骨和骨组织破坏。G6组显示TLR8靶向药物高剂量对关节炎动物模型相关病变有一定改善作用。
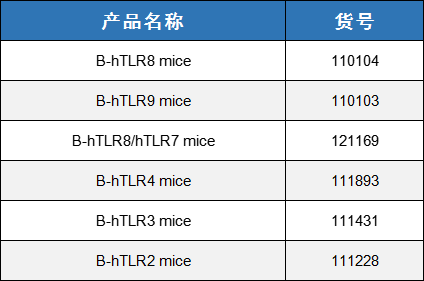
表2. TLRs靶点人源化小鼠列表
本期分享到此结束,如果您对相关小鼠模型有需求,欢迎随时与我们联系。数据多多,欢迎分享~
参考文献
[1]Taro Kawai, Shizuo Akira. TLR signaling .Cell Death and Differentiation (2006) 13, 816–825
[2]Martínez-Espinoza, Iván, and Antonieta Guerrero-Plata. “The Relevance of TLR8 in Viral Infections.”Pathogens (Basel, Switzerland) vol. 11,2 134. 22 Jan. 2022
[3]Wang, J. et al. The Functional Effects of Physical Interactions among Toll-like Receptors 7, 8, and 9. Journal of Biological Chemistry 281, 37427-37434 (2006).
[4]Dowling, D.J. Recent Advances in the Discovery and Delivery of TLR7/8 Agonists as Vaccine Adjuvants. (2018).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号