肿瘤浸润免疫细胞是指从肿瘤组织中分离出的浸润性免疫细胞。一个成功的抗肿瘤免疫反应需要免疫系统中所有淋巴样成分的存在、激活和共刺激,包括不同群体的T细胞、B细胞、树突状细胞、自然杀伤细胞(NK细胞)、骨髓来源的抑制细胞(MDSC)、中性粒细胞和巨噬细胞等。
恶性肿瘤的发生过程不仅仅是肿瘤细胞的积累过程,同时也会在其中由内皮细胞、成纤维细胞、以及浸润性免疫细胞等共同形成微环境。肿瘤微环境中各细胞对于肿瘤的发展、侵袭和转移等发挥着重要作用。因此,癌症的进化往往是肿瘤细胞和肿瘤微环境之间复杂的细胞和分子相互作用的结果。根据肿瘤和免疫细胞的相互作用可以将肿瘤恶性进展分为三个阶段:消除、平衡和逃逸。虽然多数肿瘤患者是在逃逸期被诊断出来,但肿瘤和宿主免疫之间的这种关系会一直存在,有时与之而来的是抗肿瘤免疫反应的大小。即使在疾病晚期,免疫参数目前也被认为会直接或间接影响患者的生存。
肿瘤浸润免疫细胞的分类
当肿瘤微环境中存在大量的肿瘤浸润免疫细胞时,表明机体已启动了对抗肿瘤的免疫反应,这往往和较好的临床转归相关。为了归类研究,常用两种方法对肿瘤浸润免疫细胞进行分类。第一类方法,根据免疫细胞的来源不同,肿瘤浸润免疫细胞可分为淋系肿瘤浸润免疫细胞和髓系肿瘤浸润免疫细胞(如图1),T细胞、B细胞和NK细胞属于淋系肿瘤浸润免疫细胞,巨噬细胞、嗜酸性粒细胞、嗜碱性粒细胞和中性粒细胞(N细胞)等属于髓系肿瘤浸润免疫细胞。
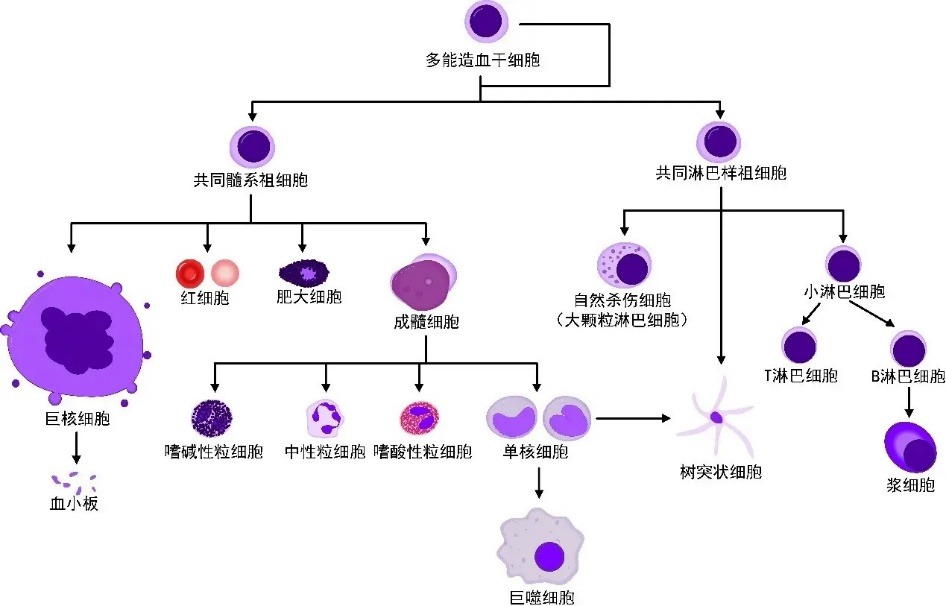
图1. 肿瘤浸润免疫细胞分类 I
另一类方法,根据免疫细胞在微环境中发挥的作用不同,肿瘤浸润免疫细胞可分为抑癌肿瘤浸润免疫细胞和促癌肿瘤浸润免疫细胞(如图2)。NK细胞、M1细胞、N1细胞、树突状细胞1(DC1细胞)、辅助T细胞1(Th1细胞)以及CD8+T细胞等属于抑癌肿瘤浸润免疫细胞;而MDSC细胞、M2细胞、N2细胞、DC2细胞、Th2细胞以及调节性T细胞(Treg细胞)等属于促癌肿瘤浸润免疫细胞。这些细胞产生的因子在塑造肿瘤微环境中发挥着核心作用,从而驱动肿瘤微环境中免疫介导的抗肿瘤或促肿瘤活性。
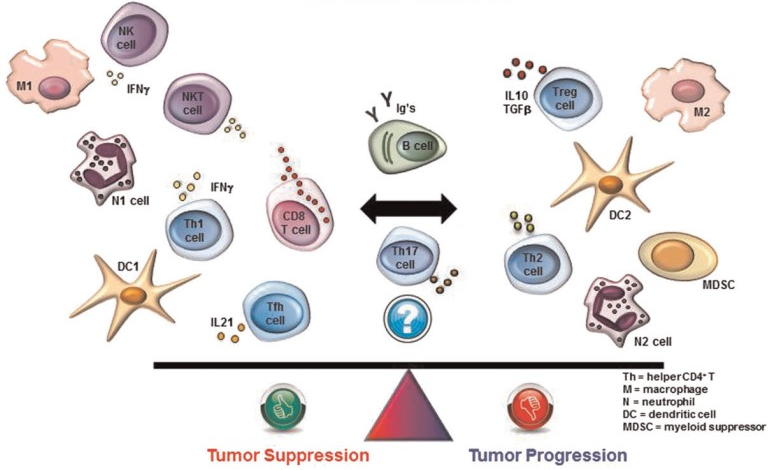
图2. 肿瘤浸润免疫细胞分类 II
肿瘤浸润免疫细胞的功能及指标
在肿瘤微环境中, 不同的肿瘤浸润免疫细胞细胞发挥着不同的作用。
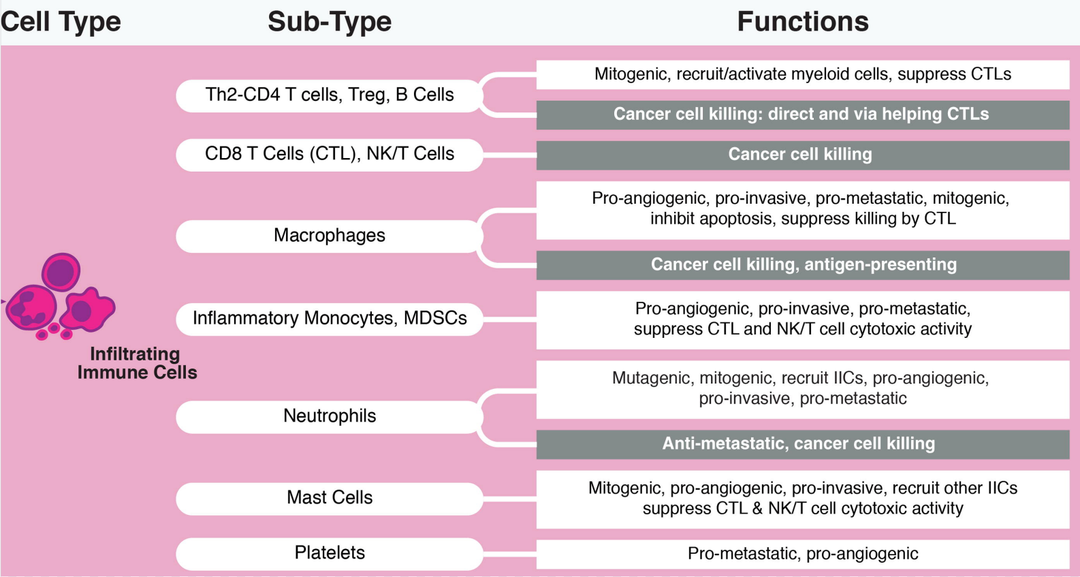
图3. 肿瘤浸润免疫细胞功能
如图3所示,其中一些肿瘤浸润免疫细胞发挥的主要功能如下:
CD4+T细胞、Treg细胞和B细胞主要促进有丝分裂,募集或者激活髓系细胞,抑制CD8+T细胞(CTL),并直接或通过辅助CTL间接参与肿瘤细胞杀伤;CTL以及NK/T细胞主要杀伤肿瘤细胞;巨噬细胞除了参与抗原呈递和杀伤肿瘤细胞之外,还可以促进血管生成、侵袭、转移、有丝分裂,抑制细胞凋亡和通过CTL抑制杀伤;骨髓来源的抑制细胞主要促进血管的生成、侵袭和转移,抑制CTL和NK/T细胞毒性活性,肥大细胞也发挥类似的功能;中性粒细胞除了参与肿瘤细胞杀伤和抗肿瘤细胞转移之外,还可以促进血管生成和有丝分裂;血小板的主要功能是促进血管生成和转移。
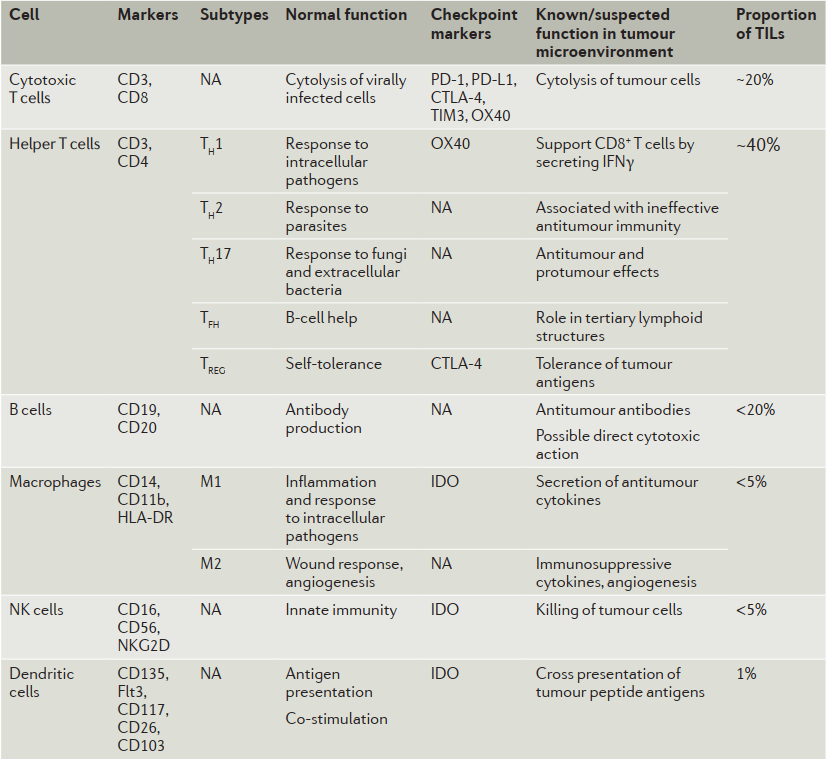
图4. 肿瘤浸润免疫细胞标记物、功能及占比
在所有肿瘤浸润免疫细胞中,使用CD3、CD8标记的细胞毒T细胞约占20%左右,而用CD3、CD4标记的辅助T细胞约占40%左右;用CD19、CD20标记的B细胞的占比小于20%;用CD14、CD11b等标记的巨噬细胞和用CD16、CD56等标记的NK细胞的占比都小于5%,而用CD135、Flt3等标记的树突状细胞约占1%左右(图4)。
综上所述,肿瘤浸润淋巴细胞在肿瘤免疫环境中起着重要作用。肿瘤免疫控制往往不是单个淋巴细胞亚群负责;相反,所有淋巴细胞亚群的位置、聚集、相互作用和共刺激是成功的抗肿瘤免疫应答所必需的。
小鼠肿瘤模型中淋系和髓系肿瘤浸润免疫细胞的分布
在已有的一项研究中,研究者选择四种小鼠肿瘤模型检测了不同体积肿瘤中淋系和髓系肿瘤浸润免疫细胞的分布状况,这四种肿瘤模型分别是肾细胞癌RENCA模型、结肠癌CT26模型、乳腺癌EMT6模型以及黑色素瘤B16F10模型,并且分别统计了肿瘤体积为100 mm3、500 mm3以及2000 mm3时的肿瘤浸润免疫细胞的分布情况。如图5所示,淋巴细胞群(T,B,NK)的数量随RENCA肿瘤体积的增大而减少,尤其CD4+T和B细胞更为明显;在CT26肿瘤中Treg和NK细胞随着肿瘤体积的增加而减少,而CD8+T细胞则与之相反;在EMT6肿瘤中NK细胞随着肿瘤体积的增加而减少;在B16F10肿瘤中,除了Treg细胞外,其余淋系肿瘤浸润免疫细胞的数量与肿瘤体积之间并无显著规律。
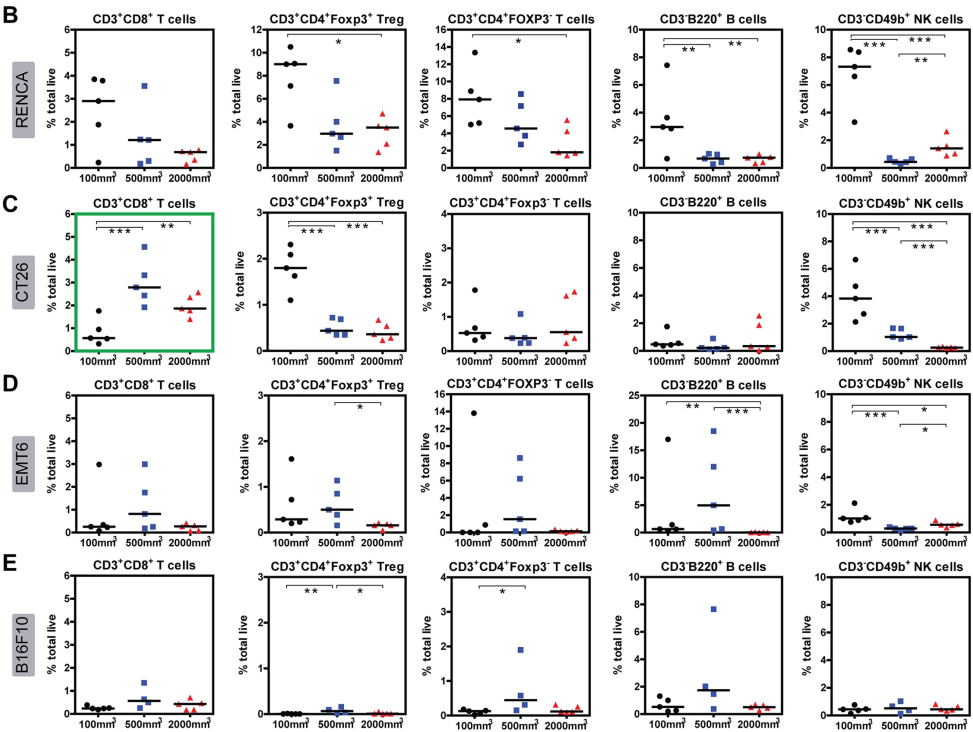
图5. 淋系肿瘤浸润免疫细胞的占比
图6显示了不同体积肿瘤中髓系细胞群的分布。在RENCA肿瘤中,DC细胞和巨噬细胞的数量随肿瘤体积增大而减少,而MDSC细胞则与之相反;在CT26肿瘤中DC细胞和巨噬细胞的数量随肿瘤体积增大而减少;在EMT6肿瘤中DC细胞和巨噬细胞的数量随肿瘤体积增大而减少,而MDSC细胞的数量则与之相反;在B16F10肿瘤中,除了DC细胞的数量随肿瘤体积增大而呈现先增加后减少的趋势,其余细胞的数量与肿瘤体积之间并无显著规律。
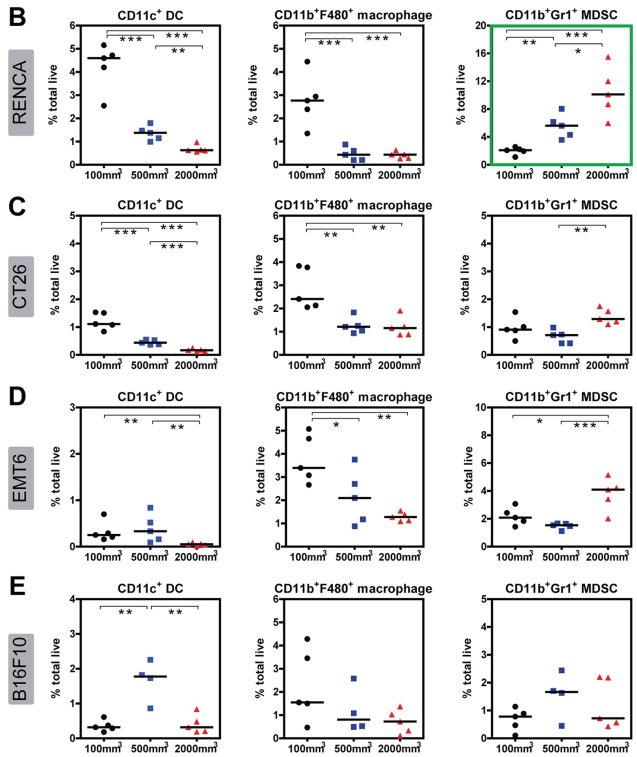
图6. 髓系肿瘤浸润免疫细胞的占比
百奥赛图MC38小鼠肿瘤模型中肿瘤浸润免疫细胞分布的探索性研究
首先,我们在NCBI数据库中统计了多篇高影响因子文献中检测肿瘤浸润免疫细胞时的肿瘤体积相关数据,得出的结果呈现在图7中。
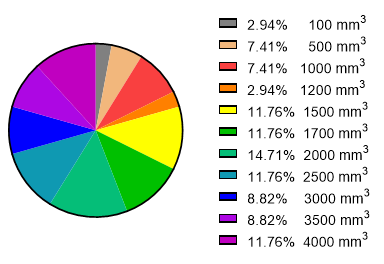
图7. 文献中检测肿瘤浸润免疫细胞时的肿瘤体积分布
小鼠肿瘤模型中不同体积的肿瘤所具有的免疫特征可作为指导机制研究和预测不同肿瘤微环境中治疗反应的框架。MC38结肠癌模型是我们研究常用的小鼠肿瘤模型,检测不同体积大小肿瘤中肿瘤浸润免疫细胞成分,寻找规律,可为肿瘤药物筛选提供依据和参考。为了得到不同体积大小的瘤块,百奥赛图给C57BL/6背景7周龄的雌鼠接种MC38细胞,小鼠总共42只,根据肿瘤的体积分为7组,每组6只小鼠。MC38细胞以5×105的总量、0.1 mL体积注射到小鼠的右侧背部皮下,每周两次测取瘤块体积。如图8所示,肿瘤体积分别到达100 mm3, 500 mm3, 1000 mm3, 1500 mm3, 2000 mm3, 2500 mm3时收集瘤块并做肿瘤浸润免疫细胞分析。
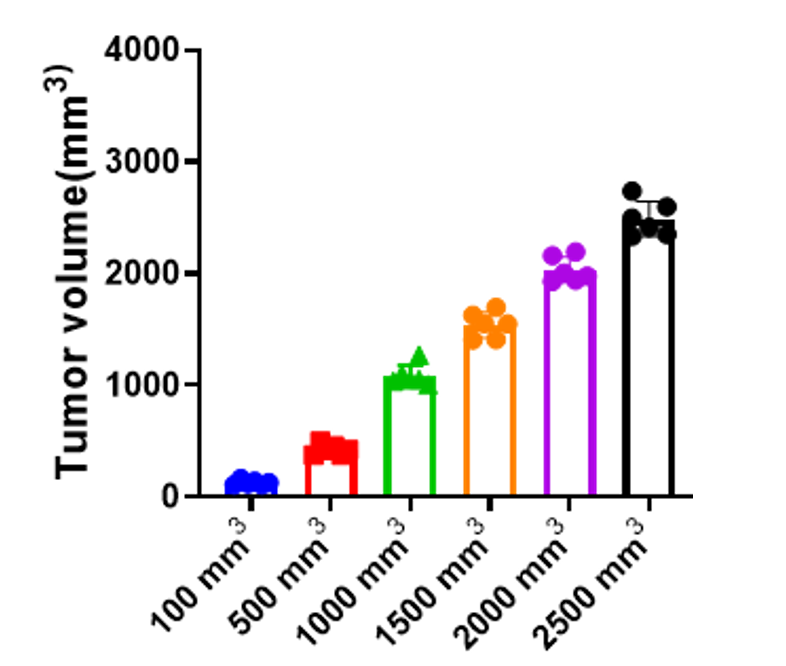
图8. MC38肿瘤体积
01 淋系肿瘤浸润免疫细胞的百分比
如图10所示,CD45+细胞占活细胞的比例随着肿瘤体积的增大呈现先减少后不变的趋势,肿瘤体积达到1500mm3后,瘤块所有活细胞中CD45+细胞占比不会随肿瘤体积的变化而变化;NK细胞占CD45+细胞的比例均随着肿瘤体积的增大同样呈现先减少后不变的趋势,不过肿瘤体积超过100 mm3以后NK细胞的占比断崖式下降;T细胞占CD45+细胞的比例随着肿瘤体积的增大而呈现先减少后增多的趋势;T细胞中CD4+T细胞占比有随肿瘤体积的增大而减少的趋势,而CD8+T细胞占比则呈现与之相反的趋势,这可能是造成T细胞占CD45+细胞的比例呈现先减少后增多趋势的主要原因;Treg占T细胞和CD4+T细胞的比例与肿瘤体积没有明显的关系。
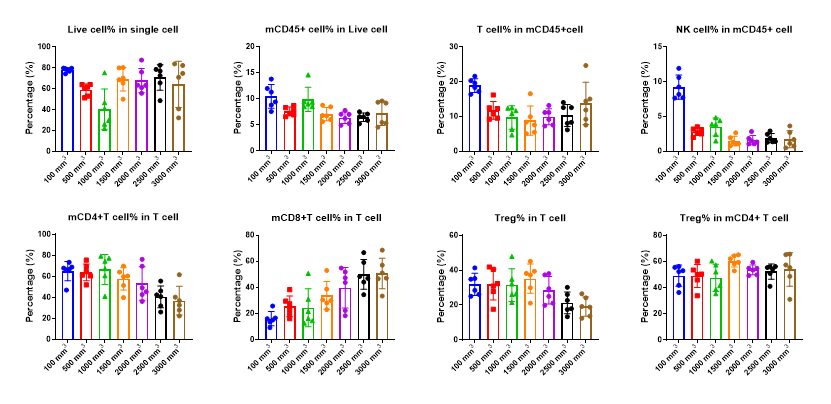
图9. 淋系肿瘤浸润免疫细胞占比
02 淋系肿瘤浸润免疫细胞的细胞数量
为了看到肿瘤中每种肿瘤浸润免疫细胞的具体数量,统计了每克瘤块中的每种肿瘤浸润免疫细胞的数量。从图11不难看出,每个细胞的数量均在肿瘤体积为100 mm3 时最多,这也许可能与肿瘤体积为100 mm3 时肿瘤重量最小有关;当肿瘤大小达到500 mm3 之后,CD45+细胞和T细胞的数量不随肿瘤体积的改变而改变;NK细胞的数量随肿瘤体积的增大呈现先减少后不变的趋势,与NK细胞占比的趋势保持一致;CD4+T细胞和Treg细胞的数量随肿瘤体积的增大而呈现减少的趋势;CD8+T细胞的数量随肿瘤体积的增大呈现先减少后增多的趋势。
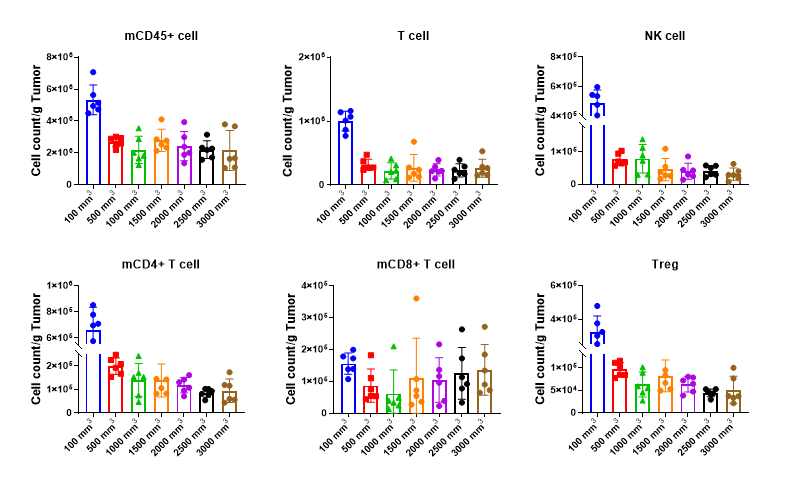
图10. 淋系肿瘤浸润免疫细胞数量
03 髓系肿瘤浸润免疫细胞的百分比
图11显示了不同体积肿瘤中髓系肿瘤浸润免疫细胞的百分比结果。M1细胞占CD45+细胞的比例随着肿瘤体积的增大呈现先减少后增多的趋势,而M2细胞占CD45+细胞的比例与之相反,肿瘤体积的增大呈现先增多后减少的趋势,这个结果也许能反映机体对肿瘤生长做出的响应,在肿瘤增长前期,起抑癌作用的M1细胞减少而具有促癌作用的M2细胞增多,到了后期后,M1细胞增多而M2细胞减少。
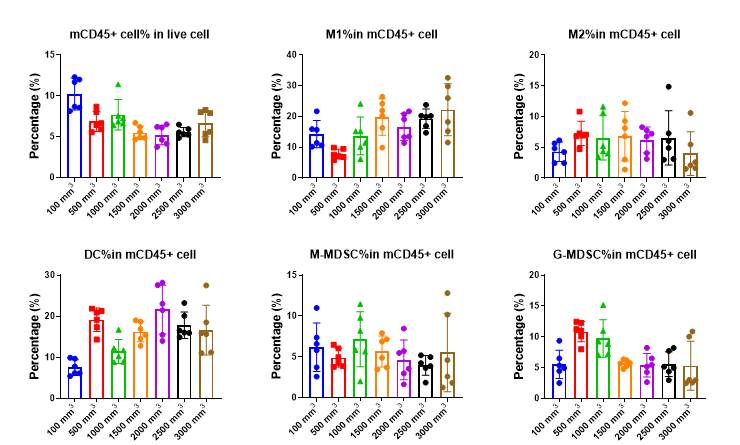
图11. 髓系肿瘤浸润免疫细胞占比
与此类似的,还有具有促癌作用的G-MDSC细胞占CD45+细胞的比例随着肿瘤体积的增大呈现先增多后减少的趋势;然而M-MDSC细胞占CD45+细胞的比例与肿瘤体积没有明显关系;DC细胞占CD45+细胞的比例随着肿瘤体积的增大呈现先增多后减少的趋势。
04 髓系肿瘤浸润免疫细胞的细胞数量
图12显示了每克肿瘤组织中一些髓系肿瘤浸润免疫细胞的细胞数量结果。除了DC细胞外,其余每种细胞的数量均在肿瘤体积为100 mm3时最多;当肿瘤体积达到500 mm3 后,M1细胞的数量随着肿瘤体积的增大而增多,而M2细胞和G-MDSC细胞的数量随肿瘤体积的增大而呈现减少的趋势;M-MDSC细胞和DC细胞的数量不随肿瘤体积的改变而发生明显变化。
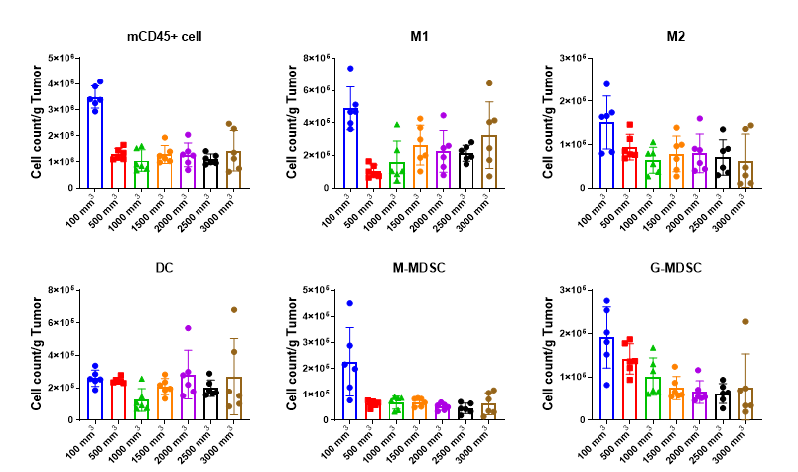
图12. 髓系肿瘤浸润免疫细胞数量
从以上结果可以看出,在MC38模型中,淋系和髓系肿瘤浸润免疫细胞在肿瘤体积为100mm3时最多,之后会急速减少后呈现不同的趋势。小鼠肿瘤模型的肿瘤免疫图谱作为一个框架,可以指导机制研究和预测不同肿瘤微环境下的治疗反应。虽然这个框架过度简化了复杂的肿瘤微环境,但它仍然有助于将适当的机制问题与适当的肿瘤微环境配对。从更广泛的意义上说,这个简单的框架为抗肿瘤药物的筛选和相关研究提供了参考,更为考虑患者的选择标准和合理的联合策略提供了重要的第一步。
百奥赛图拥有完备的药理学平台,可通过采用流式细胞术、ELISA、 Cytometric bead array、Luminex等技术,进行细胞基础功能检测、药物-细胞结合能力评价、肿瘤浸润免疫细胞分析、组织器官免疫分型和功能分析、受体/靶点占位分析、多细胞因子检测(细胞因子风暴)等,利用Luminex/MSD细胞因子检测平台进行细胞因子风暴毒性检测,为抗体药效学评价提供药效评估、机制分析、安全性评价和Biomarker鉴定等。公司高通量的检测与高效的分析检测团队也为IND申报提供了强有力的数据支持。
参考文献:
[1] Hanahan D, Coussens LM. Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell. 2012, 21(3):309-322.
[2] Salgado R, Denkert C, Demaria S, et al. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol. 2015, 26(2): 259-271.
[3] Bremnes RM, Busund LT, Kilvær TL, et al. The Role of Tumor-Infiltrating Lymphocytes in Development, Progression, and Prognosis of Non-Small Cell Lung Cancer. J Thorac Oncol. 2016, 11(6): 789-800.
[4] Savas P, Salgado R, Denkert C, et al. Clinical relevance of host immunity in breast cancer: from TILs to the clinic. Nat Rev Clin Oncol. 2016, 13(4):228-241.
[5] Yu JW, Bhattacharya S, Yanamandra N, et al. Tumor-immune profiling of murine syngeneic tumor models as a framework to guide mechanistic studies and predict therapy response in distinct tumor microenvironments. PLoS One. 2018, 13(11): e0206223.
[6] Klauschen F, Müller KR, Binder A, et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Semin Cancer Biol. 2018, 52(Pt 2): 151-157.
[7] Paijens ST, Vledder A, de Bruyn M, et al. Tumor-infiltrating lymphocytes in the immunotherapy era. Cell Mol Immunol. 2021, 18(4): 842-859.
[8] Loi S, Michiels S, Adams S, et al. The journey of tumor-infiltrating lymphocytes as a biomarker in breast cancer: clinical utility in an era of checkpoint inhibition. Ann Oncol. 2021, 32(10): 1236-1244.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号