2022年12月19日,Madrigal Pharmaceuticals公司宣布了resmetirom(甲状腺激素受体(THR)-β口服选择性激动剂)治疗非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)的III期临床试验的积极结果,该研究达到双主要终点与一项关键次要终点,这一新闻无疑为NASH研究领域带来了最好的新年贺礼。
NASH是非酒精脂肪肝病(NAFLD)的疾病进展形式,表现为肝细胞脂肪变性,炎症细胞浸润和肝细胞气球样病变等症状,疾病进展可能会进一步导致肝纤维化、肝硬化和肝细胞癌的发生。根据流行病学调查,NAFLD的全球患病率约为25%,NASH全球患病率约为1.5-6.5%,预计2015年至2030年期间NASH的患病率将增加63%,未来5-15年将超过丙肝感染成为等待肝移植的末期肝病的主要原因。全球NASH药物市场规模快速增长,预计2025年将达到107亿美元。
NASH治疗药物的主要作用机制
NASH的病理生理过程复杂,肥胖、II型糖尿病和代谢综合征是主要易感因素之一。但尚未有针对NASH适应症的药物在欧美等市场获批上市,仍需要复合的管理和药物联合治疗。目前治疗NASH的药物主要作用机制包括改善糖脂代谢、降低脂质毒性和细胞死亡、缓解肝脏炎症和抗纤维化等[1、2]。
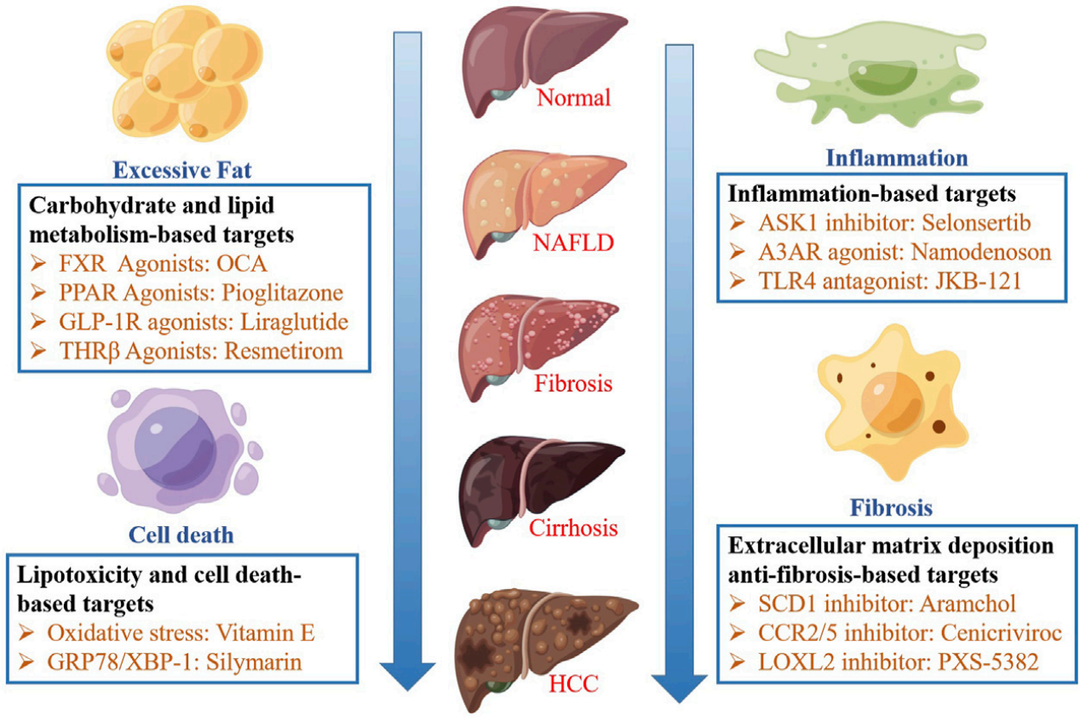
改善糖脂代谢药物
肝脏中过量的脂肪酸导致过量能量,从而产生肝细胞的脂肪毒性代谢产物破坏肝细胞,因此减少肝内游离脂肪酸是一种潜在治疗策略。
1、FXR(法尼酯 X受体)激动剂:可以改善胰岛素敏感性,抑制DNL并降低胆汁酸合成。此外,FXR的激活可以抑制固醇调节元件结合蛋白1C(SREBP-1C),进而调节甘油三酯代谢和脂质再生。
2. PPARs(过氧化物酶体增殖物激活受体):包括三个亚型(PPARα、PPARβ和PPARγ),可以调节脂肪酸代谢。
3. GLP-1R(胰高糖素样肽受体)激动剂:增强胰岛素分泌,以葡萄糖浓度依赖方式抑制胰高血糖素的分泌,减少血糖。
4. THRβ(甲状腺激素受体β)激动剂:能够激活肝脏中的THRβ亚型,减少脂肪毒性改善肝功能。
缓解肝脏炎症药物
NASH疾病患者的肝巨噬细胞累积和炎症症状明显。
1. ASK1(凋亡信号调节激酶1)抑制剂:阻断ASK1的激活,可抑制炎症发生、肝脏纤维化、胰岛素抵抗和肝脏脂质堆积等疾病过程。
2. A3AR(选择性A3腺苷受体)激动剂:下调NF-κB信号通路,诱导炎性细胞凋亡。
3. TLR4拮抗剂:抗炎抗纤维化。
抗肝脏纤维化药物
主要作用于抑制原纤维生成和纤维蛋白溶解增强两个方面。
1. CCR2/5(C-C基序趋化因子受体)抑制剂:CCR2和CCR5介导通过募集炎症单核细胞和巨噬细胞的纤维化,并激活淋巴细胞和肝星状细胞。CCR2/5抑制剂具有抗炎和抗纤维化作用。
2. TGF-β(转化生长因子)抑制剂:TGF-β诱导的促纤维化减弱。
3. FGF(激素成纤维细胞生长因子)类似物:FGF19类似物抑制胆汁酸合成,调节代谢平衡;FGF21类似物减少肝脏脂肪和炎症,逆转纤维化,增加胰岛素敏感性并改善脂蛋白。
全球部分NASH药物研发进展
针对NASH的治疗药物以代谢类药物为主,多数为小分子化合物,海外药企诺和诺德、诺华、阿利斯康等均有布局,国内歌礼制药、众生药业、东阳光药业、先为达生物处于临床I/II期阶段。也有众多药物在NASH适应症上惨遭失败,20多款药物开发终止。2022年再生元在《新英格兰医学》公布一项研究,揭示未来NASH新兴靶点CIDEB,CIDEB基因变异被发现具有保护肝脏的功能;Cell Metabolism杂志上研究论文阐明了NASH中Cholesterol与TAZ的联系,为治疗纤维化NASH提供了新的靶点;宾夕法尼亚大学在Science发表的一项研究展示了选择性抑制剂mTORC1可有效抑制NASH。相信随着科学研究和生物技术的不断提高,NASH药物开发有望迎来更多创新药物选择。
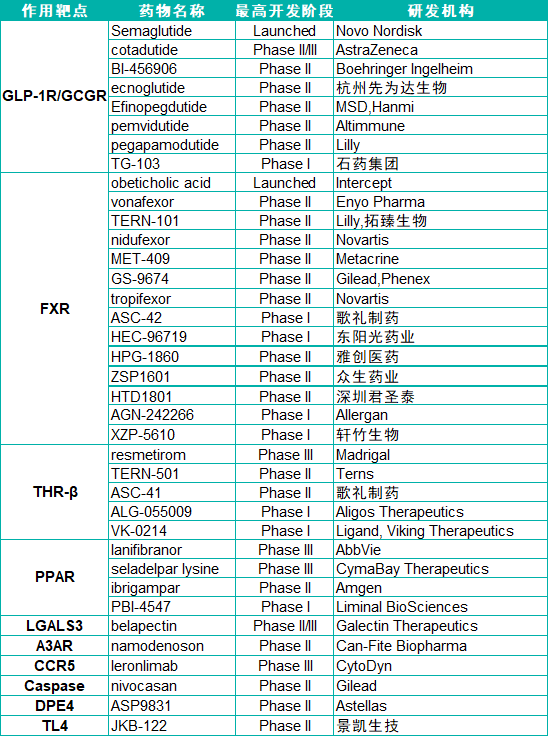
数据来源:科睿唯安数据库,公开资料
NASH动物模型及药效评估
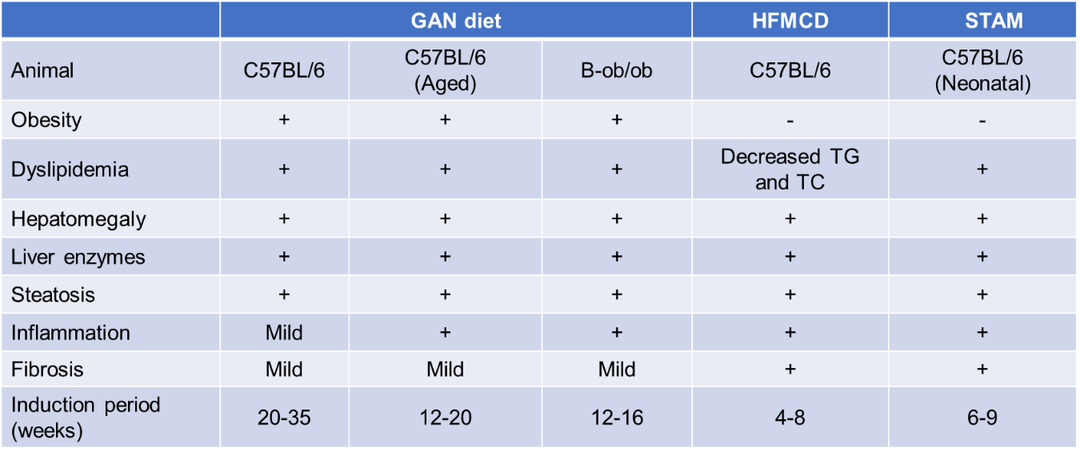
NASH动物模型是临床前研究的重要工具,主要分为饮食诱导、化学诱导、基因编辑动物模型以及联合诱导模型。除了之前已经构建的WD(西方饮食)诱导NASH小鼠模型、HFMCD(高脂肪蛋氨酸胆碱缺乏饮食)诱导的NASH小鼠模型以及联合诱导的STAM-NASH模型,百奥动物新构建出基于C57BL/6老龄鼠和B-ob/ob小鼠的GAN(Gubra-Amylin NASH)饮食诱导NASH模型。
GAN饮食是一种经过改良、无反式脂肪的高脂高胆固醇高果糖饲料(含40%脂肪、20%果糖和2%胆固醇),研究表明,GAN饮食诱导的NASH动物模型更生理的模拟了人类NASH疾病的发生,在生理、代谢和组织病理学方面有良好的转化性[3]。不同性别的动物在NASH易感性和严重程度上差异很大,雄性啮齿类动物比雌性更易发生NASH,因此绝大部分的研究只选择使用雄性动物。但雌性动物特定的病理生理机制的研究对NASH的精准治疗方案同样意义重大,FDA也要求不能忽略雌性动物对NASH研究的意义。百奥动物基于C57BL/6老龄鼠构建了GAN饮食诱导的NASH模型,同时选用雌雄两性别的老年鼠进行NASH模型的开发。结果显示,老龄鼠造模周期较年轻小鼠更短,诱导12周即可出现NASH表型,21周出现纤维化,能够更好的助力NASH药物临床前研究,加速药物评估和转化进程。
C57BL/6老龄鼠的NASH模型
模型诱导
实验动物(C57BL/6 mice,5W,M;C57BL/6 mice,56W,M/F)使用Gubra-Amylin NASH (GAN) 饮食饲养。
模型验证
GAN饮食诱导的老龄鼠NASH模型表现出明显的代谢紊乱
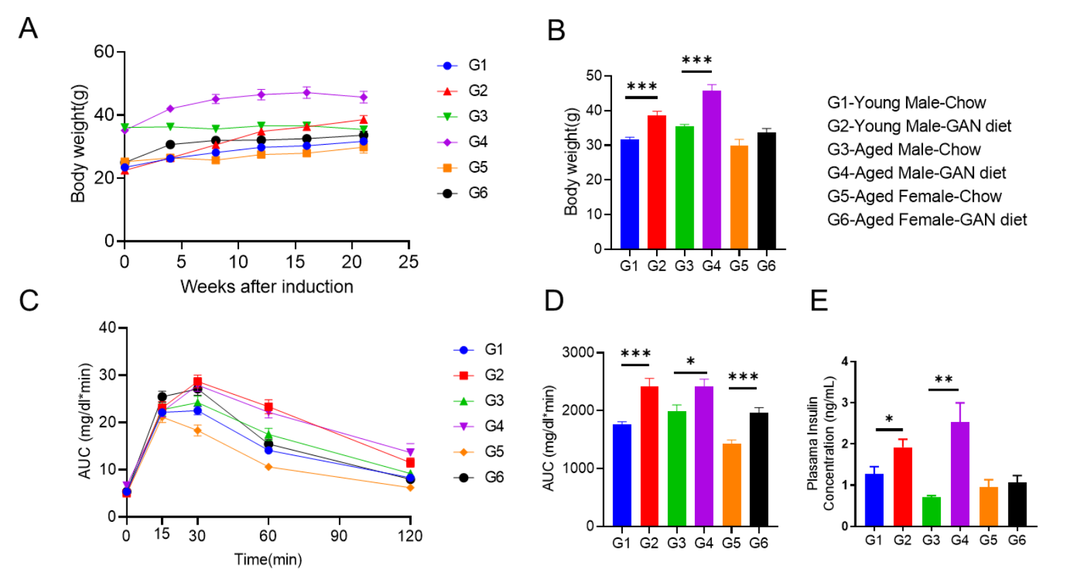
GAN饮食诱导的老龄鼠NASH模型表现出代谢紊乱。
(A-B)GAN饮食诱导组的体重增加。(C)GAN饮食诱导组的葡萄糖耐受能力受损。(D)C图曲线下面积。(E)GAN饮食诱导组的血浆胰岛素含量增加。N=6-10 mice per group. Data are expressed as mean ± SEM. **: p<0.01.
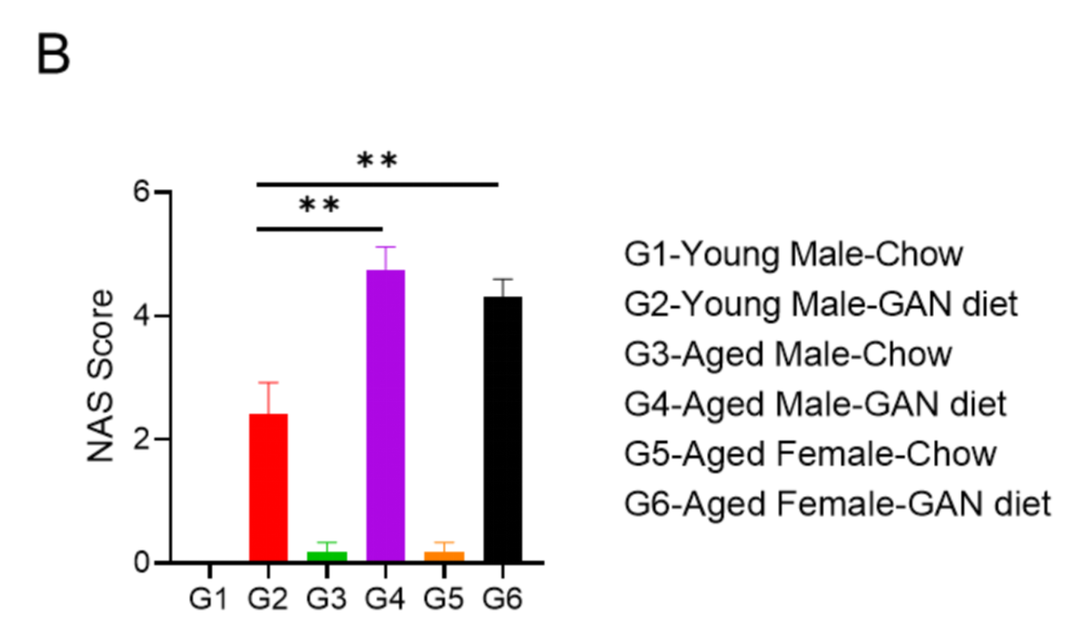
GAN饮食诱导12周后,老龄鼠表现出比年轻小鼠更严重的NASH表型
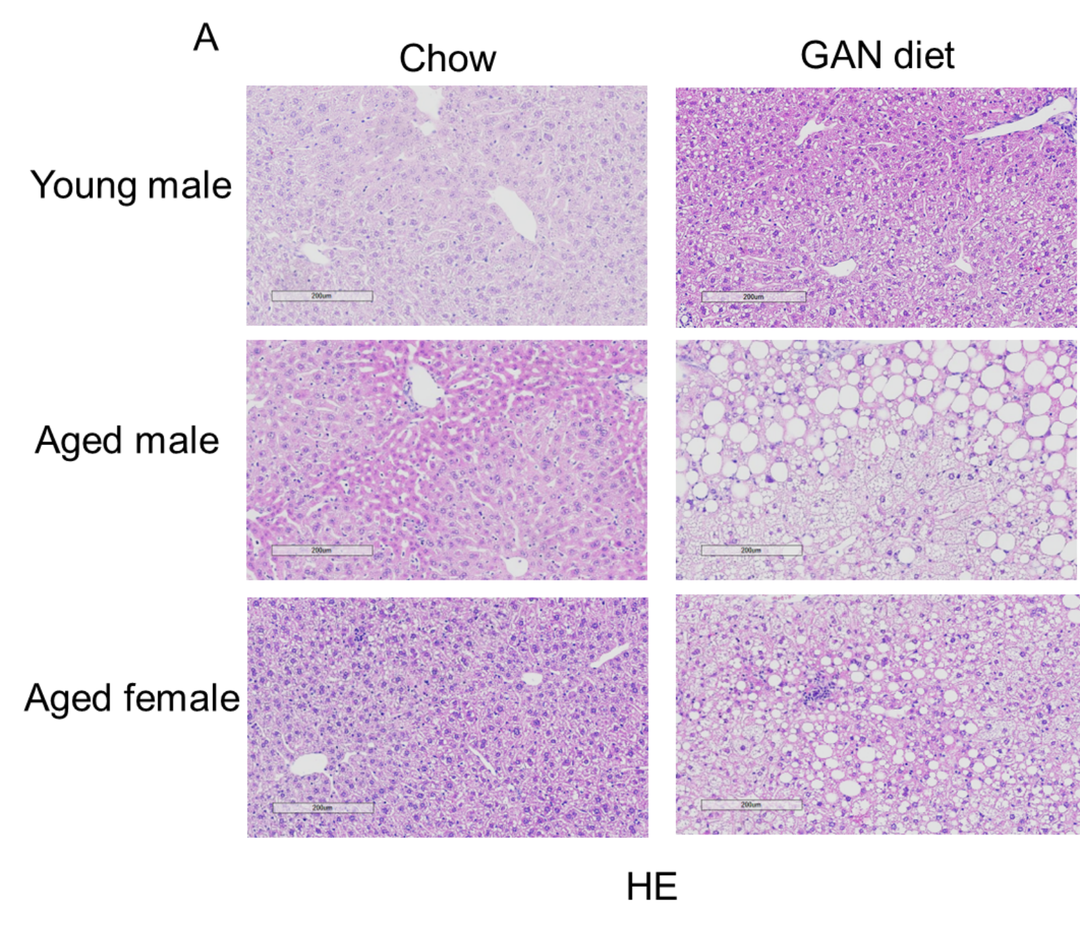
GAN饮食诱导的老龄鼠NASH模型
(A)诱导12周后H&E染色的代表性图片。(B)NAS(NAFLD acticity score)评分。
Data are expressed as mean ± SEM.N=6-10 mice per group. **: p<0.01.
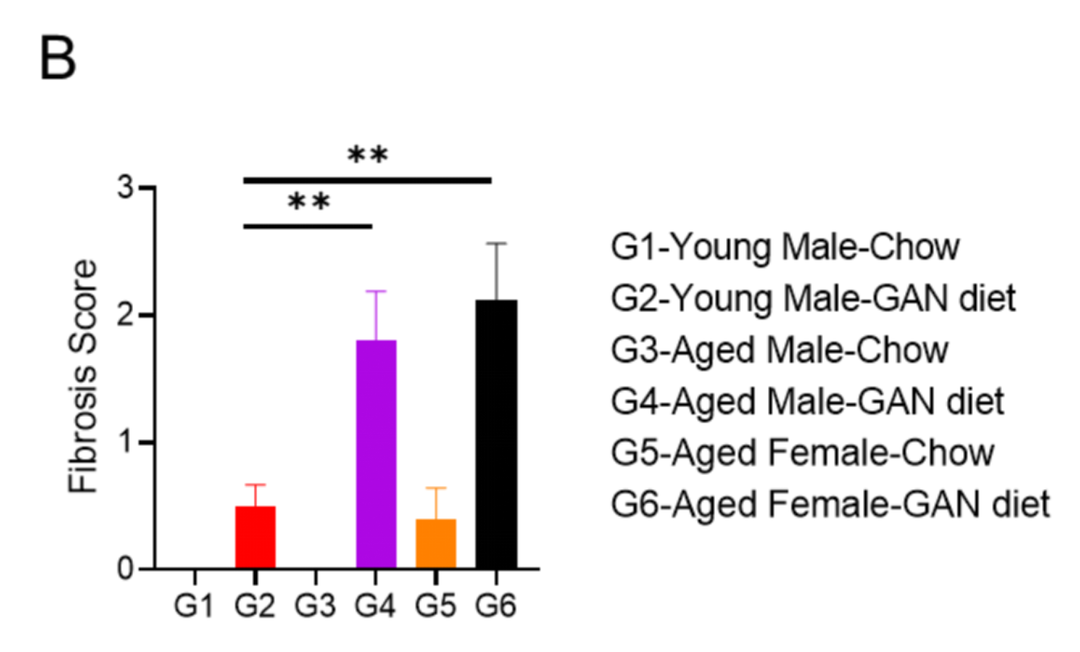
GAN饮食诱导21周后,老龄鼠表现出比年轻小鼠更严重的纤维化
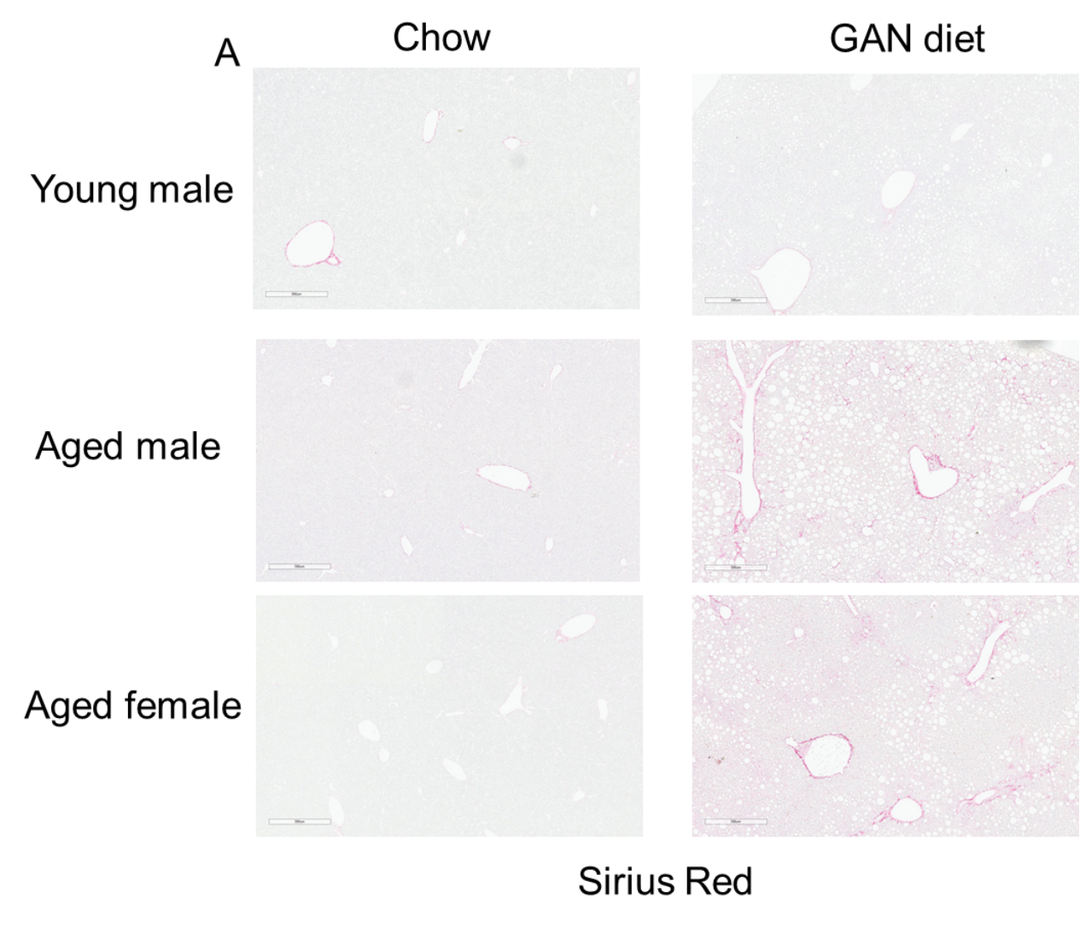
GAN饮食诱导的老龄鼠纤维化
(A)诱导21周后天狼星红染色的代表性图片。(B)天狼星红染色的纤维化评分。
Data are expressed as mean ± SEM. N=6-10 mice per group. **: p<0.01.
GAN饮食诱导21周后,老龄雄鼠肝脏中的免疫细胞浸润增加
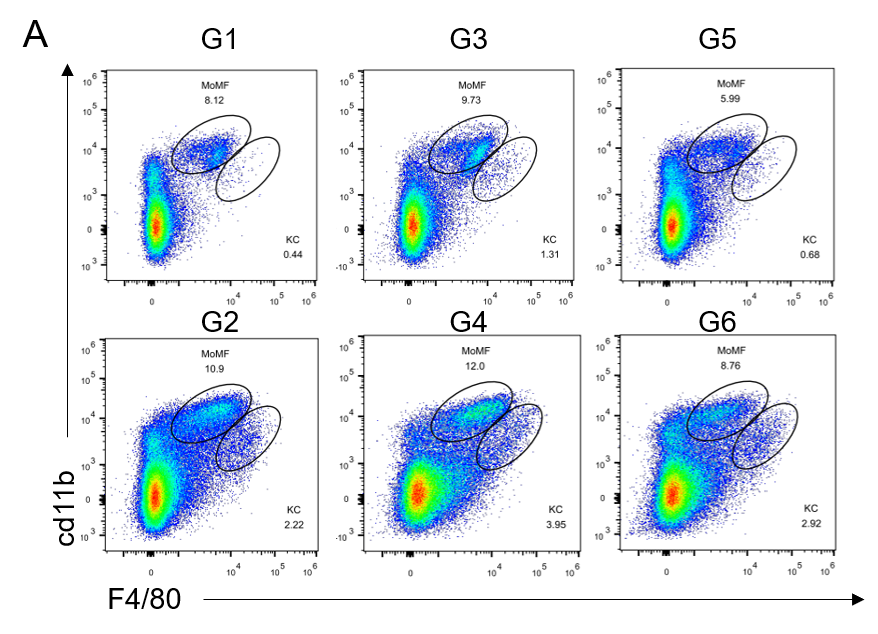
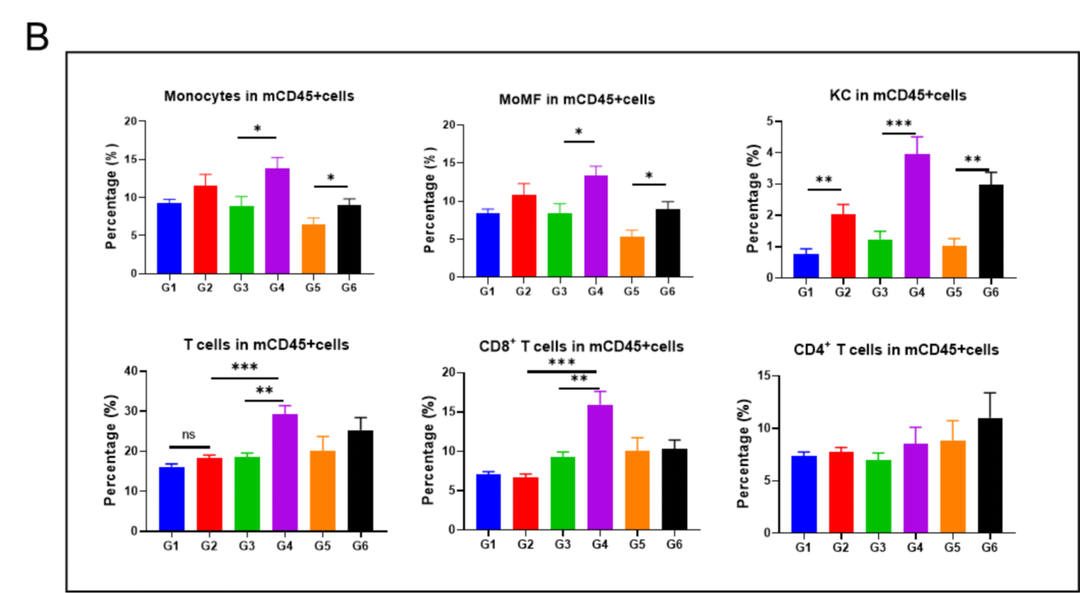
GAN饮食诱导21周后,老龄雄鼠肝脏中的免疫细胞浸润增加
(A)流式细胞仪评估肝脏中单核细胞(CD11bintF4 / 80low)和kupffer细胞(CD11b+F4 / 80hi)浸润比例。(B)肝脏中不同类型免疫细胞分析。
Data are expressed as mean ± SEM. N=6-10 mice per group. *P <0.05, **P <0.01, ***P <0.001.
GAN饮食诱导的C57BL/6小鼠NASH模型构建及药效评价
模型诱导
实验动物(C57BL/6 mice,6W,M)使用Gubra-Amylin NASH (GAN) 饮食饲养。
模型验证
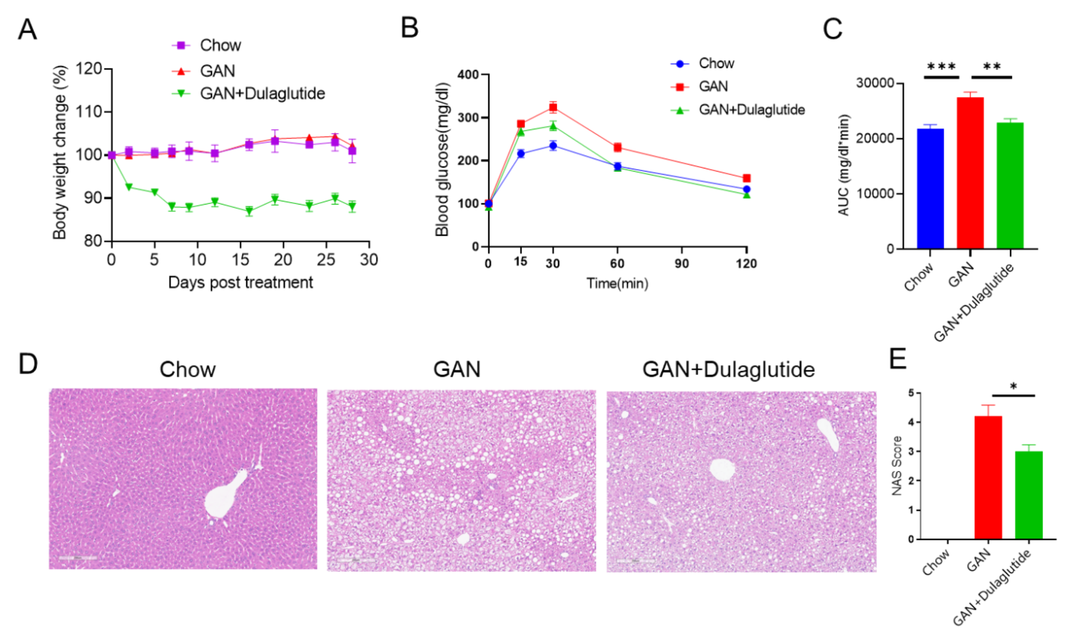
GAN饮食诱导的C57BL/6小鼠NASH模型
(A)治疗下的体重变化。(B)治疗后的葡萄糖耐受能力。(C)B图曲线下的面积。(D)诱导20周后H&E染色的代表性图片。(E)NAS(NAFLD acticity score)评分。
Data are expressed as mean ± SEM. N=9 mice per group. *p<0.05, **p<0.01,***p<0.001.
GAN饮食诱导的B-ob/ob小鼠NASH模型构建及药效评价
模型诱导
实验动物(B-ob/ob mice,6W,M)使用Gubra-Amylin NASH (GAN) 饮食饲养。
模型验证
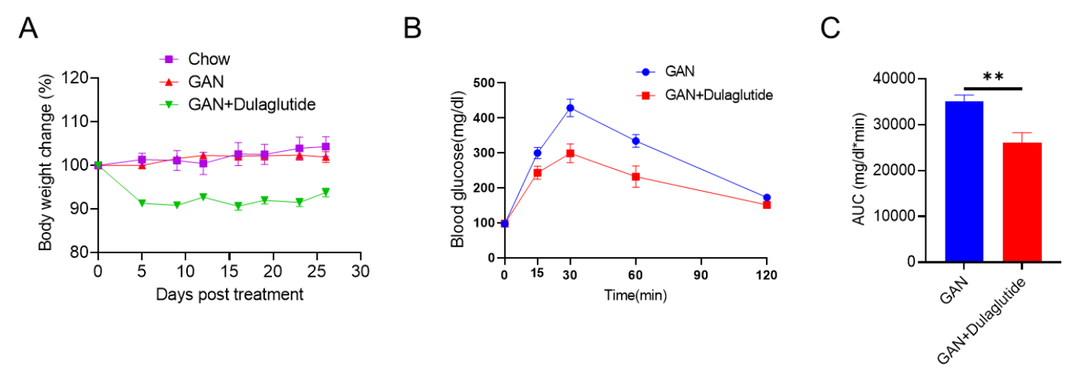
GAN饮食诱导的B-ob/0b小鼠NASH模型
(A)治疗下的体重变化。(B)治疗后的葡萄糖耐受能力。(C)B图曲线下的面积。
Data are expressed as mean ± SEM. N=9 mice per group. *p<0.05, **p<0.01,***p<0.001.
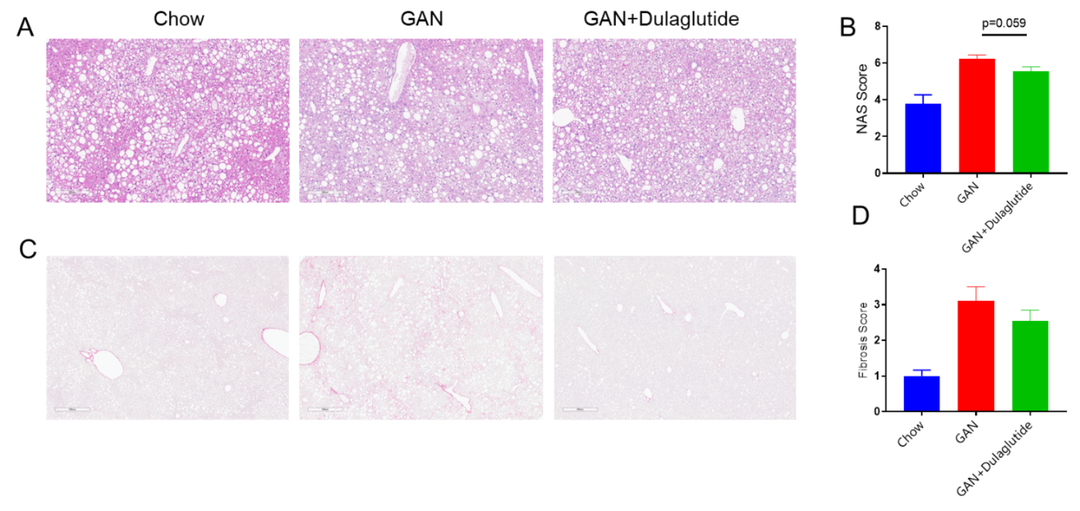
GAN饮食诱导B-ob/ob小鼠的NASH及纤维化
(A)诱导16周后H&E染色的代表性图片。(B)NAS(NAFLD acticity score)评分。(C)诱导16周后天狼星红染色的代表性图片。(D)天狼星红染色的纤维化评分。
Data are expressed as mean ± SEM. N=9 mice per group.
百奥动物NASH模型比较
百奥动物可提供多款饮食/饮食化学联合诱导的NASH小鼠模型,以及基于NASH模型的药物药理药效评估服务,欢迎联系洽谈。
参考资料:
1. Fu Y, et al., Diagnostic and therapeutic strategies for non-alcoholic fatty liver disease. Front Pharmacol. 2022 Nov 2;13:973366.
2. Oseini, A.M. and Sanyal, A.J. Therapies in non-alcoholic steatohepatitis (NASH). Liver Int, 2017,37: 97-103.
3. Hansen, H.H., et al., Human translatability of the GAN diet-induced obese mouse model of non-alcoholic steatohepatitis. BMC Gastroenterol. 2020 Jul 6;20(1):210
4. Hansen, H.H., et al., Mouse models of nonalcoholic steatohepatitis in preclinical drug development. Drug Discov Today, 2017. 22(11): p. 1707-1718.
5. Ibrahim, S.H., et al., Animal Models of Nonalcoholic Steatohepatitis: Eat, Delete, and Inflame. Dig Dis Sci, 2016. 61(5): p. 1325-36.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号