系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)是一种严重的自身免疫性疾病,主要特征为免疫调节功能紊乱,通过自身反应性细胞和抗体可引发炎性细胞因子的过度产生和攻击正常组织(心脏、关节、皮肤、肺、血管、肝脏、肾脏和神经系统)[1]。
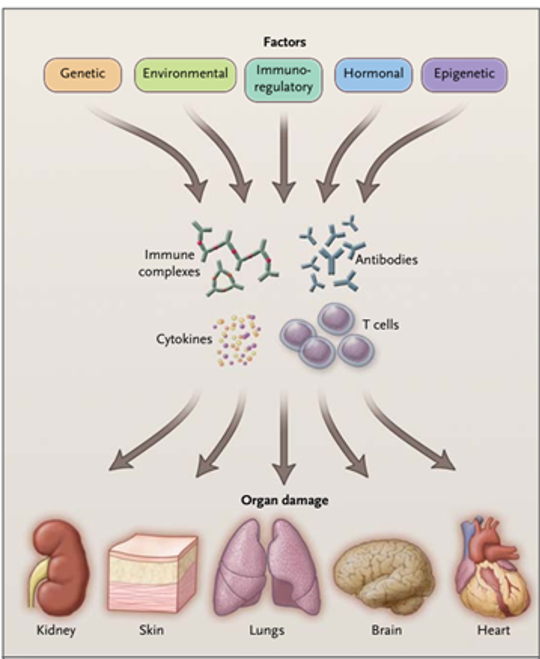
系统性红斑狼疮发病机制综述[1]
遗传、环境、激素、表观遗传和免疫调节因素依次或同时作用于免疫系统。致病因素的作用导致自身抗体、免疫复合物、自身反应性或炎症性T细胞和炎症细胞因子的产生,这些细胞可能启动和放大各种器官的炎症和损伤。受局部因素影响,靶器官可能进一步受损。
流行病学数据显示,我国SLE疾病负担较重,预估发病率约为8.57/10万人年,位居全球第四位[2]。其中约90%的SLE患者是女性,其余10%为男性及儿童。研究显示,SLE患者5年生存率从20世纪50年代的50%~60%升高至90年代的超过90%,并在2008年~2016年逐渐趋于稳定。SLE已由既往的急性、高致死性疾病转为慢性、可控性疾病[3]。
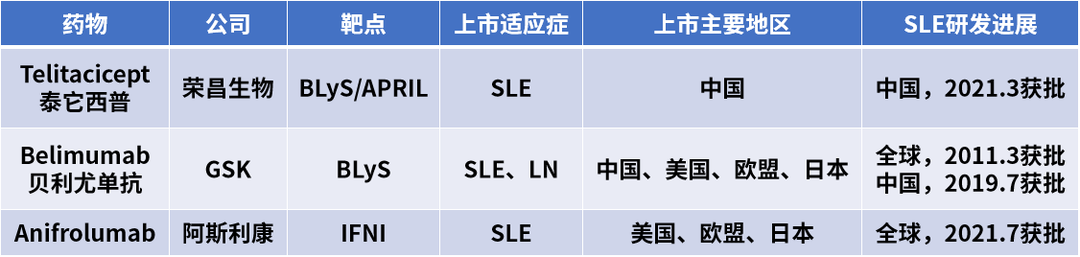
SLE传统治疗药物包括糖皮质激素、抗疟药、免疫抑制剂、富马酸酯、间充质干细胞、小剂量白细胞介素2(IL2)、生物制剂等。目前,获批上市用于治疗SLE的靶向生物药仅3种。
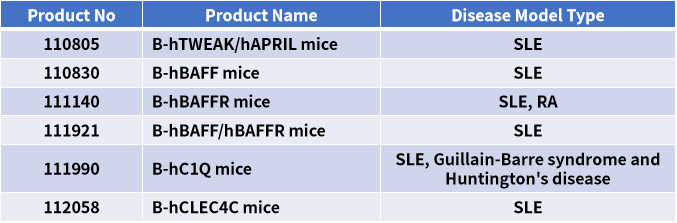
BioMice百奥动物自主开发了一系列稳定的靶点人源化小鼠模型,能够在不同方面模拟SLE发生发展过程,为临床前开发、评价更有效的SLE治疗药物提供了相应的疾病模型,加速了相关药物的研发进程。部分模型数据展示如下:
B-hTWEAK/hAPRIL mice

肿瘤中的TWEAK/Fn14信号通路[4]。将TWEAK与Fn14结合导致Ect2 GEF激活Cdc42,随后由Trio GEF激活Rac1,促进胶质瘤细胞的迁移和侵袭。TWEAK/Fn14信号同时激活经典和替代NF-κB通路,诱导细胞因子、趋化因子、粘附分子的产生。TWEAK/Fn14相互作用激活TRAF2信号通路。然后,Fn14招募一个cIAP1 TRAF2复合体。cIAP1使细胞对TNF-α敏感。TNF-α通过与TNFR1和TNFR2两种受体结合产生不同的效应。TNFR1可诱导细胞死亡,TNFR2可促进细胞增殖。
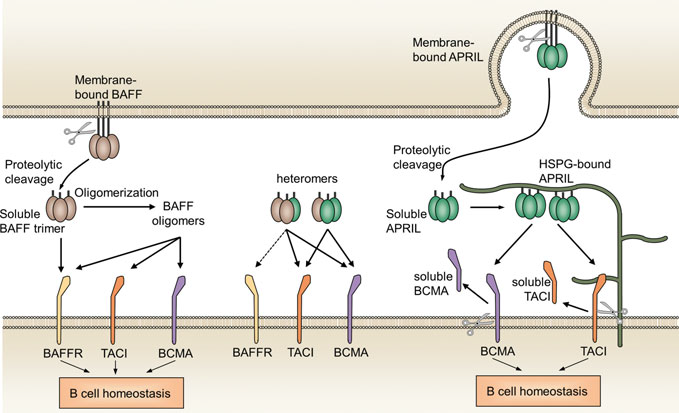
BAFF和APRIL受体相互作用[5]。B细胞刺激分子BAFF和APRIL是维持B细胞和体液免疫的关键因素。BAFF和APRIL可以裂解成三聚体可溶性细胞因子,也可以组装成异构体。BAFF结合它的三个受体具有不同的亲和力:它与BAFF-R结合最强,其次是TACI,与BCMA结合较弱。APRIL是BCMA的首选配体,其次是TACI。APRIL还在细胞外基质和肿瘤或其他细胞表面与HSPG结合,触发APRIL多聚化并通过TACI实现信号传递。BAFF通过BAFF-R信号通路使用NF-κB和PI3K通路,而APRIL信号通过NF-κB通路与BCMA和TAC结合。
B细胞蛋白表达分析
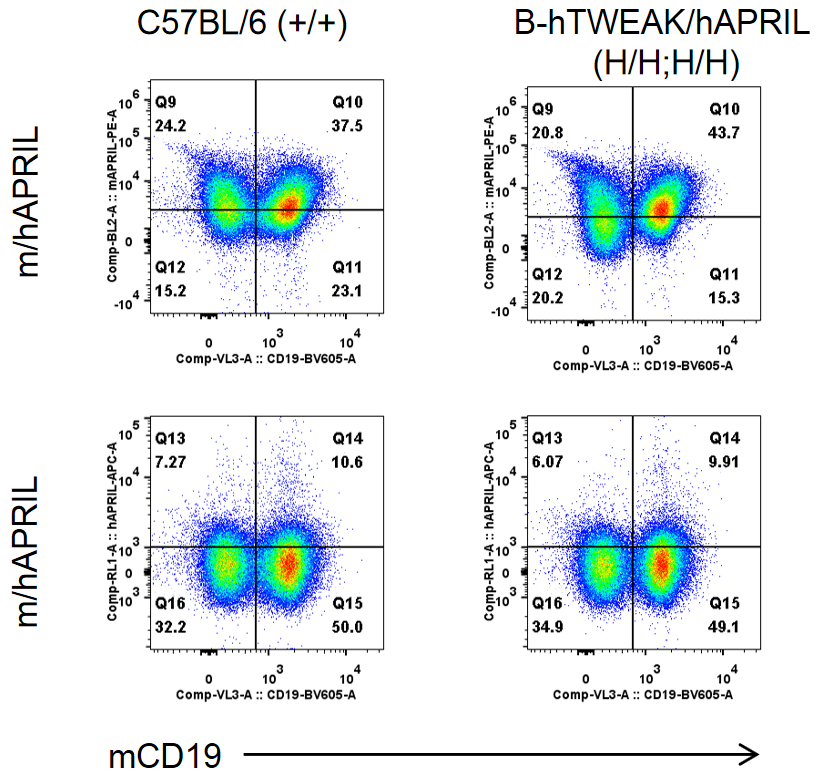
纯合B-hTWEAK/hAPRIL小鼠中种属特异性APRIL表达的流式细胞术分析。采集野生型(WT)小鼠和纯合B-hTWEAK/hAPRIL小鼠脾细胞,用抗APRIL抗体流式细胞术分析。由于抗体的交叉反应性,在WT小鼠和纯合B-hTWEAK/hAPRIL小鼠中检测到APRIL。
B-hBAFF mice
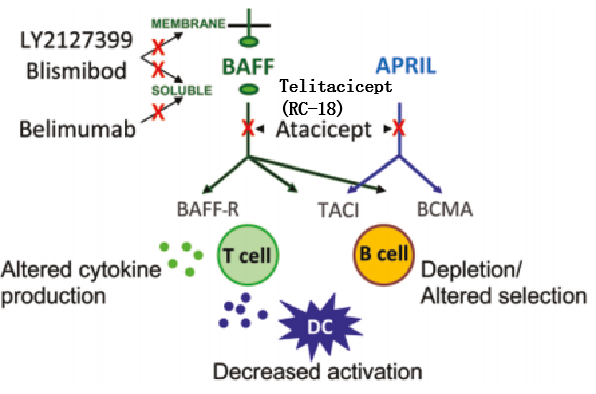
人B细胞激活因子和增殖诱导配体抑制剂的作用机制[6]。B细胞激活因子(BAFF)和增殖诱导配体(APRIL)与三种受体B细胞激活因子受体(BAFF-R)、跨膜激活剂和钙调节剂和亲环配体相互作用剂(TACI)和B细胞成熟抗原(BCMA)结合不同。选择性BAFF抑制剂阻断可溶性BAFF或可溶性和膜性BAFF与其受体之间的相互作用,使APRIL功能完整,而BAFF/APRIL双抑制剂atacicept (TACI-Ig)阻断BAFF和APRIL与所有三种受体的相互作用。BAFF抑制会消耗B细胞并改变自身反应性B细胞的选择,并可能对T细胞和树突状细胞(DC)有直接或间接的影响。
蛋白表达分析
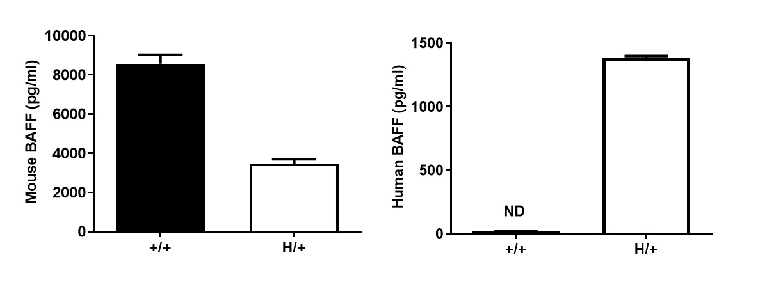
用ELISA法分析野生型(WT)小鼠和B-hBAFF小鼠中BAFF的表达。采集WT小鼠和杂合B-hBAFF小鼠血清,采用种属特异性BAFF ELISA试剂盒进行ELISA分析。在WT小鼠和杂合B-hBAFF小鼠(H/+)中检测到小鼠BAFF。人BAFF仅在杂合B-hBAFF小鼠中检测到。ND:检测不到。
B-hBAFFR mice
蛋白表达分析
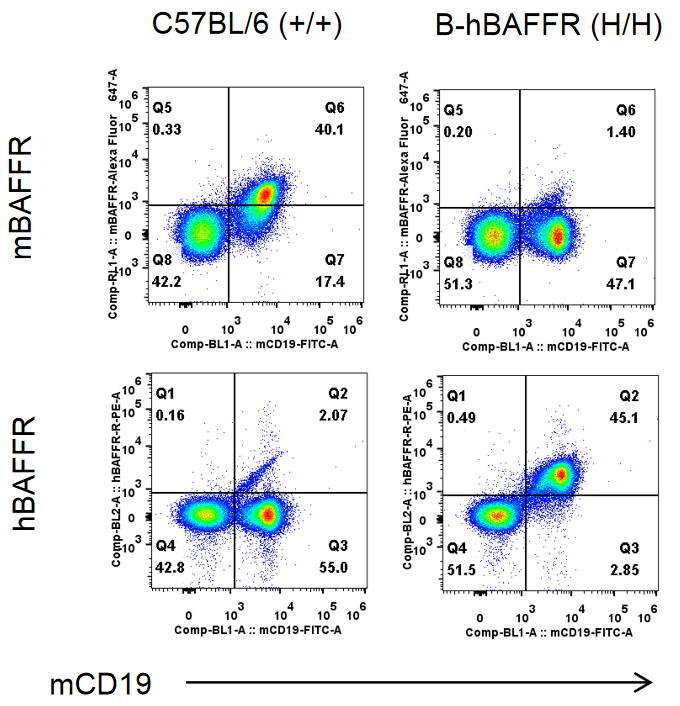
纯合B-hBAFFR小鼠中种属特异性BAFFR表达的流式细胞仪分析。取WT和纯合B-hBAFFR小鼠脾细胞,用种属特异性抗BAFFR抗体流式细胞术分析。小鼠BAFFR在WT小鼠中检测到。人BAFFR仅在纯合B-hBAFFR中检测到,而在WT小鼠中检测不到。
B-hBAFF/hBAFFR mice
蛋白表达分析
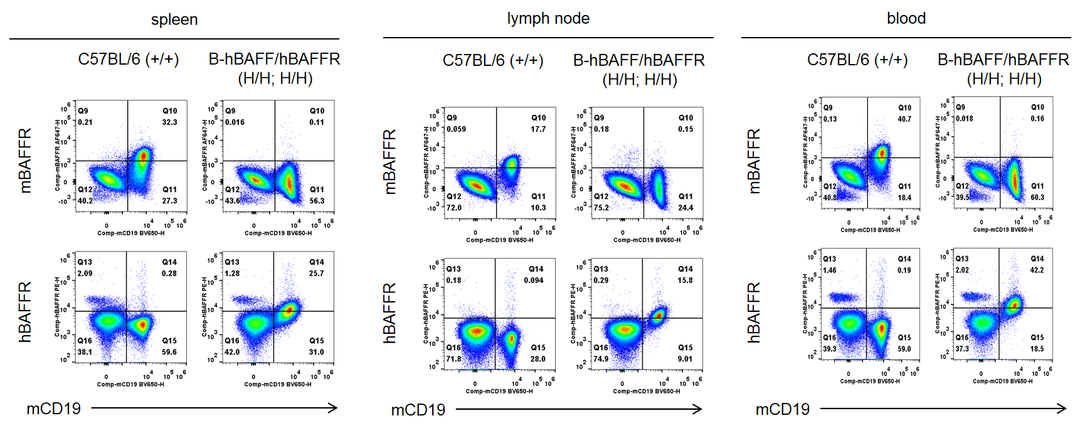
流式细胞术分析纯合B-hBAFF/hBAFFR小鼠中种属特异性BAFFR的表达。从野生型(WT)小鼠和纯合B-hBAFF/hBAFFR小鼠采集脾脏、淋巴结和血液中的B细胞,用种属特异性抗BAFFR抗体流式细胞仪分析。在WT小鼠中检测到小鼠BAFFR。人BAFFR仅在纯合B-hBAFF/hBAFFR小鼠检测到,而WT小鼠(+/+)则没有。
B-hC1Q mice
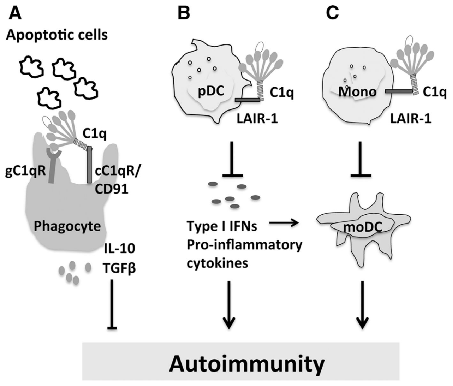
C1q在免疫稳态中具有基本的抑制作用[7]。a.在描述良好的凋亡细胞清除通路中,C1q与吞噬细胞上的各种gC1q和C1q尾部受体相互作用,导致细胞因子产生/炎症反应的调节。C1q胶原蛋白尾部与LAIR-1之间的相互作用可阻止pDCs和单核细胞产生I型ifn和炎症因子,并在稳态或炎症状态下抑制DC分化和激活。
PDC浆细胞样树突状细胞,Mono单核细胞,moDC单核细胞来源的树突状细胞。
蛋白表达分析

ELISA法检测C1Q在野生型C57BL/6小鼠和纯合B-hC1Q小鼠中的表达。采集野生型C57BL/6小鼠和纯合B-hC1Q小鼠血清。小鼠C1Q仅在野生型小鼠中检测到。C1Q在野生型C57BL/6小鼠和纯合B-hC1Q小鼠中均可检测到。因此,推测该抗人C1Q抗体在人鼠之间具有交叉反应性。
B-hCLEC4C mice
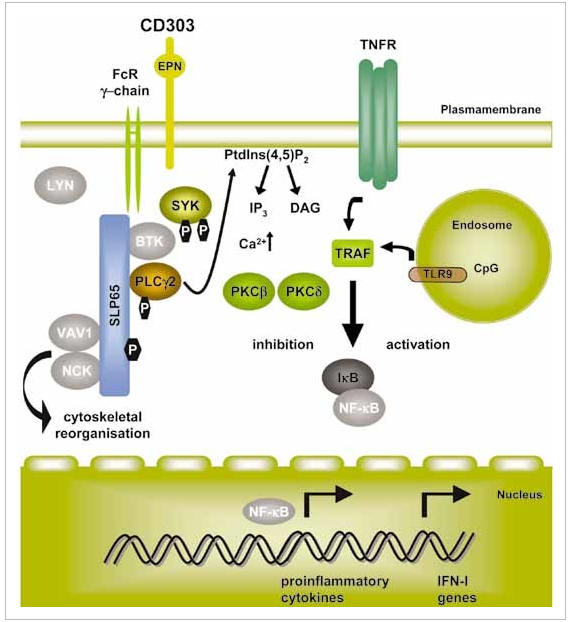
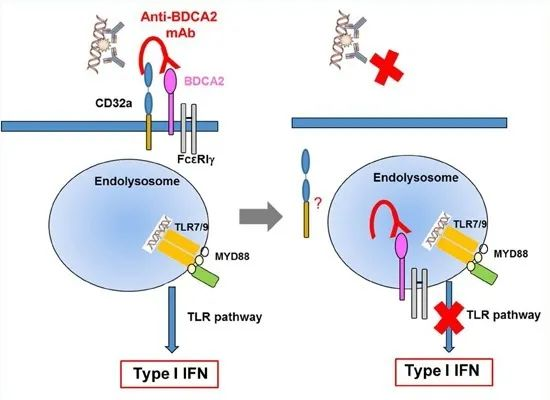
BDCA-2靶点全名为血液树突状细胞抗原2,也叫CLEC4C或CD303。CD303与FcRγ-链相关,在BCR样信号体中发出信号。触发CD303导致Syk的激活,SLP65的募集和PLCγ2的活性。在pDC中,PLCγ2-PKC通路可能在CD303触发后对NF-kB通路起负调控作用,并抑制IFN-I基因。越来越多的证据表明,pDC作为IFN-I的主要生产者可能在SLE的发病机制中发挥作用。pDC衍生的I型IFN被认为在SLE的致病性中发挥重要作用。血液树突状细胞抗原(BDCA2)是一种受体,特异性表达于人类和非人类灵长类动物的pDCs上,抑制TLR7和TLR9介导的I型IFN[8,9]。
蛋白表达分析
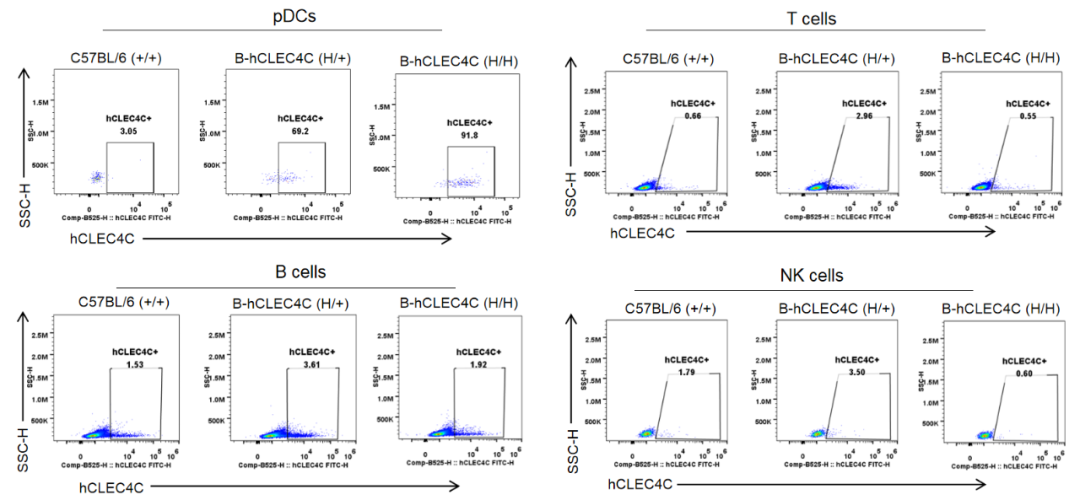
流式细胞术分析B-hCLEC4C小鼠中种属特异性CLEC4C表达。采集野生型C57BL/6小鼠、杂合B-hCLEC4C小鼠和纯合B-hCLEC4C小鼠脾细胞,用抗CLEC4C抗体进行流式细胞术分析。人类CLEC4C仅在B-hCLEC4C小鼠的浆细胞样树突状细胞(pDCs)中检测到,而在野生型小鼠中检测不到。在B-CLEC4C小鼠和野生型小鼠的T细胞、B细胞和NK细胞中均未检测到人CLEC4C。
参考资料:
[1] Tsokos GC. Systemic lupus erythematosus. N Engl J Med. 2011, 365(22):2110-21.
[2] Tian J, Zhang D, Yao X, et al. Global epidemiology of systemic lupus erythematosus: a comprehensive systematic analysis and modelling study. Ann Rheum Dis. 2022 Oct 14:ard-2022-223035.
[3]曾小峰,陈耀龙.2020中国系统性红斑狼疮诊疗指南[J].中华内科杂志,2020(3):172-185.
[4] Hu G, Zeng W, Xia Y. TWEAK/Fn14 signaling in tumors[J]. Tumor Biology, 2017, 39(6): 1010428317714624.
[5]Samy E, Wax S, Huard B, et al. Targeting BAFF and APRIL in systemic lupus erythematosus and other antibody-associated diseases[J]. International reviews of immunology, 2017, 36(1): 3-19.
[6]Boneparth A , Davidson A . B-cell activating factor targeted therapy and lupus[J]. Arthritis Research & Therapy, 2012, 14(4 Supplement):S2-S2.
[7]Son M, Diamond B, Santiago-Schwarz F. Fundamental role of C1q in autoimmunity and inflammation. Immunol Res. 2015;63(1-3):101-106. doi:10.1007/s12026-015-8705-6
[8]Röck J, Schneider E, Grün JR, et al. CD303 (BDCA-2) signals in plasmacytoid dendritic cells via a BCR-like signalosome involving Syk, Slp65 and PLCgamma2. Eur J Immunol. 2007;37(12):3564-3575. doi:10.1002/eji.200737711
[9]Pellerin A, Otero K, Czerkowicz JM, et al. Anti-BDCA2 monoclonal antibody inhibits plasmacytoid dendritic cell activation through Fc-dependent and Fc-independent mechanisms. EMBO Mol Med. 2015;7(4):464-476. doi:10.15252/emmm.201404719






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号