01、背景介绍
X射线计算机断层扫描(X-CT)作为一种非破坏性成像技术在医学和科学研究界广为人知,图像的黑白对比度来源于材料或者动物不同部位的吸收系数[1]。Micro-CT(Micro Computed Tomography,微计算机断层扫描技术),也称为显微CT、微焦点CT或者微型CT。它是采用了与普通临床CT 不同的微焦点X 射线球管以及对应探测面板,是对活体小动物或多种硬组织和相关软组织进行扫描成像分析的技术,它的分辨率高达几微米,具有良好的“显微”作用,可以在不对样本进行任何预处理的情况下清楚的了解样本内部显微结构。Micro-CT可用于医学、药学、生物、考古、材料、电子、地质学等诸多领域的研究。
1895 年,Wilhelm C. Roentgen 发现了X 射线,并为夫人拍下了世界上第一张X片——戴戒指的手掌照片。1967 年,Godfrey N. Hounsfield 发明了第一台CT设备,能够从多个角度拍摄,在不破坏物体的情况下观察其内部结构,采集被摄物体的三维信息。19 世纪70 年代,医院开始使用CT诊断疾病。20世纪90年代,人们对小动物模型的兴趣不断增加,新的X射线探测器的开发刺激了小动物专用扫描仪的发展。现在,微型CT系统已经变得高度复杂,是学术界和工业界临床前成像中心的重要组成部分[2]。

几篇综述论文介绍了Micro-CT的成像原理及应用[4] [5],概括来说,成像原理如下:当X 射线透过样本时,样本各个部位对X射线的吸收率不同。X 射线源发射X 射线,穿透样本,最终在X 射线检测器上成像。对样本进行180˚ 以上的不同角度成像,通过计算机软件,将每个角度的图像进行重构,还原成在电脑中可分析的3D 图像。

Micro-CT基础示意图[3]
02、Micro-CT在肺部疾病小鼠模型研究上的应用
肺肿瘤研究方向

Micro-CT检测亚甲基蓝(MB)对hEGFR突变转基因小鼠自发肺腺癌药效作用[6]

Micro-CT检测KC自发非小细胞肺癌小鼠在重组病毒感染强制表达IRF8下的肿瘤抑制效果[7]
肺纤维化研究方向


博来霉素诱导的小鼠肺纤维化模型。根据不同HU区间进行正常、低通气、不通气区域体积的分割。在第4周,结果显示低通气和不通气区域的比例都很高,然后在第10周和第16周之间明显减少,而在正常通气的区域,则呈现相反的态势。[13]
通过使用Micro-CT对小鼠肺部区域进行扫描重建成像,利用肺部分析算法(Hounsfield单位阈值范围分别为-434至-121HU和-120至121HU)实现对通气不良和非通气不良区域的影像区分,从而实现对肺部区域动态检测,并进行功能和结构的评价。量化的影像数据也能提供纵向研究的信息以减少动物之间的变异性,可以更进一步验证体外数据。
早期评估我们可以选择固定点(冠状面气管分支)位进行观察肺实质的变化,理应在造模第四周达到最大。

第四周肺实质面积最大[13]
利用小鼠不同方式造模致其产生非小细胞肺癌肿瘤/肺腺癌/肺部纤维化,用药后在活体模型小鼠上,连续观察其肺部实质病变的变化,就可以来评价该药物的有效性。预期利用Micro-CT,可以同时实现活体小鼠造模是否成功的验证,以及通过对小鼠肺部长期连续性的观察来实现药物有效性的评估。
已开展方法案例
肺部原位/自发肿瘤小鼠模型 (In vivo)-体积量化评价

FVB老龄鼠自发肺癌抗体药物药效评价。 (a) FVB老年鼠自发肺癌结节示意图,分别展示了横断面、冠状面、矢状面以及三种不同渲染方式的3D重建图像(绿色:肺部,红色:骨骼,蓝色:肿瘤,来自软件“simpleware”,蓝色肺部和红色肿瘤)。(b,c) 单臂试验下,靶向药物治疗后结节抓取绘制3D重建图像,其体积的变化量统计图。(n=每组10/8)
03、Micro-CT在肝癌小鼠模型研究上的应用
肝肿瘤研究方向

利用美天旎公司产品nano 12000肝特异性造影剂3D效果图[8]


Micro-CT检测肝转移性嗜铬细胞瘤小鼠模型肿瘤示意图,绿色代表实体瘤[9]
对于肝脏疾病尤其在肿瘤方面,想要精确判断肿瘤位置、体积还是需要肝特异性造影剂,使用的造影剂需要满足:1、仅和肝细胞结合或被摄取;2、长效造影且低毒性。市面上推荐美天旎Nano系列和MediLumine的Fenestra系列。
已开展方法案例
肝原位/STAM小鼠模型(In vivo)-肝肿瘤体积/最长径量化评价

Micro-CT检测肝肿瘤。(a)肝原位异种移植模型肿瘤示意图,黄色线段及方框内标注信息为实体瘤测量线段及长度,下方为3D渲染图像可在相同位置看到非肝细胞的肿瘤实质区域。(b)STAM模型肿瘤示意图黄色线段及方框内标注信息为实体瘤测量线段及长度,下方为3D渲染图像可在相同位置看到非肝细胞的肿瘤实质区域。(c,d) 肝原位肿瘤体积与STAM模型肿瘤最大长经统计图。

04、Micro-CT在骨科疾病模型上的应用
骨疏松研究方向

蓝萼甲素作用于卵巢切除诱导的小鼠骨质疏松模型,其药效随剂量明显改善。[10]

龙葵作用于卵巢切除诱导的SD大鼠骨质疏松模型,药效随剂量明显改善,图像展示股骨头骨小梁分析。[11]
骨关节炎研究方向

半月板扰动诱导的骨性关节炎模型分别展示假手术组、右单侧和双侧造模组可视图,量化统计图分别为内侧半月板体积、软骨下松骨厚度、软骨下骨厚度。[12]

图片展示软件分割内侧半月板、软骨下骨以及软骨下松骨感兴趣区域。[12]
骨科疾病模型的判断依赖Micro-CT高分辨扫描,因为需要量化皮质骨和骨小梁区域亦或者特定部位孔隙度、体积等。一些疾病如接下来介绍的模型建立案例-进行性骨干发育不良小鼠模型,也可通过明显的表型进行判断,表型的判断是细致的。诚然,模型种类繁多但在骨科上,仍然病症是共性的,如骨量变化。所以多角度、多参数的分析仍是需要的,于客户于内研都是扎实的积累。
已开展方法案例
骨质疏松小鼠模型 (Ex/In vivo)-密度属性、结构性参数
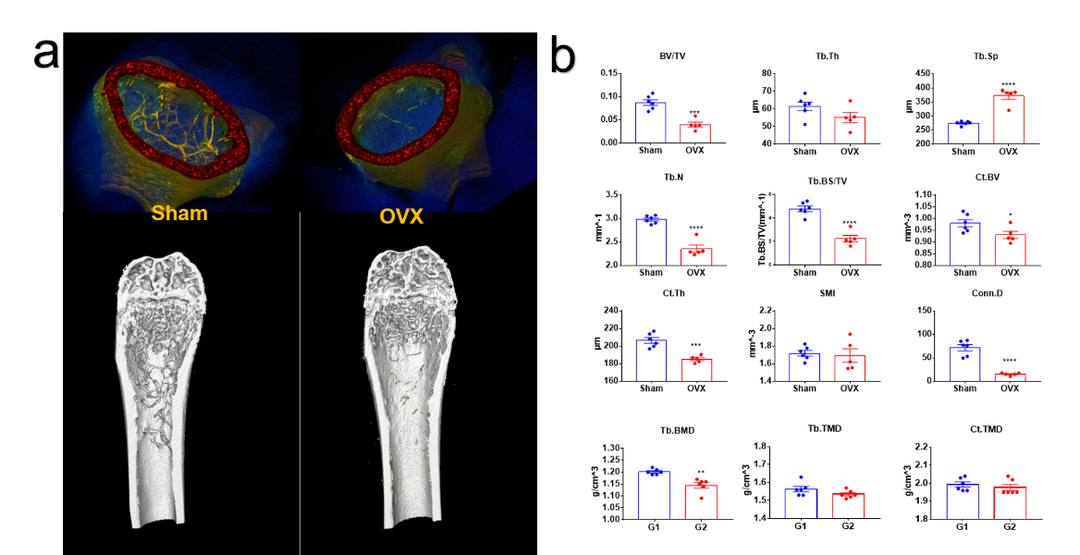
卵巢切除诱导的骨质疏松模型离体检测。(a)骨质疏松模型假手术组(sham)和手术组(OVX)3D重建图像。(b)骨小梁、皮质骨结构性参数以及密度属性参数统计图。指标意义参考下方表格,综上结果模型特征明显,手术成功。
骨分析常见参数的意义


活体下,测定骨密度支持自定义区域以及长度,如红色区域股骨远端,紫色区域股骨近端及脊椎骨等。Rod1、Rod2、Rod3、Rod4分别为不同密度的羟基磷灰石。

靶向抗体药物治疗药效良好。假手术组(G3),手术组(G4),药物溶剂组(G5),药物浓度递增组(G6-G8),数据显示为平均值±SEM,并使用单因素ANOVA进行分析与G4进行比较,“in vivo BMD”与G5进行比较。
骨性关节炎小鼠模型(Ex vivo)-体积、结构性参数

小鼠交叉韧带横断术(ACLT)骨性关节炎。a. 骨性关节炎模型3D重建图,手术组软骨下骨大面积增生、磨损。b. 内侧半月板抓取示意图 c. 股骨软骨下骨松质骨横截面,手术组骨体积减少。d. 软骨下松骨结构性参数以及胫骨平面各项参数。
骨性关节炎模型造模手段通常有交叉韧带横断术(ACLT)和内侧半月板扰动(DMM)二者的评判标准和分析角度几乎一致,如胫、股骨软骨下松骨的结构性参数以及胫骨平面的厚度和孔隙度等,如果更关注软骨还可以进行离体组织造影来分析软骨。
进行性骨干发育不良小鼠模型(In vivo)-影像评价

三维成像显示不正常表型小鼠长骨(四肢)可见多处骨裂和骨增厚以及弯曲。颅骨、髋骨、坐骨可见明显异常。
05、Micro-CT在肥胖小鼠、脂肪肝小鼠模型上的研究应用
已开展方法案例
肥胖小鼠模型-皮下、内脏脂肪/体重质量比

脂肪分割示意图和肥胖小鼠及野生小鼠脂肪3D重建。(a) 红色为内脏脂肪,蓝色为皮下脂肪。重建图显示肥胖小鼠内脏及皮下大量脂肪,野生小鼠几乎无明显脂肪堆积(b)脂肪/体重、皮下脂肪/体重、内脏脂肪/体重质量比,HFD组(G1),STD组(G4)。
NASH小鼠模型-脂肪肝程度量化-CT值比及绝对CT值

使用Micro-CT量化脂肪肝。图片由上至下从左至右展示,肥胖小鼠肝脏感兴趣区域的抓取,模块自动进行分析,CT值比反应脂肪肝程度以及肝脏绝对CT值的比较。
目前CRO公司在NASH临床前药物测试评价上几乎都是横向研究,除了实验中途的血生化、血常规指标反应药物响应,最终只能依靠终点收集样本进行病理评价。借助Micro-CT不仅可以追踪模型发病进展,做到归一化,也可以评价药物的连续作用。相较于病理漫长的实验周期,快速诊断量化会成为临床前药物测试纵向研究的利器。
生命科学中对无损、快速和可靠的成像方法的需求,以及对高分辨率三维(3D)成像的需求,用以揭示整个生物体内的组织结构,使得微型CT不断发展。多年来,微型CT已经渗透进生命科学,并被广泛应用于从医学到生态学的许多不同领域。微型CT作为一种无损和高分辨率成像技术,可以与其他成像技术互补使用,以尝试整合不同方法的可视量化结果,从而得出更可靠的科学结论。每种成像技术的内在物理局限性通过多种技术的结合,发展出更全面的方法,从细胞、组织层面的形态学堆栈的三维结构,汇编了更广泛的信息。[14]
06、目前开展服务内容
下面展示了百奥赛图影像药效组方法建立成功并且可以对外服务的列表,更多详细信息欢迎联系。

绿色代表技术成熟,黑色代表可共同开发。
参考文献:
[1] Scharf J , Chouchane M , Finegan D P , et al. Bridging Nano and Micro-scale X-ray Tomography for Battery Research by Leveraging Artificial Intelligence[J]. 2021.
[2] Clark D P , Badea C T . Advances in micro-CT imaging of small animals[J]. Physica Medica, 2021, 88(6):175-192.
[3] Cengiz I F , Oliveira J M , Reis R L . micro-ct -a digital 3d microstructural voyage into scaffolds: a systematic review of the reported methods and results[J]. 2019.
[4] Ashton JR, West JL, Badea CT. In vivo small animal micro-CT using nanoparticle contrast agents. Front Pharmacol. 2015;6:256.
[5] Clark D, Badea C. Micro-CT of rodents: state-of-the-art and future perspectives. Physica Medica. 2014;30:619–34.
[6] Zhenzhen Fan1, Yahui Tian. Blocking interaction between SHP2 and PD-1denotes a novel opportunity for developing PD-1inhibitors. EMBO Molecular Medicine. 2020;12:e11571
[7] Liang Jinxia,Lu Feng,Li Bo et al. IRF8 induces senescence of lung cancer cells to exert its tumor suppressive function.[J] .Cell Cycle, 2019, 18: 3300-3312.
[8] Liu C N , Morin J , Dokmanovich M , et al. Nanoparticle contrast-enhanced micro-CT: A preclinical tool for the 3D imaging of liver and spleen in longitudinal mouse studies[J]. Journal of Pharmacological and Toxicological Methods, 2019, 96:67-77.
[9] Martiniova Lucia,Schimel Daniel,Lai Edwin W et al. In vivo micro-CT imaging of liver lesions in small animal models.[J] .Methods, 2010, 50: 20-5.
[10] Zhu Meisong,Shan Jing,Xu Huaen et al. Glaucocalyxin A suppresses osteoclastogenesis induced by RANKL and osteoporosis induced by ovariectomy by inhibiting the NF-κB and Akt pathways.[J] .J Ethnopharmacol, 2021, 276: 114176.
[11] Kim Jae-Hyun,Shin Hwajeong,Kim Minsun et al. Solanum nigrum Line inhibits osteoclast differentiation and suppresses bone mineral density reduction in the ovariectomy‑induced osteoporosis model.[J] .Mol Med Rep, 2021, 24: undefined.
[12] Fouasson-Chailloux Alban,Dauty Marc,Bodic Benoit et al. Posttraumatic Osteoarthritis Damage in Mice: From Histological and Micro-Computed Tomodensitometric Changes to Gait Disturbance.[J] .Cartilage, 2021, 13: 1478S-1489S.
[13] Song Shengren,Fu Zhenli,Guan Ruijuan et al. Intracellular hydroxyproline imprinting following resolution of bleomycin-induced pulmonary fibrosis.[J] .Eur Respir J, 2022, 59: undefined.
[14] Keklikoglou K , Arvanitidis C , Chatzigeorgiou G , et al. Micro-CT for Biological and Biomedical Studies: A Comparison of Imaging Techniques.[J]. Journal of imaging, 2021, 7(9).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号