经历新冠近四年,疫情仍然以星星之火的态势影响着国内外。近两年来,全球研发企业与投资机构的目标几乎都投向了承担着“事前预防”角色的疫苗企业,但此刻亦有许多医药巨头正在悄然行动,在“事后补救”的抗纤维化赛道上积极布局。其中不乏 Boehringer Ingelheim、Genentech、BMS、Roche(Promedior)这些国际大厂,也有 FibroGen、Pliant Therapeutics、Galecto、Blade Therapeutics 等生物技术公司[1]。医药巨头的关注无疑是对领域未来机会的认可。
目前,全球仅上市吡非尼酮(抑制TGF-β1的生成和减少血管因子的合成)和尼达尼布(血管生成因子抑制剂)两款药物,但两款药物因其安全性不佳,并且药效有限,仅仅可以延缓病人的纤维化进展,靶点和机理等药理学内容模糊。因此,以 Pfizer 和 Gilead 为代表的跨国制药巨头,已逐渐将新药开发战略重心转移至抗纤维化药物领域中,以满足巨大的市场需求。
不是癌症的癌症--纤维化
纤维化(Fibrosis)其实是多种类型组织损伤尤其是在慢性炎症性疾病过程中,组织修复反应失调的结局。纤维化几乎发生在所有器官和组织中,例如心、肝、肺、肾、皮肤等,长期以来,人们一直认为纤维化不可逆,但临床前模型和临床试验均表明,它是一个高度动态变化的过程。
当组织受到损伤时,多种来源的肌成纤维细胞可通过重塑细胞外环境来启动伤口愈合反应,以恢复组织完整性并促进实质细胞的替换。通常,当组织愈合时,这个促纤维化程序被关闭。然而,持续的损伤和损害会导致这一过程的失调,导致细胞外基质(ECM )蛋白在病理上的过度沉积,并伴随着肌成纤维细胞活性的上调,造成巨噬细胞和免疫细胞浸润的慢性炎症环境。在这种细胞环境中,细胞因子和生长因子被大量释放,包括转化生长因子-β(TGF-β)家族成员和 Wingless/Int-1(Wnt1),它们是纤维化过程的主要效应子。TGF-β 和 Wnt1 结合其干细胞表面受体,并发起下游信号转导,最终分别导致 Smad2/3 和 CBP/β-Catenin 转录调节物的核易位。这导致靶基因表达上调,其功能进一步增强肌成纤维细胞分化和 ECM 蛋白(包括胶原、层粘连蛋白和纤维连接蛋白)的产生和分泌。
随着过多 ECM 沉积的进行,基体的结构发生变化并变硬。细胞通过细胞表面整合素受体(激活 Hippo 信号转导通路及其主要下游效应子 YAP 和 TAZ)的机械传导感受 ECM 张力。在另一个前向循环中,激活的 YAP 和 TAZ 转位到胞核,促进包括 CTGF 和 PDGF 在内的促生长基因的上调,这些基因通过 PI3K/AKT/mTOR 通路促进肌成纤维细胞的增殖和活化。
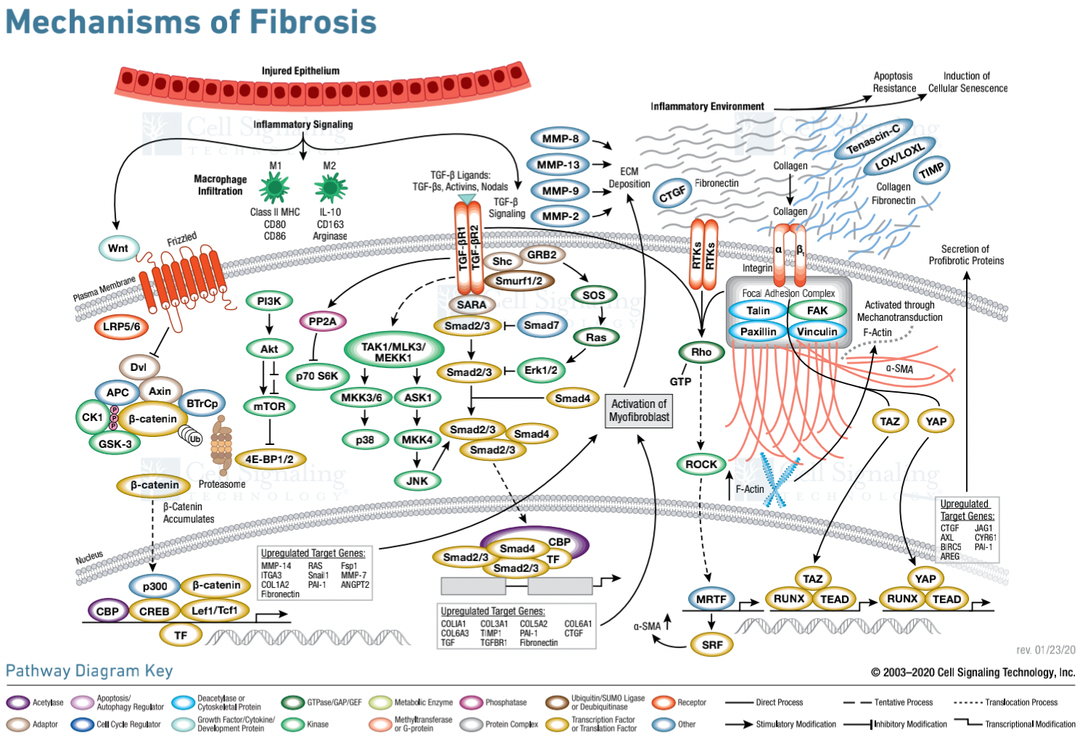
纤维化损伤过程[2]
常见的与纤维化有关的疾病有:特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、肝硬化、慢性肾病、心肌梗死、心力衰竭以及非酒精性脂肪肝炎(NASH)等。纤维化还影响肿瘤侵袭和转移、慢性移植物排斥和许多进行性肌病的发病机制。除器官损伤外,纤维化还与癌症进展有关,因为纤维化 ECM 可刺激细胞增殖并改变细胞极性,从而促进肿瘤发育和生长。
抗纤维化的应用领域广泛且机制具有一定的共性,因此专注于抗纤维化药企的平台技术具有通用性,目前各家企业的重心一般集中于抗肺纤维化、肝纤维化、肾纤维化、心血管纤维化以及皮肤、视网膜纤维化等领域,其中,领先企业往往先从IPF以及肝纤维化开始,然后进行延展。
由于体外药效无法模拟真实体内纤维化环境,抗纤维化药物筛选只能使用漫长的体内试验来进行,几乎所有的新药筛选捷径,包括人工智能,都无法加快抗纤维化药物的研发进程。因此,临床前动物模型在药物研发过程中显得尤为重要,百奥动物自主研发了相应的肝纤维化和肺纤维化模型,为该领域临床前药效评价提供了稳定有效的工具,助力抗纤维化药物研究。
肝纤维化模型
四氯化碳(CCl4)诱导的肝纤维化
四氯化碳(CCl4)诱导的小鼠肝纤维化是被广泛接受的研究肝纤维化实验模型。它在许多方面反映了与毒性损伤相关的人类疾病模式,如α-SMA表达、星状细胞活化和关键基质成分(包括胶原蛋白-1、基质金属蛋白酶及其抑制剂TIMPs)已在该模型的发病机制中得到证实。
CCl4诱导肝纤维化模型的建立及组织学评价

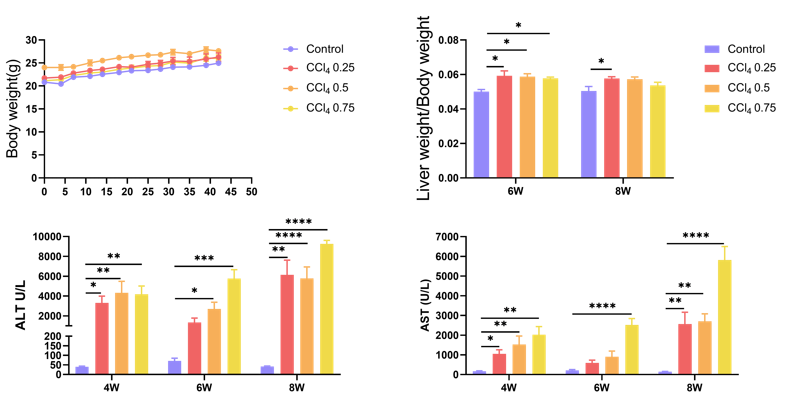
四氯化碳 (CCl4) 诱导的肝纤维化模型。8周龄雄性 C57BL/6 小鼠腹腔注射浓度为0.25、0.5和0.75 mL/kg的CCl4,每周2次。4、6和8周后小鼠的体重、肝重/体重和血液生化数据如上图。
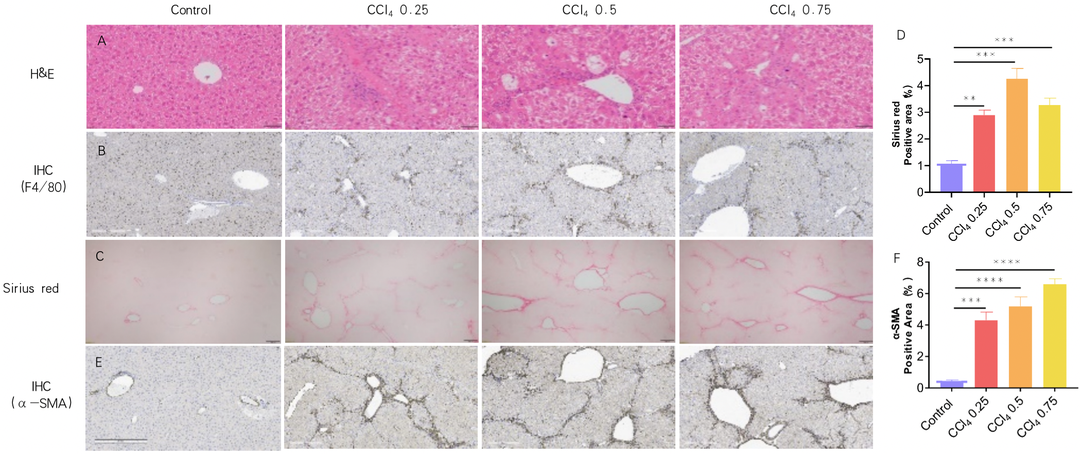
使用CCl4 诱导6周的肝纤维化模型。(A) H&E染色的代表性图片显示 CCl4 诱导后肝脏炎症增加。比例尺:50 μm。(B) 免疫组化的代表性图片,显示肝巨噬细胞(kupffer cells)标记物F480。(C-D) 天狼星红染色的代表性图片,显示肝纤维化增加。比例尺:200 μm。(E-F) 免疫组织化学的代表性图片显示肝脏中的成纤维细胞标志物α-SMA水平。比例尺:300 μm。
奥贝胆酸(OCA)在小鼠肝纤维化模型中的药效验证
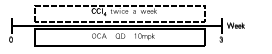
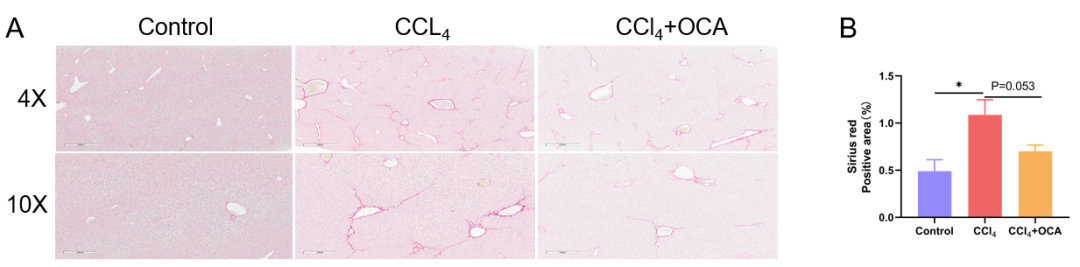
奥贝胆酸(OCA)治疗后肝纤维化减轻。(A) 图为经CCl4 诱导和 OCA 处理3周后,天狼星红染色显示肝纤维化的代表性图片。(B) 图表示天狼星红染色统计数据。数值为平均值±SEM。*p < 0.05。
胆管结扎诱导的肝纤维化
胆管结扎引起肝外胆道梗阻,从而导致胆管扩张和胆汁淤积。当胆管内压力进一步升高时,肝内胆管扩张破裂,肝内血管被扩张的胆管和外渗的胆汁同时压迫,肝细胞缺血坏死,纤维组织增生,围绕肝小叶向肝细胞周围扩散,最终可导致肝纤维化。
胆管结扎诱导肝纤维化模型的建立
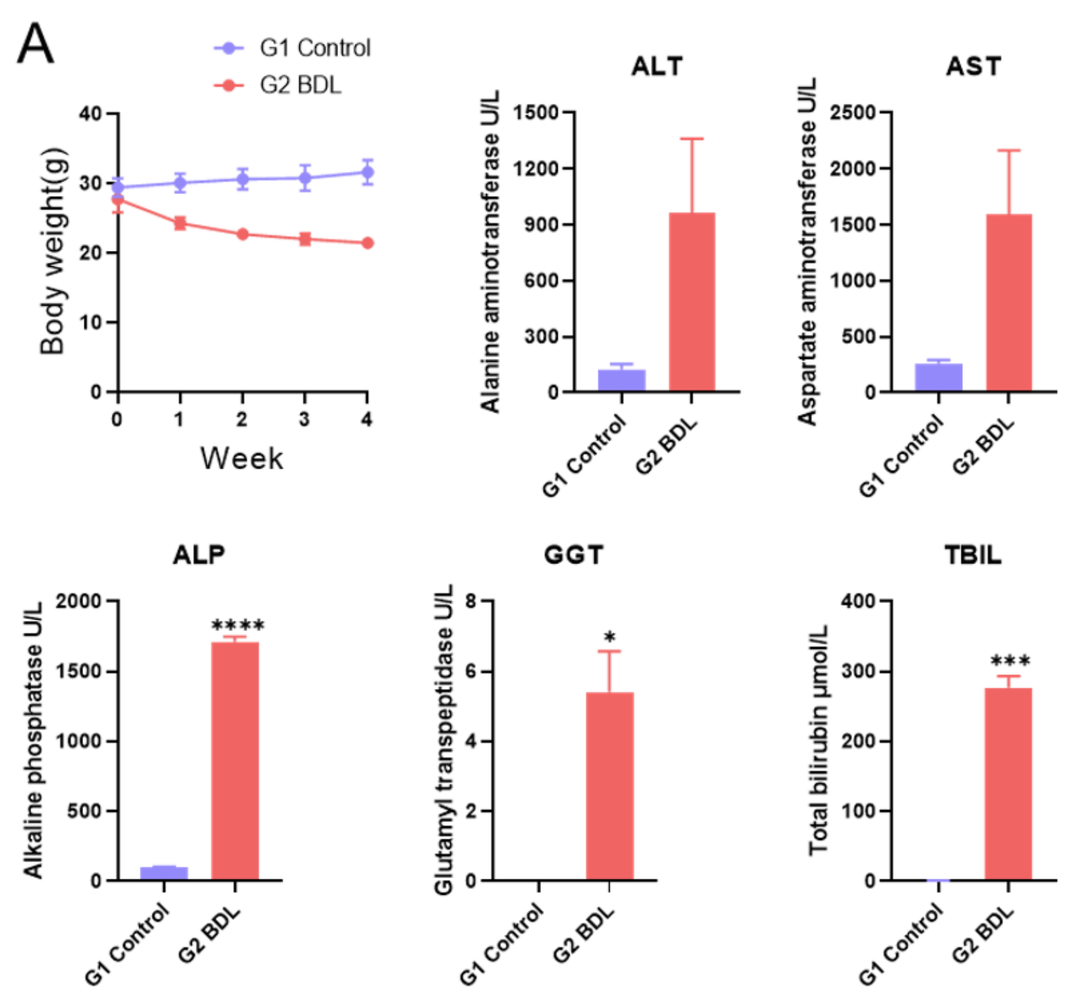
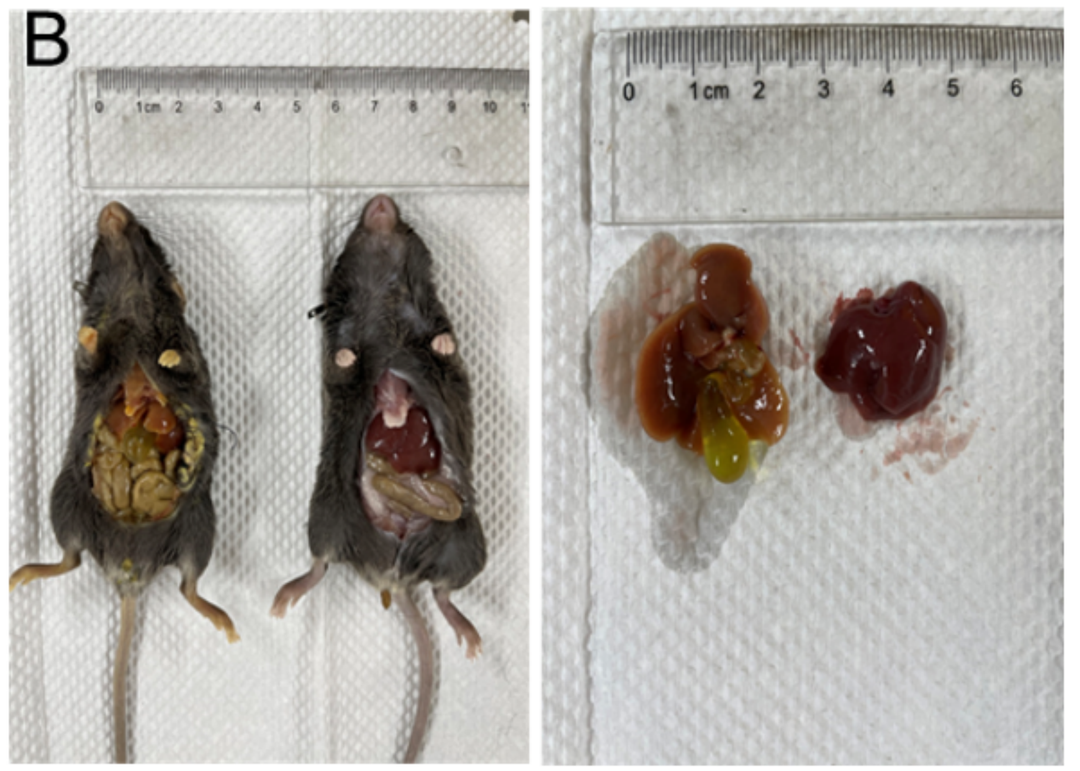
胆管结扎肝纤维化模型。(A) 图表示血清中ALT、AST、ALP、GGT和TBIL水平。 (B) 图表示BDL后4周肝脏代表性外观。数值为平均值±SEM。*p<0.05, ***p<0.001, ****p<0.0001。
胆管结扎所致肝纤维化模型的组织学评价
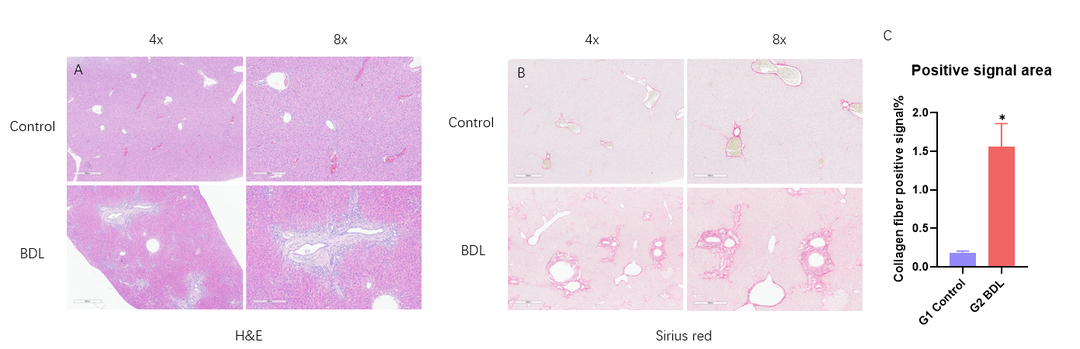
胆管结扎4周后H&E和天狼星红染色。(A) 图表示H&E染色代表性病理改变。(B) 图天狼星红染色代表性图片显示肝纤维化增加。(C) 图表示胶原纤维阳性信号区比例。数值为平均值±SEM。* p < 0.05。

胆管结扎4周后免疫组化染色。 (A-B) 免疫组化染色的代表性图像显示 F4/80 和阳性信号区比例。(C-D) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。
硫代乙酰胺(TAA)诱导的肝纤维化模型
硫代乙酰胺 (TAA) 是一种广泛用于模拟肝纤维化发病机制中产生损伤的化合物。TAA 通过其代谢产物硫代乙酰胺二氧化硫 (TASO2) 增加活性氧 (ROS) 的形成,引起严重的氧化应激以及脂质过氧化和蛋白质羰基和 DNA 加合物的生成。产生的ROS,引起肝星状细胞 (HSC) 活化,同时诱导造血干细胞转分化为肌纤维母细胞样细胞,导致 EMC 合成和降解失衡及持续纤维化过程。
TAA诱导肝纤维化模型的建立及组织学评价


TAA 诱导肝纤维化模型4周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色的代表性图像显示α-SMA水平和阳性信号区比例。(G-F) 天狼星红染色的代表性图像显示肝纤维化增加。
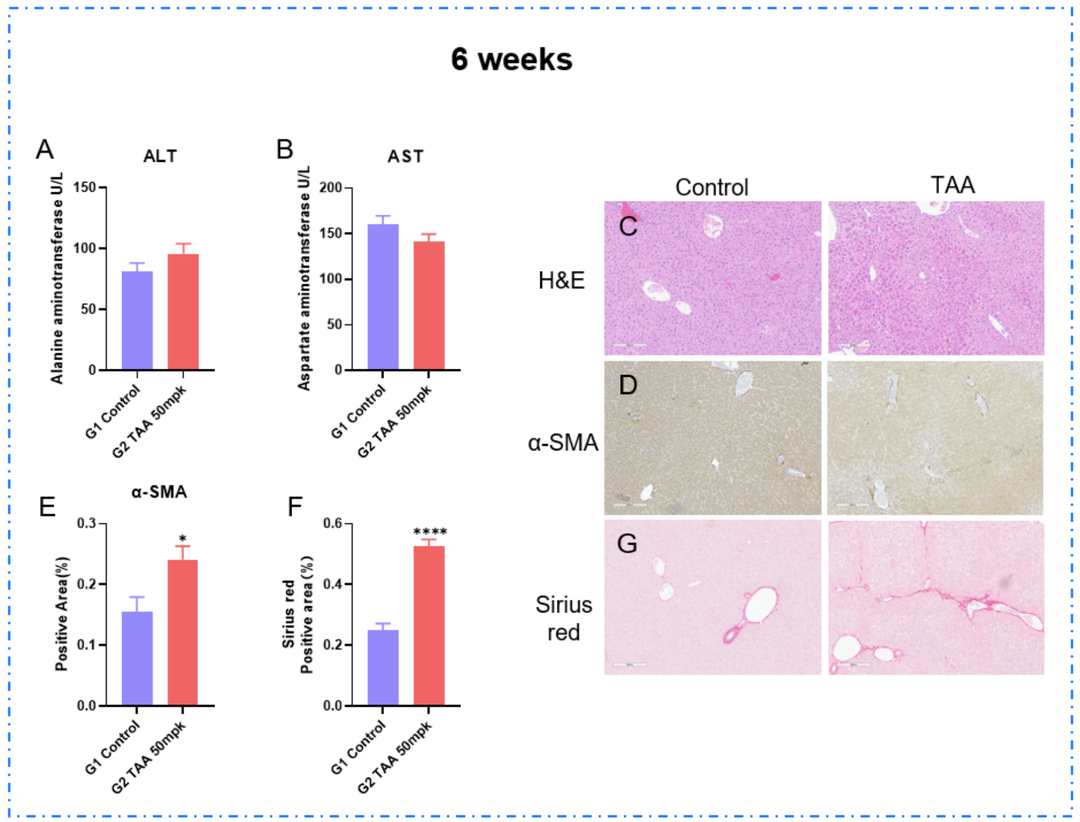
TAA 诱导肝纤维化模型6周。(A-B) 血清中 ALT 和 AST 水平。(C) H&E染色的代表性图片。(D-E) 免疫组化染色代表性图像显示α-SMA水平和阳性信号区比例。(F-G) 天狼星红染色的代表性图片,显示肝纤维化增加。
肺纤维化模型
博来霉素(BLM)诱导的肺纤维化小鼠模型
博来霉素 (BLM) 能够引起与接受化疗患者相似的组织学肺模式,是目前诱导动物肺纤维化应用最广泛的药物之一。BLM 通过裂解DNA、诱导炎症反应和增加上皮凋亡剂量发挥其细胞毒性作用,从而刺激肺损伤并导致纤维化。
肺纤维化小鼠模型的建立及组织学评价
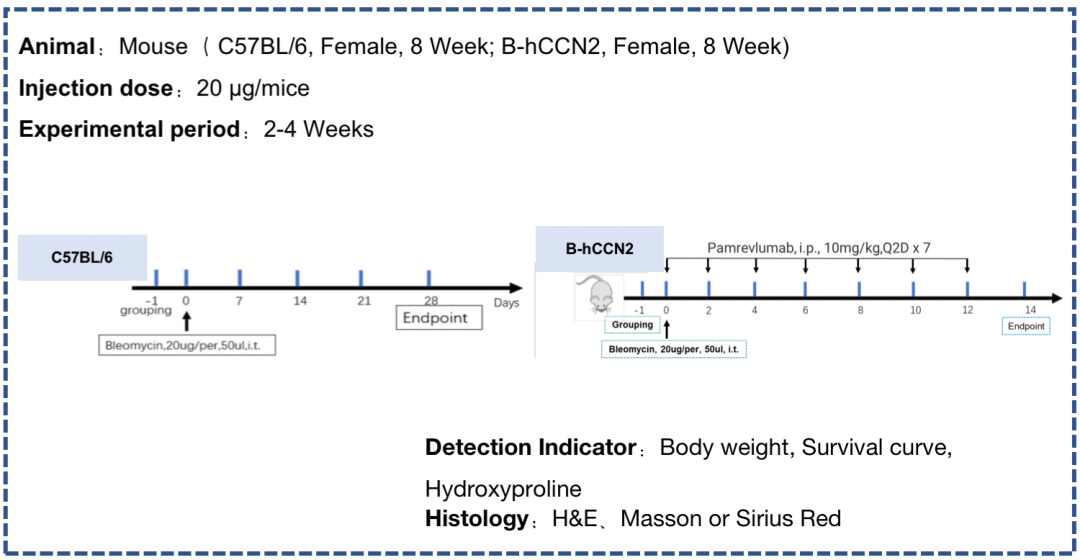
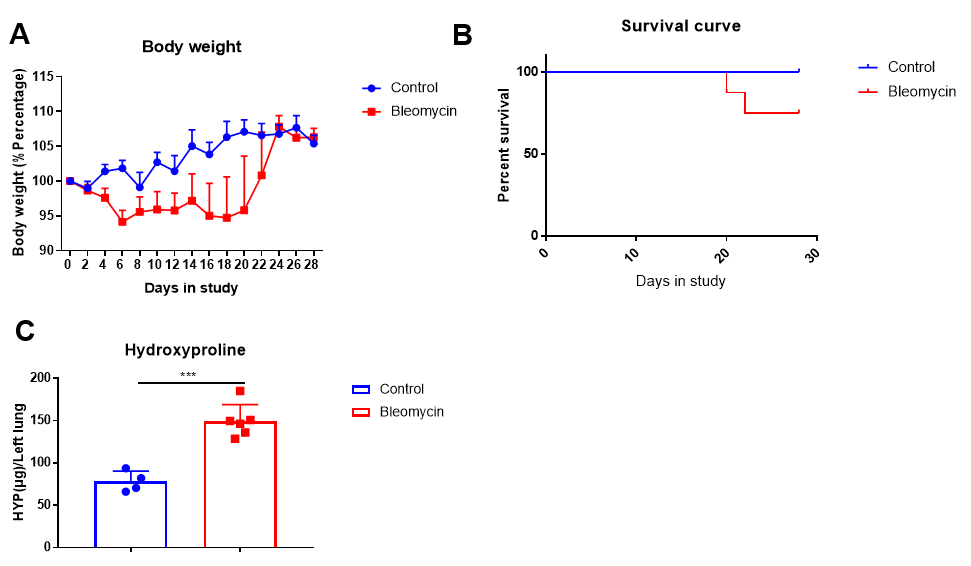
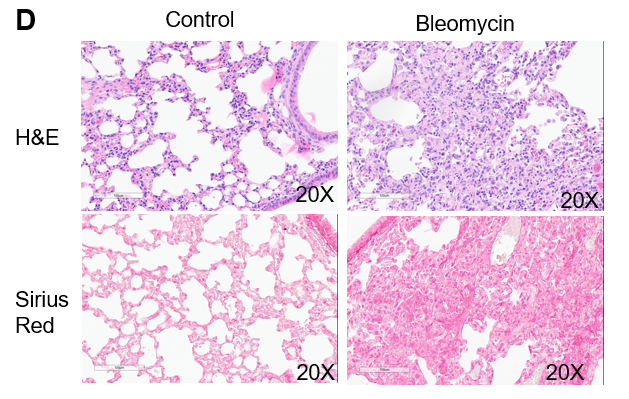
博来霉素诱导的肺纤维化。C57BL/6J 小鼠在第0天给予博来霉素,每天记录体重,实验结束时收集肺组织,测定肺内羟脯氨酸 (HYP)。 (A) 博来霉素导致体重减轻。 (B)存活率缩短。 (C) HYP 含量增加。 (D) 病理学检查显示显著肺纤维化。
Pamrevlumab 在肺纤维化模型(B-hCCN2小鼠)中的药效验证
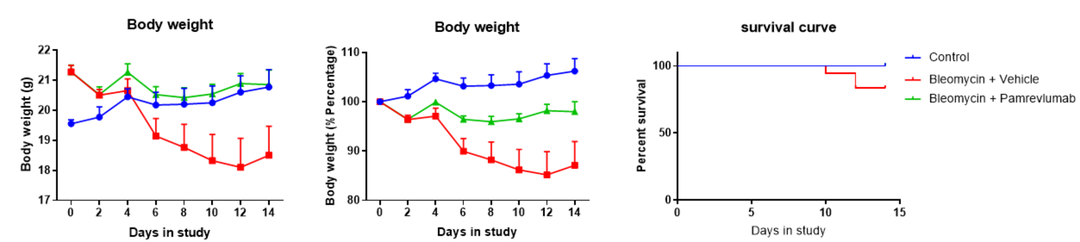
Pamrevlumab 对博来霉素诱导的体重减轻的影响。B-hCCN2 小鼠在第0天给予博来霉素,然后每两天注射一次 Pamrevlumab 或溶剂,共7次,每天记录体重。实验结果表明,Pamrevlumab治疗能够改善博来霉素诱导的 B-hCCN2 小鼠体重减轻,并可有效降低博来霉素诱导的死亡率。
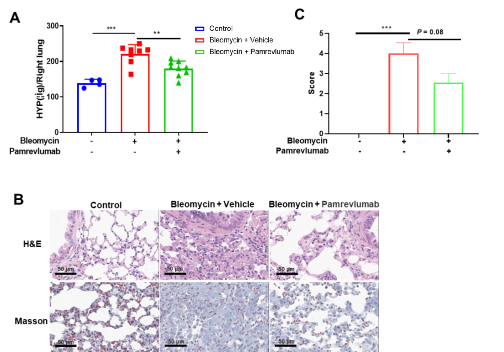
Pamrevlumab 对博来霉素诱导的肺纤维化的影响。 (A) 博来霉素诱导 HYP 含量增加,Pamrevlumab 治疗降低了肺中 HYP 含量。(B) Masson 染色和H&E染色的代表性图像。(C) 条形图显示了纤维化严重程度的定量平均评分。数值为平均值±SEM,n = 4-8,单因素 ANOVA 和 Dunnett 检验,***P < 0.001,**P < 0.01。
Micro-CT在肺部疾病模型的研究应用
博来霉素诱导肺纤维化模型—直方图、体积
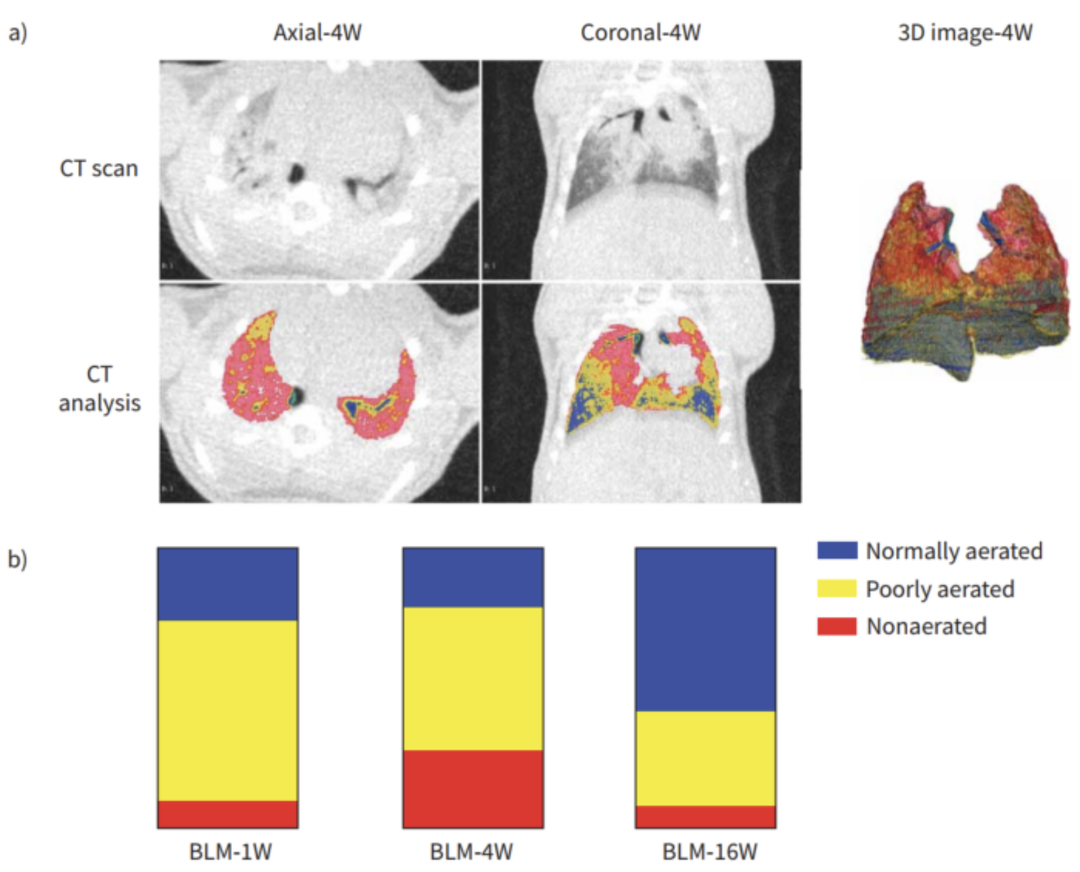
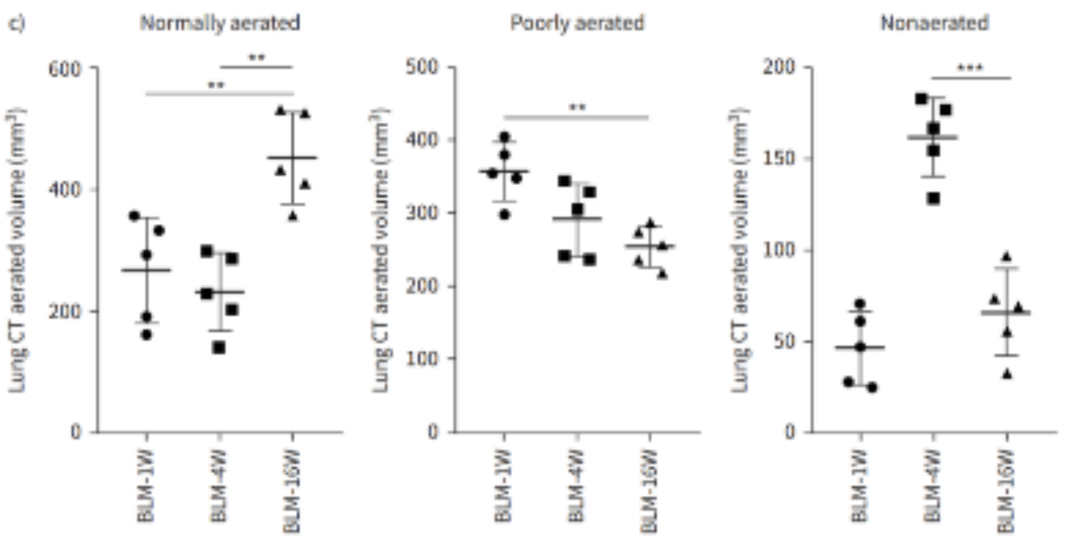
根据不同HU区间进行正常、低通气、不通气区域体积的分割。在第4周,结果显示低通气和不通气区域的比例都很高,然后在第10周和第16周之间明显减少,而在正常通气的区域,则呈现相反的趋势[3]。
通过使用Micro-CT对小鼠肺部区域进行扫描重建成像,利用肺部分析算法(Hounsfield单位阈值范围分别为-434至-121HU和-120至121HU)实现对通气不良和非通气不良区域的影像区分,从而实现对肺部区域动态检测,并进行功能和结构的评价。量化的影像数据也能提供纵向研究的信息以减少动物之间的变异性,可以更进一步验证体外数据。
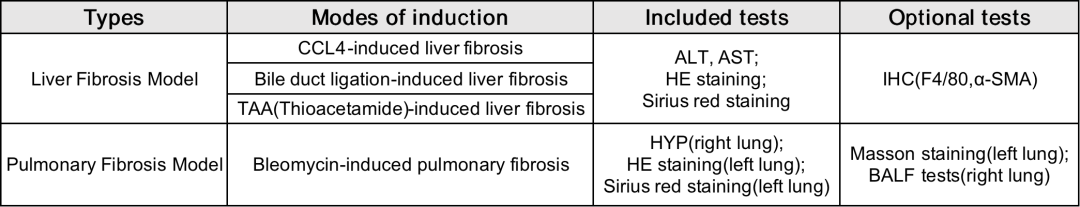
百奥动物可以提供的模型及检测指标
令人期待的未来突破
勃林格殷格翰作为肺纤维化治疗领域的全球市场领导者,在这个存在高度未满足医疗需求的领域成功而大胆迈出的第一步是前文所说的尼达尼布(BI BF1120),而今年2月BI 1015550也已经被美国食品药品监督管理局(FDA)授予突破性治疗认定。勃林格殷格翰未来将启动一项III期临床试验,以进一步研究BI 1015550治疗IPF和进行性肺纤维化(PPF)患者的疗效,并希望能尽快让该药物惠及全球患者[4]。
Pliant Therapeutics,Inc.是一家临床阶段的生物制药公司,致力于发现和开发用于治疗纤维化的新型疗法。今年7月,Pliant Therapeutics 也公布了其INTEGRIS-IPF IIa期试验积极结果,其药品PLN-74809在患有特发性肺纤维化(IPF)患者身上达到主要与次要终点,呈现剂量相关疗效,并具有良好的耐受性。
2021年2月,北京泰德制药与美国Graviton Bioscience Corporation 签订治疗纤维化创新药TDI01海外授权合作协议,首付款及研发、销售里程碑付款最高可达 5.175亿美元。
近年来,随着企业临床及各方面的不断推进、纤维化的细胞和分子机制不断被阐明,且新冠疫情后人们对于抗纤维化重视加深,叠加肿瘤赛道的逐渐拥挤,抗纤维化治疗领域被开发的价值不断体现。我们也期待早日拥有更多创新药物用于改善病患生活质量。
参考来源:
[1] https://mp.weixin.qq.com/s/L8QVMXsh_8-Kk1-iKbeQVA
[2] Nie X , Qian L , Sun R , et al. Multi-organ proteomic landscape of COVID-19 autopsies - ScienceDirect[J]. Cell, 2021.
[3] Song Shengren,Fu Zhenli,Guan Ruijuan et al. Intracellular hydroxyproline imprinting following resolution of bleomycin-induced pulmonary fibrosis.[J] .Eur Respir J, 2022.
[4] https://mp.weixin.qq.com/s/EwbXZN77rPwapjFYdRexVQ






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号