转化生长因子β(TGFβ)是一种多功能的细胞因子,对细胞增殖、分化、粘附、迁移和凋亡具有多重功能。多种类型细胞均可分泌,最早从人血小板中鉴定。哺乳动物中表达三种类型TGFβ:TGFβ1、TGFβ2和TGFβ3,每种由不同的基因编码,并通过结合相同的TGFβ受体发挥相应功能。其中TGFβ2和TGFβ3在胚胎发育中发挥重要作用,而TGFβ1则主要参与控制出生后的免疫反应[1]。
三种TGFβ起初均表达为非活性蛋白复合物(SLC或LLC)。TGFβ1同型二聚体与潜伏相关肽(Latent Associated Peptide, LAP)(TGFβ1 N 端具有的长 20~30 个氨基酸的序列)形成的复合被称为小潜复合物 (Small Latent Complex, SLC)。在细胞外,SLC 与 潜伏TGFβ1结合蛋白(Latent TGFβ Binding Protein, LTBP)结合形成的复杂复合物被称为大潜复合物(Large Latent Complex, LLC)。
TGFβ的活化有以下3种途径:1)SLC在胞外被蛋白酶水解;2)LLC被细胞外基质铆钉,进而由αβ整合素介导释放有活性的TGFβ;3)SLC被细胞表面的GARP铆钉,并由αβ整合素介导释放有活性的TGFβ。
接下来,具有活性的TGFβ与TGFβRII二聚体结合,随后进一步与TGFβRI二聚体结合,形成四聚体,激活下游信号通路,调节基因表达。
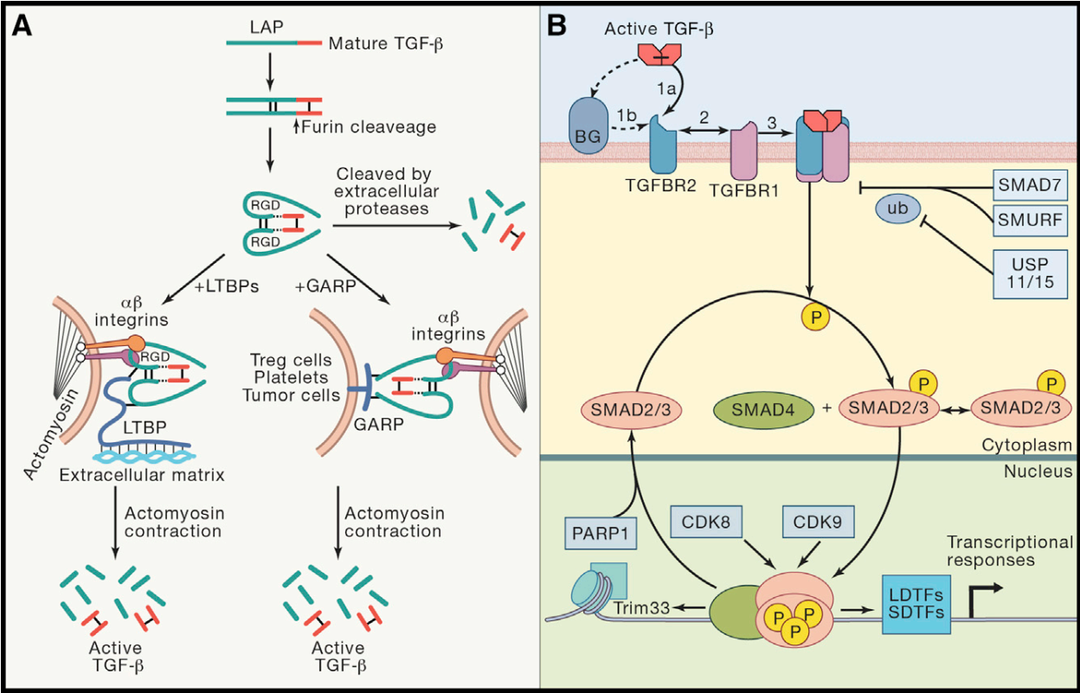
图1. TGFβ信号通路[2,3]
稳态条件下,TGFβ1信号不仅调节多种组织细胞的生长、增殖和分化;也指导免疫系统的耐受和炎症抑制,尤其在胃肠道起重要作用。TGFβ1调节功能的多样性赋予了它在肿瘤发生和发展中亦正亦邪的双面性。在癌症发生早期,TGFβ是一个抑癌因子,可发挥细胞周期阻滞作用,阻断细胞从G1期进入S期,达到抑制肿瘤细胞增殖的作用。然而,随着炎症加剧,一些癌细胞可能会发生突变,使其对TGFβ信号通路不响应,或响应与凋亡脱钩、反变为促进癌细胞转移和定植。同时,肿瘤细胞亦可大量分泌TGFβ1发挥免疫抑制功能,抑制T、B淋巴细胞与NK细胞活化和分化,造成机体免疫功能障碍,使得肿瘤细胞免疫逃逸(图2)。
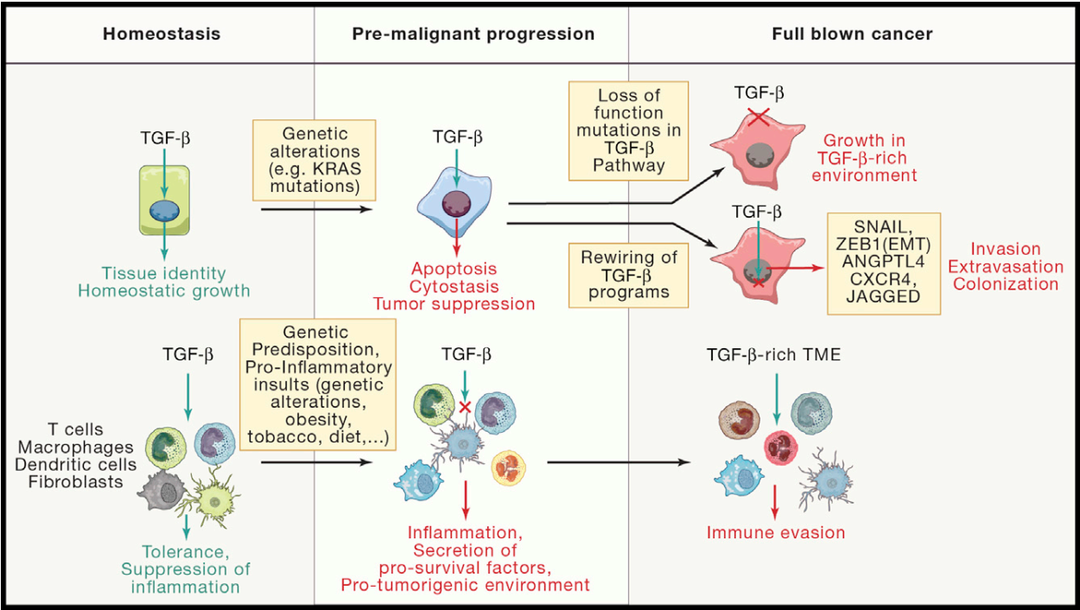
图2. TGFβ的抑癌和促癌信号[2]
针对TGFβ信号通路的在研药物主要包括配体抗体、配体陷阱(如bintrafusp alfa)、受配体抗体、小分子激酶抑制剂等,主要聚焦于肿瘤免疫疗法[4]。目前,处于临床阶段的TGFβ1配体抗体药物如下表所示:
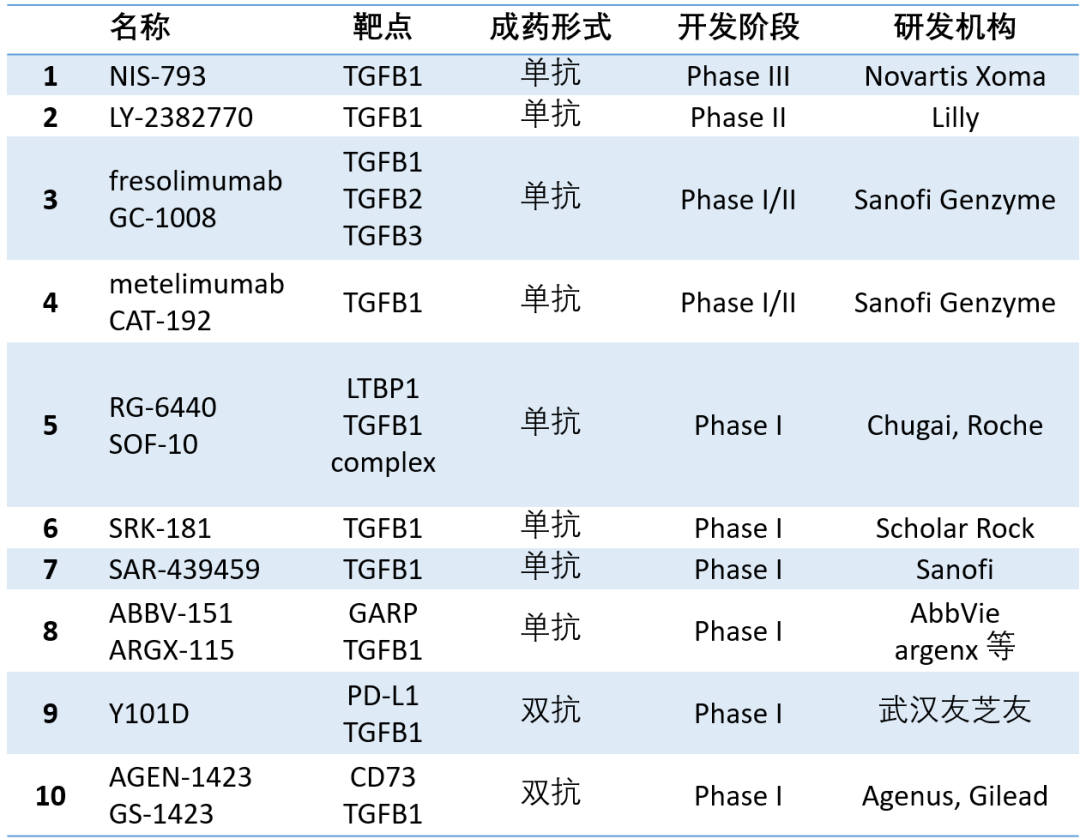
数据整理自Cortellis数据库
为了更好的助力靶向TGFβ1的新药研发,百奥动物自主研发了TGFβ1人源化小鼠B-hTGFB1 mice,用于靶向TGFβ1药物的临床前药效评估。
B-hTGFB1 mice
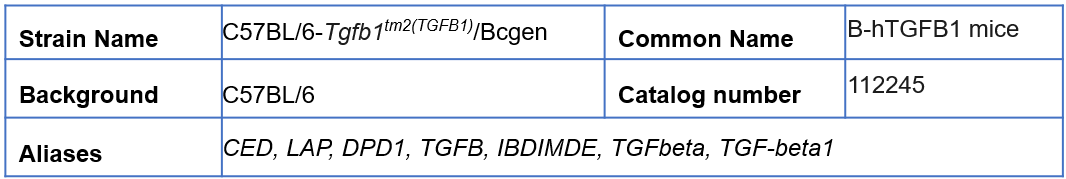
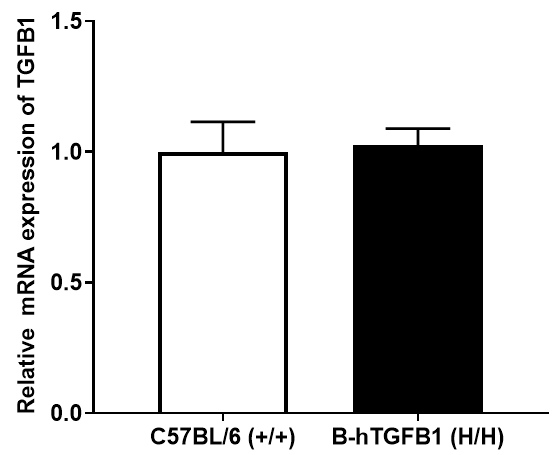
图3. RT-qPCR分析B-hTGFB1小鼠和野生型小鼠的TGFB1 mRNA的表达。B-hTGFB1小鼠中人TGFB1 mRNA表达量与野生型小鼠中的鼠TGFB1 mRNA表达量类似。这表明人TGFB1基因原位替换不影响TGFB1 mRNA的表达。
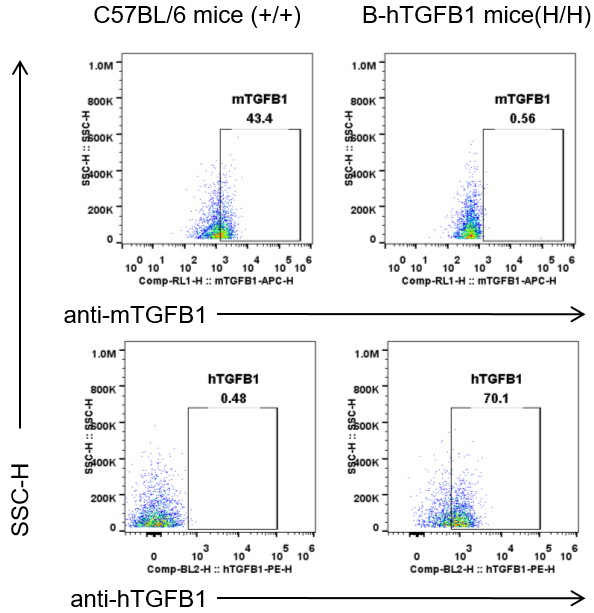
图4. 利用流式细胞仪分析纯合B-hTGFB1小鼠和野生型小鼠的血小板中TGFB1蛋白的种属特异性表达。小鼠的TGFB1仅在野生型小鼠中被检测到,人TGFB1仅在纯合B-hTGFB1小鼠中检测到。脾脏中TGFB1蛋白的表达同样也具有种属特异性(数据未展示)。
TGFB1人源化不影响脾脏、淋巴结、血液中白细胞各亚群比例(数据未展示)。
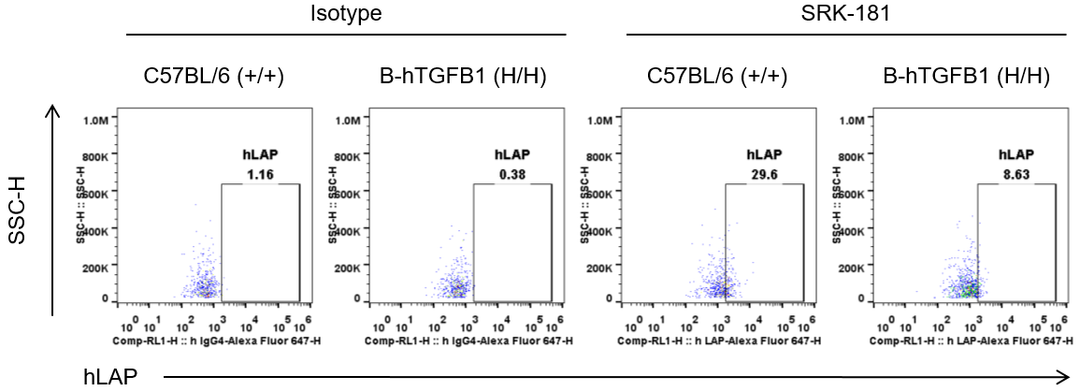
图5. 抗体结合实验。从B-hTGFB1小鼠和野生型小鼠取血,用流式细胞术分析血小板人LAP的表达。SRK-181可特异性结合SLC并抑制TGFβ1活化[5]。于是,在SRK-181处理过的纯合B-hTGFB1小鼠和野生型小鼠中均能检测到人LAP的表达;而未处理的鼠中不能检测到人LAP的表达。(hLAP抗体可人鼠交叉识别。)
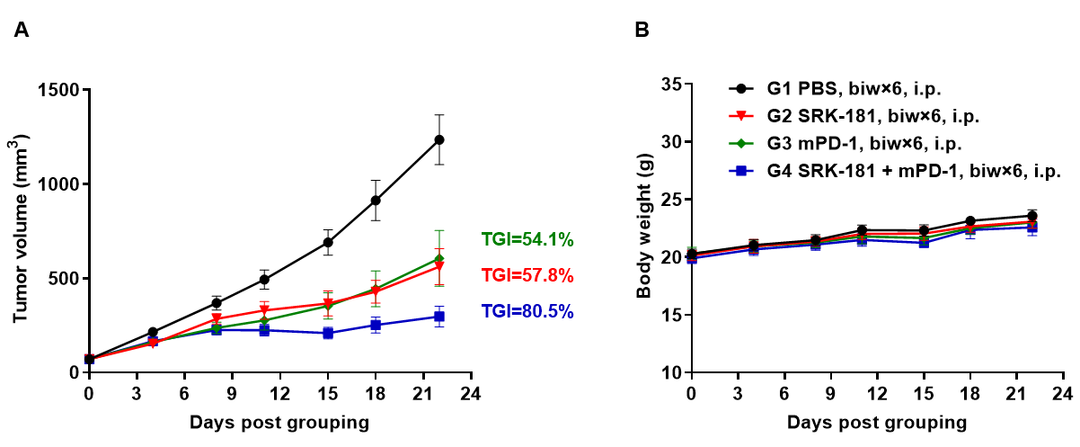
图6. 抗鼠PD-1抗体和抗人TGFβ1抗体联用在B-hTGFB1小鼠中的抗肿瘤作用。(A)mPD-1和hTGFβ1抗体(自制)联用可抑制B-hTGFB1小鼠中MC38肿瘤的生长;(B)治疗期间的体重改变。数值为平均值±SEM。由图可见,抗鼠PD-1抗体和抗人TGFβ1抗体联用可有效控制B-hTGFB1小鼠中的肿瘤生长,说明B-hTGFB1小鼠是TGFβ1抗体药物临床前评估的有力模型。
相关产品列表
参考资料
1. Stockis, J., Dedobbeleer, O. & Lucas, S. Role of GARP in the activation of latent TGF-β1. Molecular bioSystems 13, 1925-1935 (2017).
2. Batlle, Eduard, and Joan Massagué. “Transforming Growth Factor-β Signaling in Immunity and Cancer.” Immunity vol. 50,4 (2019): 924-940. doi:10.1016/j.immuni.2019.03.024
3. Kelly, Aoife et al. “Regulation of Innate and Adaptive Immunity by TGFβ.” Advances in immunology vol. 134 (2017): 137-233. doi:10.1016/bs.ai.2017.01.001
4. Kim, Byung-Gyu et al. “Novel therapies emerging in oncology to target the TGF-β pathway.” Journal of hematology & oncology vol. 14,1 55. 6 Apr. 2021, doi:10.1186/s13045-021-01053-x
5. Martin, Constance J et al. “Selective inhibition of TGFβ1 activation overcomes primary resistance to checkpoint blockade therapy by altering tumor immune landscape.” Science translational medicine vol. 12,536 (2020): eaay8456. doi:10.1126/scitranslmed.aay8456






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号