关于靶点TREM1
TREM1(Triggering receptor expressed on myeloid cells-1)是一种在中性粒细胞、单核细胞、巨噬细胞表面表达的髓系细胞表面受体,在多种肿瘤微环境中均表达,协同经典的模式识别受体(PRR),例如Toll-like受体(TLR)家族和Nod-like受体(NLR)家族,在宿主防御中放大由微生物成分介导的炎症反应。
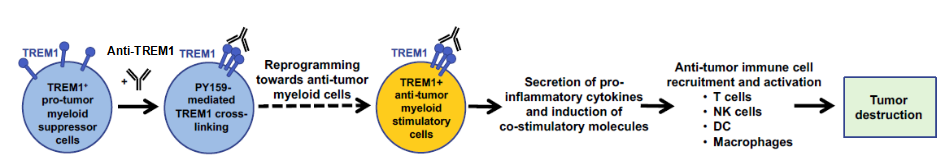
TREM1作用机制[1]
通过抗TREM1抗体将肿瘤相关髓系细胞群上的细胞表面TREM1交联,可引起下游信号传导,从而诱导一组特定的促炎细胞因子和趋化因子的分泌,并增加HLA-DR和CD40的表面表达。
另外,TREM1作为炎症反应的放大器,暗示其具备抗肿瘤作用。但是,TREM1激活可能激活全身免疫,可考虑特异性靶向肿瘤微环境。这些免疫介质可以招募包括T细胞、NK细胞、DC和巨噬细胞在内的免疫细胞,并促进抗肿瘤免疫细胞的激活。
关于靶点TREM2
TREM2(Triggering receptor expressed on myeloid cells-2)是免疫球蛋白超家族的跨膜受体,通过与配体DAP12结合从而传递细胞内信号。DAP12也被称为TYRO蛋白酪氨酸激酶结合蛋白(TYROBP),是参与先天免疫应答的细胞中表达的信号传导衔接蛋白,介导脾酪氨酸激酶SYK的激活。TREM2还可以结合DAP10,而DAP10通过招募磷脂酰肌醇3-激酶(PI3K)促进信号传导。
有研究表明,可能形成TREM2-DAP12/DAP10异源二聚体,下游信号的传递非常依赖于这样的组合。TREM2 可以被解离素和金属蛋白酶结构域蛋白 10(ADAM10)和 γ-分泌酶从细胞表面切割,从而释放可溶性TREM2 (sTREM2)。
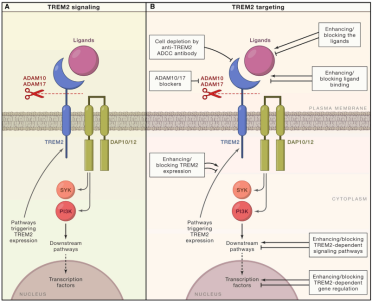
TREM2蛋白结构及信号通路[2]
(A) 当TREM2与其一个配体相互作用时,信号通过衔接蛋白DAP10和DAP12传播,分别激活PI3K或Syk。ADAM10/17通过切割茎部区域的TREM2形成sTREM2并停止TREM2信号级联。
(B) 靶向TREM2和信号级联不同阶段的可能治疗途径。
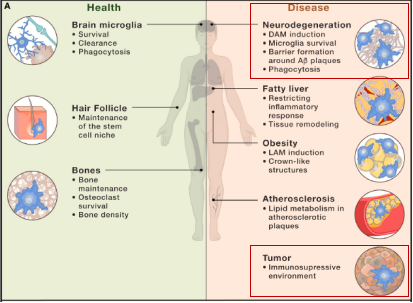
TREM2在特定组织中的生理学和病理学作用[2]
在生理学上,TREM2的活性仅限于特定的组织部位:如在大脑、骨骼和毛囊干细胞部位;在这些部位中,TREM2在组织维持中的作用得到了实验证实。此外,TREM2在各种病理学中成为重要的组织损伤信号中枢:比如在AD(Alzheimer's disease, 阿尔茨海默病)和其他可能的神经退行性病变、代谢综合征相关肥胖、脂肪肝和动脉粥样硬化以及肿瘤中。在这些不同的疾病中,TREM2信号的激活会导致病理特异性结果。
TREM2是一种髓样受体,它在阿尔茨海默症(AD)中传递维持小胶质细胞反应的细胞内信号。此外,对肿瘤微环境的scRNA序列研究表明,TREM2在多个髓样细胞亚群中表达,总之,越来越多的证据表明TREM2在促进肿瘤免疫抑制微环境中起着重要作用。
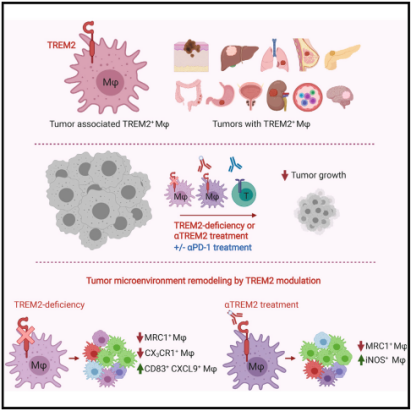
TREM2介导的肿瘤微环境模型[3]
最新的研究发现TREM2–/–小鼠比野生型小鼠对各种癌症的生长有更强的抵抗力,并且对抗PD-1免疫疗法的反应更灵敏。此外,与抗PD-1联合应用时,抗TREM2单抗抑制肿瘤生长并促进肿瘤消退。
scRNA序列显示,TREM2缺失和抗TREM2均与肿瘤浸润中缺乏MRC1+和CX3CR1+巨噬细胞有关,同时,表达免疫刺激分子的髓细胞亚群的扩张可促进T细胞反应的改善。在超过200例人类癌症病例中,TREM2在肿瘤巨噬细胞中表达,并与两种癌症的延长生存期呈负相关。因此,TREM可能是靶向治疗肿瘤骨髓浸润和增强检查点免疫治疗的理想靶标。
药物研究进展
TREM家族作为一类新型的靶点,全球范围内披露的研发管线不多,目前TREM1靶点针对癌症的临床前药物比较活跃的是nangibotide(处于临床II/III期)及PY-159(处于临床I期)。另外TREM1的抑制剂(GF-9)也有临床前抑制肿瘤的报导,但机制有待深入确实。
TREM2靶点针对肿瘤和阿尔兹海默症的临床前药物比较活跃的是AL-002(处于临床II期)及PY-314(处于临床I期),另外TREM2靶点在肥胖、脂肪肝、动脉粥状硬化和中风等疾病病理中都有着重要作用,是多种疾病非常有希望的潜在药物靶点。
表1. 关于TREM部分药物研究进展
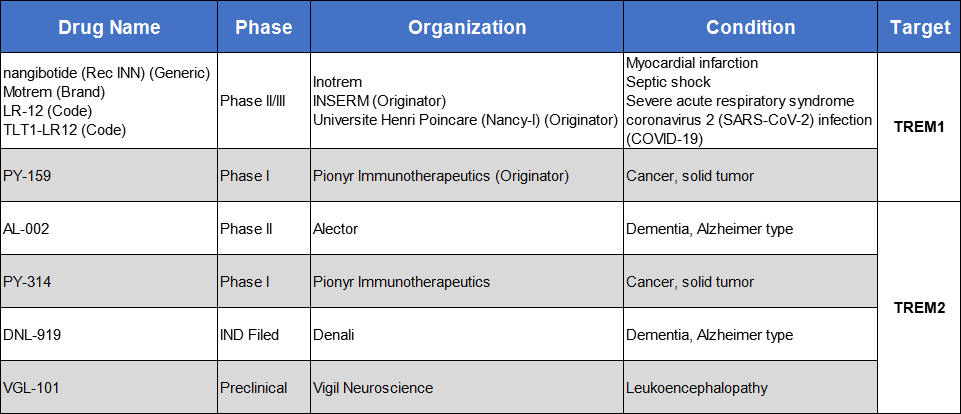
数据来源科睿唯安
随着各大药企对TREM家族的深入研究,相信市场前景会更加广阔。BioMice百奥动物自主研发的B-hTREM1 mice、B-hTREM2 mice助力TREM家族靶向药物开发,为临床前药效评估提供了优质模型。
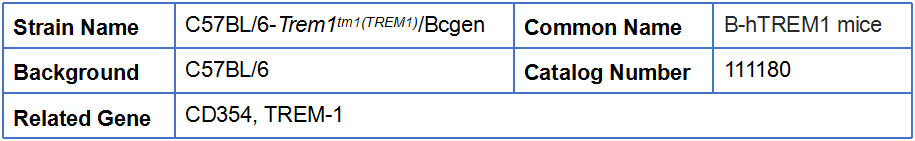
B-hTREM1 mice
基本信息
蛋白表达分析
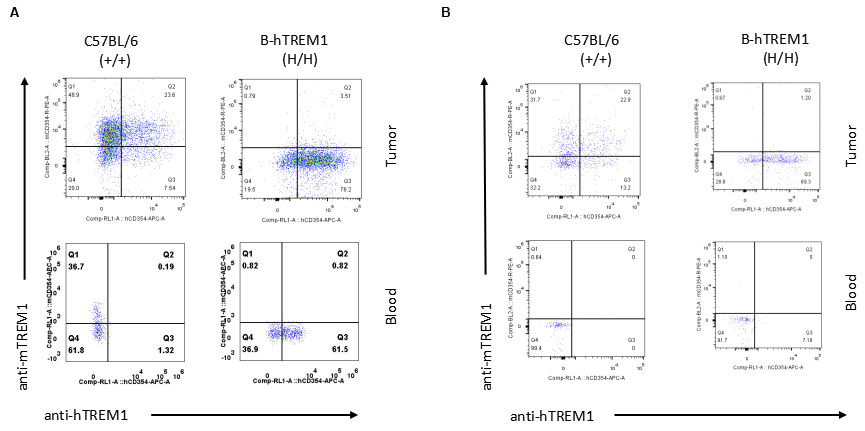

通过流式细胞术对纯合B-hTREM1小鼠进行种属特异性TREM1表达分析。将MC38细胞接种到野生型C57BL/6(+/+)和纯合B-hTREM1小鼠(H/H)中。当肿瘤体积达到约500 mm3时,采集血液和肿瘤,并通过种属特异性抗TREM1抗体的流式细胞术进行分析。
图A,巨噬细胞
结果显示:在野生型小鼠的血液和肿瘤巨噬细胞中检测到鼠TREM1,人TREM1仅在纯合B-hTREM1小鼠的血液和肿瘤巨噬细胞中可检测到。
*目前尚不清楚在C57BL/6(Q2)肿瘤中用特异性抗hTREM1染色的细胞群。
图B,单核细胞(M-MDSC)
结果显示:在野生型小鼠和纯合B-hTREM1小鼠的血单核细胞中未检测到鼠TREM1和人TREM1。人TREM1仅在纯合B-hTREM1小鼠的肿瘤单核细胞中可检测到。
*目前尚不清楚在C57BL/6(Q2)肿瘤中用特异性抗hTREM1染色的细胞群。
图C,中性粒细胞(G-MDSC)
结果显示:在野生型小鼠的血液和肿瘤中性粒细胞中检测到鼠TREM1,人TREM1仅在纯合B-hTREM1小鼠的血液和肿瘤中性粒细胞中可检测到。
图D,T细胞
结果显示:在野生型小鼠和纯合B-hTREM1小鼠的血液和肿瘤T细胞中未检测到小鼠和人TREM1。
图E,B细胞
结果显示:在野生型小鼠和纯合B-hTREM1小鼠的血液和肿瘤B细胞中未检测到小鼠和人TREM1。
脾脏白细胞亚群分析

用流式细胞术分析从雌性C57BL/6和B-hTREM1小鼠(n= 3,6周龄)中分离的脾细胞以评估白细胞亚群。A.具有代表性的FACS图。B. FACS分析结果。纯合B-hTREM1小鼠的T细胞、B细胞、NK细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分比与C57BL/6小鼠相似,表明TREM1人源化不会改变这些细胞类型在脾脏的整体发育、分化或分布。
脾脏T细胞亚群分析
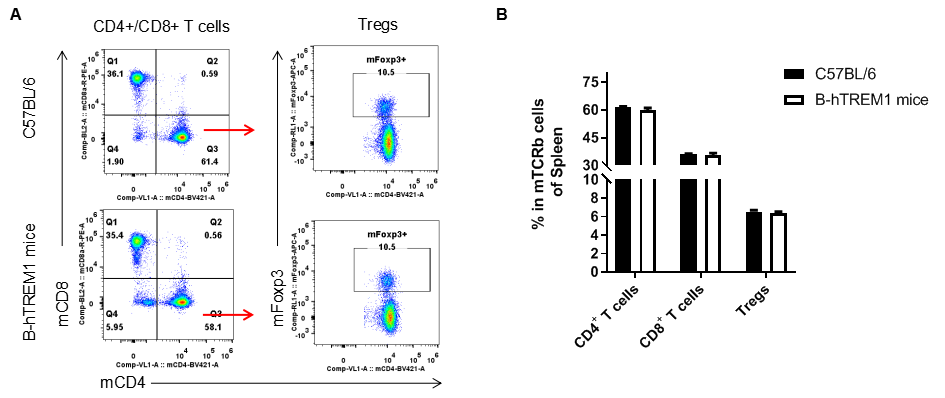
利用流式细胞术分析纯合B-hTREM1小鼠和野生型小鼠脾脏中T细胞亚群(如图),结果显示纯合B-hTREM1小鼠与野生型小鼠中各T细胞亚群的百分比相似,表明人源化TREM1不会改变T细胞亚群在脾脏中的整体发育、分化或分布。
淋巴结白细胞亚群分析

利用流式细胞术分析纯合B-hTREM1小鼠和野生型小鼠淋巴结中白细胞亚群(如图),结果显示纯合B-hTREM1小鼠的白细胞亚群百分比与野生型小鼠相似,表明人源化TREM1不会改变白细胞亚群在淋巴结中的整体发育、分化或分布。
淋巴结T细胞亚群分析
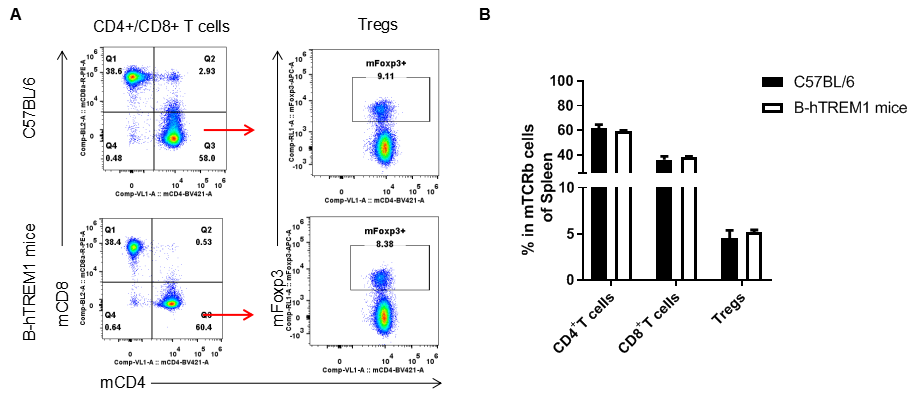
利用流式细胞术分析纯合B-hTREM1小鼠和野生型小鼠淋巴结中T细胞亚群(如图),结果显示纯合B-hTREM1小鼠与野生型小鼠中各T细胞亚群的百分比相似,表明人源化TREM1不会改变T细胞亚群在淋巴结中的整体发育、分化或分布。
血液白细胞亚群分析
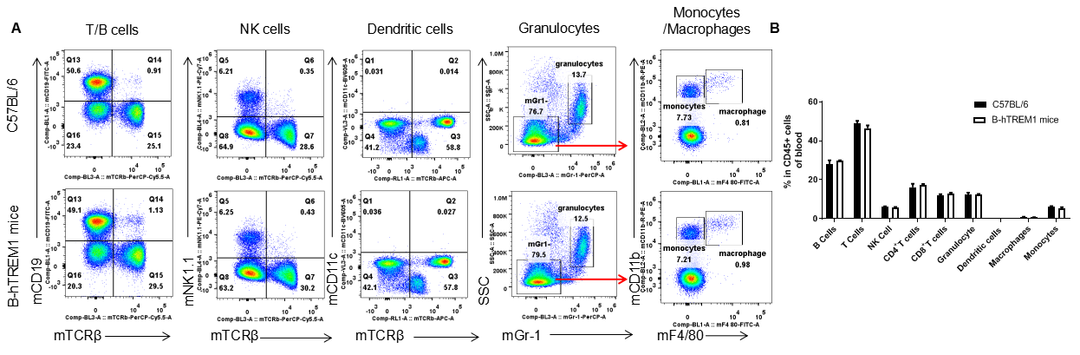
利用流式细胞术分析纯合B-hTREM1小鼠和野生型小鼠血液中白细胞亚群(如图),结果显示纯合B-hTREM1小鼠的白细胞亚群百分比与野生型小鼠相似,表明人源化TREM1不会改变白细胞亚群在血液中的整体发育、分化或分布。
血液T细胞亚群分析

利用流式细胞术分析纯合B-hTREM1小鼠和野生型小鼠血液中T细胞亚群(如图),结果显示纯合B-hTREM1小鼠与野生型小鼠中各T细胞亚群的百分比相似,表明人源化TREM1不会改变T细胞亚群在血液中的整体发育、分化或分布。
肿瘤生长曲线和体重变化
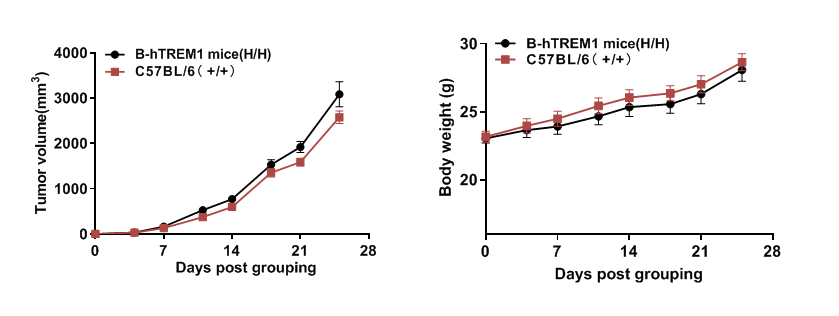
B-hTREM1小鼠中MC38肿瘤细胞皮下移植生长。将小鼠结肠癌MC38细胞皮下植入野生型C57BL/6小鼠和B-hTREM1小鼠(雄性,8周龄,n=6)。每周测量两次肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(平均值±SEM)。如图A所示,MC38细胞能够在B-hTREM1小鼠中建立肿瘤,并可用于有效性研究。
B-hTREM2 mice
基本信息

蛋白表达分析
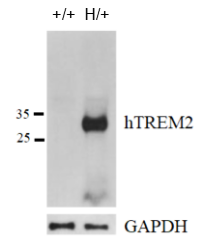
通过western blot分析杂合B-hTREM2小鼠中种属特异性TREM2的表达。收集野生型小鼠(+/+)和杂合B-hTREM2小鼠(H/+)的脑组织,用种属特异性抗hTREM2抗体进行western blot分析。在野生型小鼠中未检测到小鼠TREM2,人TREM2仅在杂合B-hTREM2小鼠中可检测到。
参考文献
[1] Juric V, Mayes E, Binnewies M, et al P02.11 TREM1 agonist PY159 promotes myeloid cell reprogramming and unleashes anti-tumor immunity Journal for ImmunoTherapy of Cancer 2021;9:doi: 10.1136/jitc-2021-ITOC8.23
[2] Deczkowska A, Weiner A, Amit I. The Physiology, Pathology, and Potential Therapeutic Applications of the TREM2 Signaling Pathway. Cell. 2020;181(6):1207-1217. doi:10.1016/j.cell.2020.05.003
[3] Molgora M, Esaulova E, Vermi W, et al. TREM2 Modulation Remodels the Tumor Myeloid Landscape Enhancing Anti-PD-1 Immunotherapy. Cell. 2020;182(4):886-900.e17.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号