引言
CXC趋化因子受体家族(CXCR1-8),在各类免疫细胞及部分上皮细胞中有广泛表达,同时在肿瘤细胞中也高表达,其广泛地促进了肿瘤血管生成,在肿瘤增殖及转移过程中有重要作用。同时,在其他疾病模型中CXC趋化因子受体家族成员也发挥着重要作用,如CXCR2和CXCR3与动脉粥样硬化、肺纤维化及其他自身免疫疾病有高度相关性[1]。CXCR5除参与肿瘤发展外,也与系统性红斑狼疮、类风湿关节炎等自身免疫疾病密切相关[2]。因此,CXCR家族蛋白是肿瘤治疗及自身免疫性疾病治疗等领域的重要靶点。
CXC趋化因子受体家族属于7次跨膜的G蛋白偶联受体超家族(GPCR),其家族成员均含有七次跨膜结构,包含一个胞外的N端和胞内的C端,并在胞外和胞内分别含有三个LOOP环[3]。
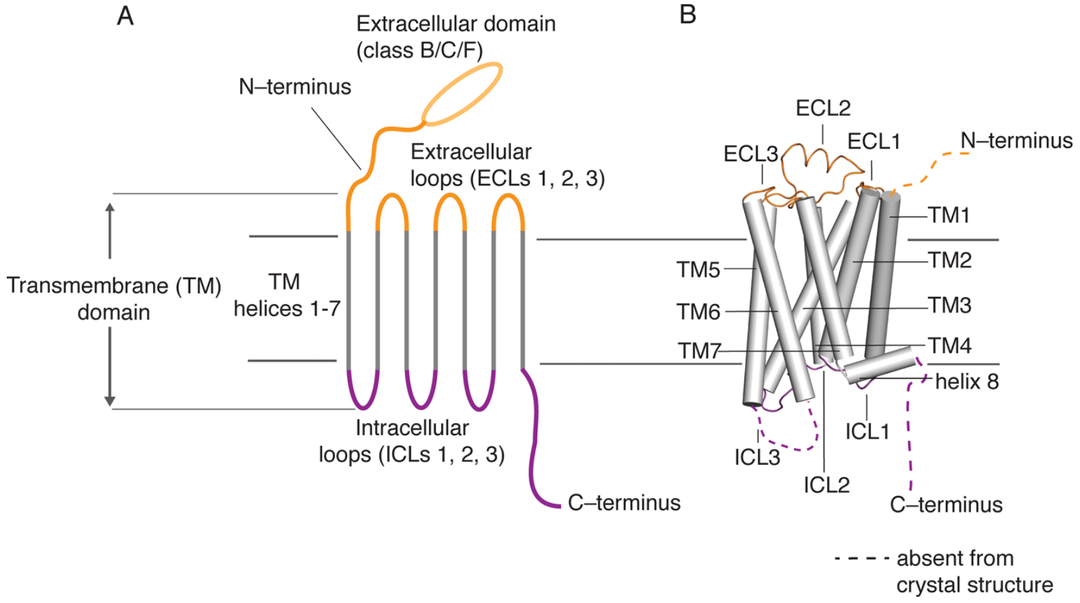
GPCR家族蛋白结构[3]
关于CXCR家族,目前研究热度较高的为CXCR2-7。其中CXCR2主要表达在髓系细胞及内皮细胞中,CXCLs/CXCR2之间的相互作用会诱导淋巴细胞的迁移,血管生成,细胞抗衰老等功能[4],这些作用与肿瘤发育,炎症生成及高血压等疾病相关。靶向抑制CXCR2可抑制CXCR2的促进血管生成,抗衰老等作用,并改善肿瘤微环境,促进T细胞的浸润。
CXCR4在淋系细胞、髓系细胞及少量内皮细胞和上皮细胞中均有表达,肿瘤细胞通过增加CXCR4使肿瘤向高表达CXCL12的淋巴细胞或组织转移:CXCL12/CXCR4促进血管内皮生长因子VEGF的增加,导致肿瘤血管的生成,促进肿瘤细胞增殖[5]。靶向抑制CXCR4主要应用于治疗急性淋巴细胞白血病、多发性骨髓瘤、转移性乳腺癌、转移性胰腺癌等恶性肿瘤。
CXCR5主要表达在成熟的B细胞及滤泡辅助T细胞中,CXCL13/CXCR5信号途径的非正常激活影响肿瘤细胞转移、浸润,同时也与系统性红斑狼疮及类风湿关节炎等自免疾病相关[2]。靶向抑制CXCR5主要应用于治疗转移型肿瘤及自免疾病等。
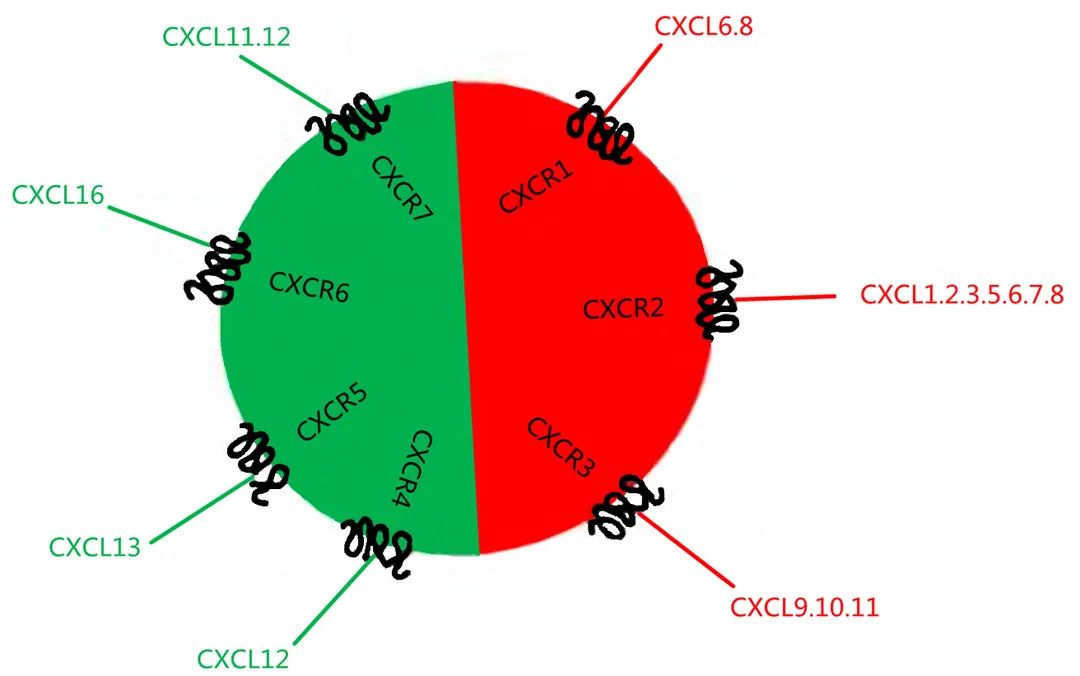
CXCR及其配体[6]
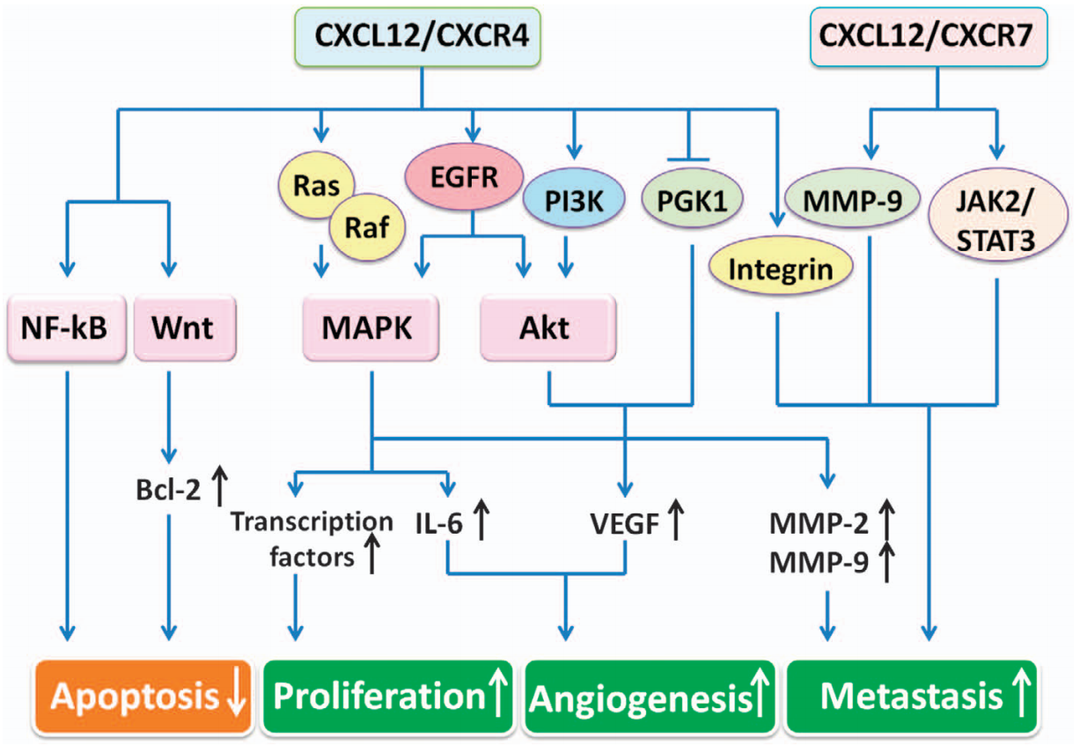
CXCL12/CXCR4/CXCR7信号通路[7]
CXCR家族研究进展
CXCR 家族作为肿瘤治疗及自免疾病的热门靶点,众多公司均有管线布局,其中AnorMED靶向CXCR2/CXCR4的药物已经上市,作为肿瘤及自免疾病的药物。除此之外,Pfizer、Lilly、Merk、GSK、AstraZeneca、BMS、复星医药等公司均有管线产品进入临床阶段,另有44款药物处于临床试验阶段,其适应症同样多为肿瘤、炎症及其他自免疾病领域。热门靶点为CXCR2/3/4/5等。
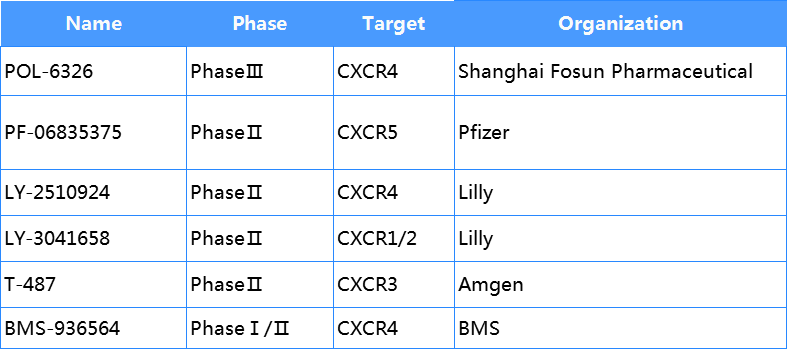
CXCR家族部分管线
数据来源科睿唯安
随着各大药企对CXCR家族的深入研究,相信CXCR家族市场前景会更加广阔。百奥动物自主研发的B-hCXCR2 mice、B-hCXCR4 mice、B-hCXCR5 mice小鼠助力CXCR家族靶向药物开发,为临床前药效评估提供了优质模型。
B-hCXCR2 mice
1、基本信息

2、蛋白表达分析
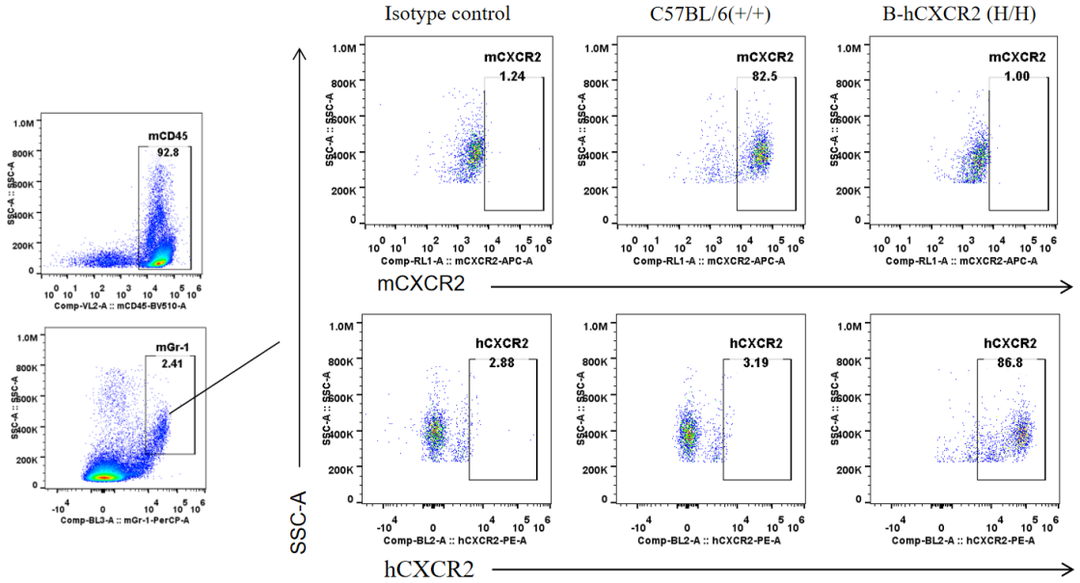
通过流式细胞术对野生型小鼠和纯合B-hCXCR2 小鼠进行品系特异性CXCR2表达分析。采集野生型小鼠和纯合B-hCXCR2小鼠的脾细胞,用CXCR2抗体进行流式细胞术分析。野生型小鼠中检测到鼠CXCR2。人CXCR2只能在纯合子B-hCXCR2中检测到,而不能在野生型小鼠中检测到。
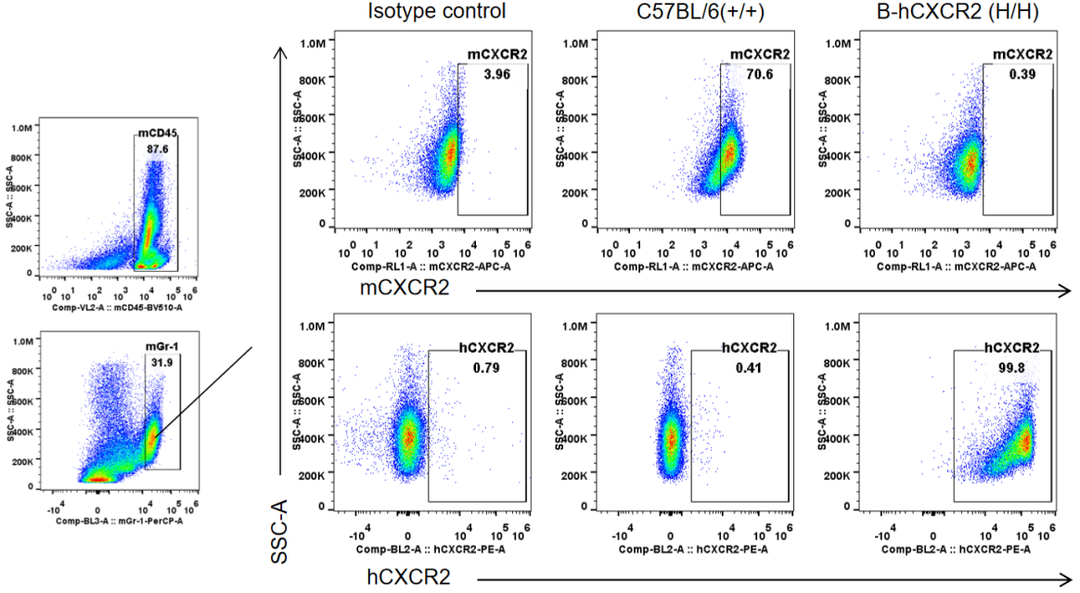
通过流式细胞术对野生型小鼠和纯合B-hCXCR2小鼠进行品系特异性CXCR2表达分析。采集野生型小鼠和纯合B-hCXCR2 小鼠的骨髓细胞,用CXCR2抗体进行流式细胞术分析。野生型小鼠中检测到鼠CXCR2。人CXCR2只能在纯合子B-hCXCR2中检测到,而不能在野生型小鼠中检测到。
B-hCXCR4 mice
1、基本信息

2、蛋白表达分析
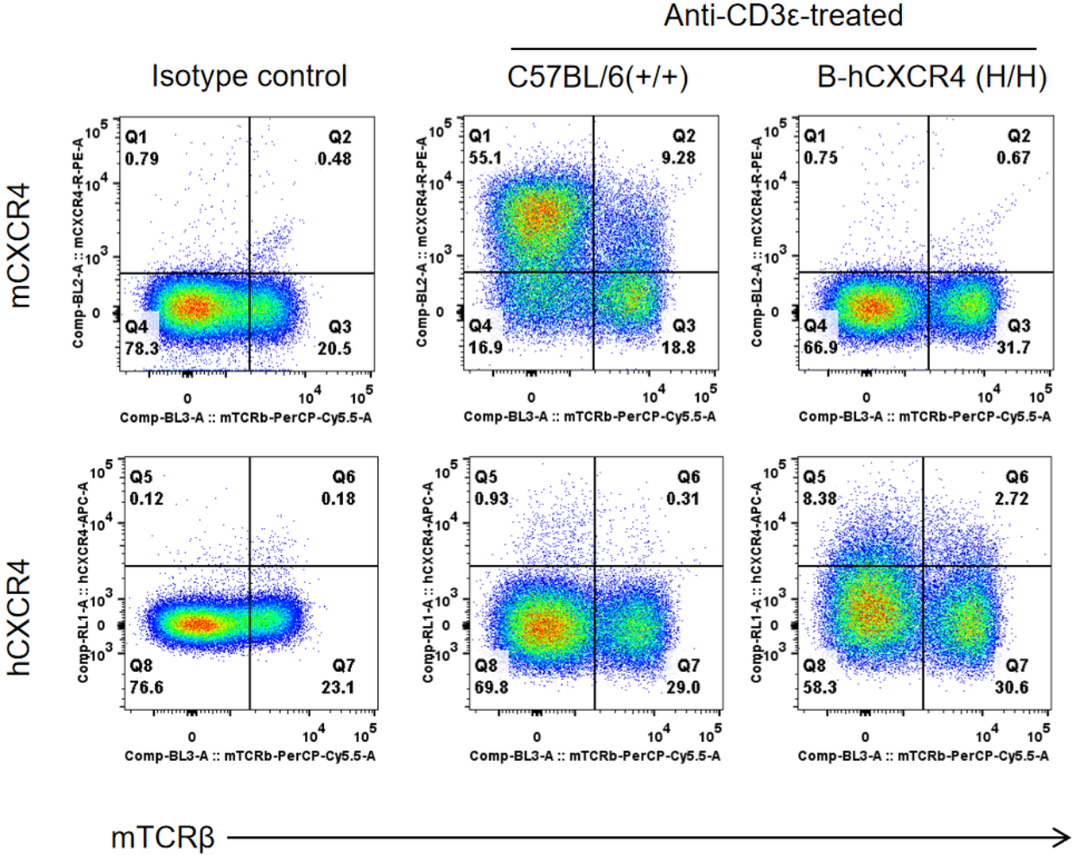
通过流式细胞术对野生型小鼠和纯合子B-hCXCR4小鼠进行品系特异性CXCR4表达分析。野生型小鼠和纯合子B-hCXCR4 (H/H)小鼠在体内使用抗CD3 ε处理后,收集脾细胞,使用CXCR4抗体进行流式细胞术分析。野生型小鼠中检测到鼠CXCR4。人CXCR4仅在纯合子B-hCXCR4中检测到,但表达水平明显低于野生型小鼠中鼠CXCR4。
B-hCXCR5 mice
1、基本信息

2、蛋白表达分析
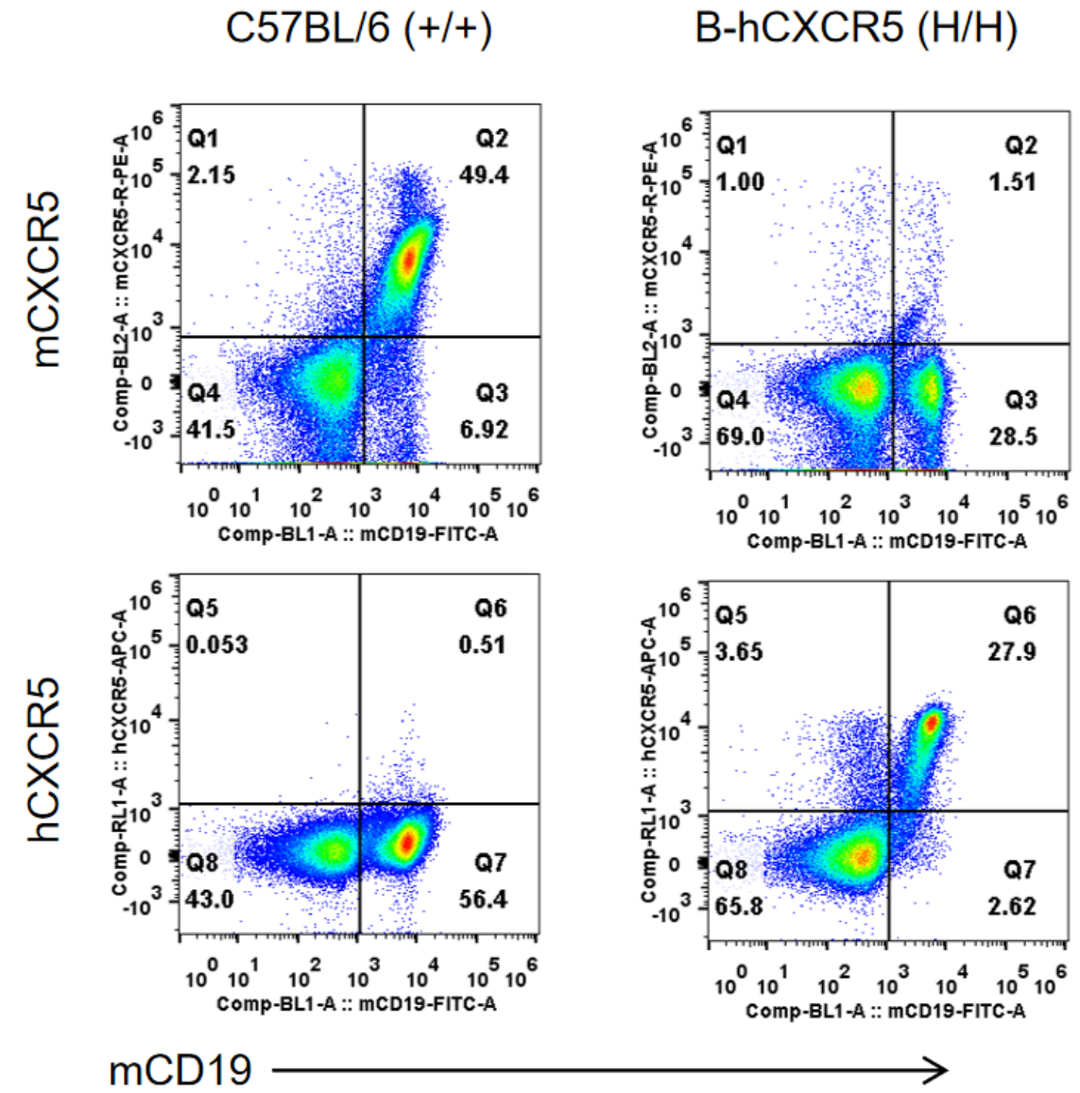
通过流式细胞术对野生型小鼠和纯合子B-hCXCR5小鼠进行品系特异性CXCR4表达分析。采集野生型小鼠和纯合子B-hCXCR5小鼠的脾细胞,用种属特异性抗CXCR5抗体进行流式细胞术分析。小鼠CXCR5仅可在野生型小鼠中检测到,而人CXCR5仅可在纯合子B-hCXCR5小鼠中检测到。
我们也制备了一系列CXCR靶点人源化细胞系,如您想详细了解,欢迎联系我们。
参考文献
[1] Karin N.CXCR3 Ligands in Cancer and Autoimmunity, Chemoattraction of Effector T Cells, and Beyond[J].Front Immunol,2020, 11: 976.
[2] Kazanietz M G, Durando M, Cooke M.CXCL13 and Its Receptor CXCR5 in Cancer: Inflammation, Immune Response, and Beyond[J].Front Endocrinol (Lausanne),2019, 10: 471.
[3] Latorraca N R, Venkatakrishnan A J, Dror R O.GPCR Dynamics: Structures in Motion[J].Chem Rev,2017, 117 (1): 139-155.
[4] Skinner D D, Lane T E.CXCR2 Signaling and Remyelination in Preclinical Models of Demyelination[J].DNA Cell Biol,2020, 39 (1): 3-7.
[5] Teicher BA, Fricker S P.CXCL12 (SDF-1)/CXCR4 pathway in cancer[J].Clin Cancer Res,2010, 16 (11): 2927-31.
[6] Verburg-Van Kemenade BM, Van Der Aa L M, Chadzinska M.Neuroendocrine-immune interaction: regulation of inflammation via G-protein coupled receptors[J].Gen Comp Endocrinol,2013, 188: 94-101.
[7] Guo F, Wang Y, Liu J, et al.CXCL12/CXCR4: a symbiotic bridge linking cancer cells and their stromal neighbors in oncogenic communication networks[J].Oncogene,2016, 35 (7): 816-26.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号