啮齿类动物模型在临床前抗肿瘤药物评价体系中发挥着重要的作用。肿瘤动物模型的建立为研究肿瘤发生与转移的机制、筛选和评价抗肿瘤药物的药效提供了有力的工具。目前使用的啮齿类动物肿瘤模型包括自发性肿瘤模型、诱发性肿瘤模型、基因工程小鼠肿瘤模型以及异种/同种移植的肿瘤模型。其中,移植模型中的皮下(s.c.)移植瘤更易于和更广泛用于临床前研究。
然而,皮下移植瘤并不能充分代表临床癌症,“种子和土壤学说”已经证实了肿瘤原发器官微环境会影响肿瘤细胞的生物学特征[1],不少学者们认为皮下(异位)移植瘤脱离了原发组织的微环境,其发生发展与临床相去甚远,同时该模型对药物反应性差、转移发生率较低、生存曲线数据与临床脱节[2]。尤其是近年来随着免疫肿瘤治疗的出现和免疫相关在研药物数量的井喷式增长,皮下移植瘤模型已经很难满足药物研发的需求。因此与人类疾病具有更强生物学和药理学相关性的一系列原位(o.t.)移植瘤模型应运而生。
原位肿瘤模型与皮下肿瘤模型对比

例如为了更好地研究胆囊癌的治疗,来自中国的科研团队使用细胞系构建了胆囊癌的原位移植模型并与临床及皮下移植瘤模型进行了对比。结果发现原位移植模型与临床胆囊癌的淋巴结转移率分别为69.2%和53.3%;腹水生成率分别为38.5%和11.7%;肝浸润率分别为100%和61.7%;淋巴血管密度分别为10.4%和8.77%,这些均是临床胆囊癌的主要特征,但是在皮下移植模型中未发现腹水生成、淋巴结转移和肝转移的证据,充分地证明原位移植模型可以更好地模拟临床疾病的进展和部分特征[3]。

类似的结果在很多研究结果中都得到了证明,正是这种高度的临床相似性,在近些年的药物研发中,原位移植模型发挥了不可替代的作用,无论是早期阶段的药物筛选还是后期的候选药物药效验证及机制探索,无论是在药物的专利申请还是申报药物的临床前药效数据中,原位移植模型对皮下移植模型的取代都似乎成为了一种不可阻挡的趋势。
在一篇CD47抗体的临床前药效评价文献中,作者就同时使用了皮下和原位两种肝癌模型来评价药效[4],其中原位模型可以更准确模拟体内真实环境,下图为原位肝癌模型药效数据。将皮下成瘤后的HepG2-Luc肿瘤碎片原位接种于NSG小鼠肝脏中,构建原位肝癌模型。待肿瘤生长2周后给予药物干预,并每周对体内的荧光信号进行观察。从荧光信号结果中可以看出CD47抗体给药组相较于IgG给药对照组,可以更明显抑制肝脏肿瘤的生长,并且解剖后的肿瘤体积和重量也说明了同样的结论,因此该原位移植模型可以有效评估CD47抗体药效。
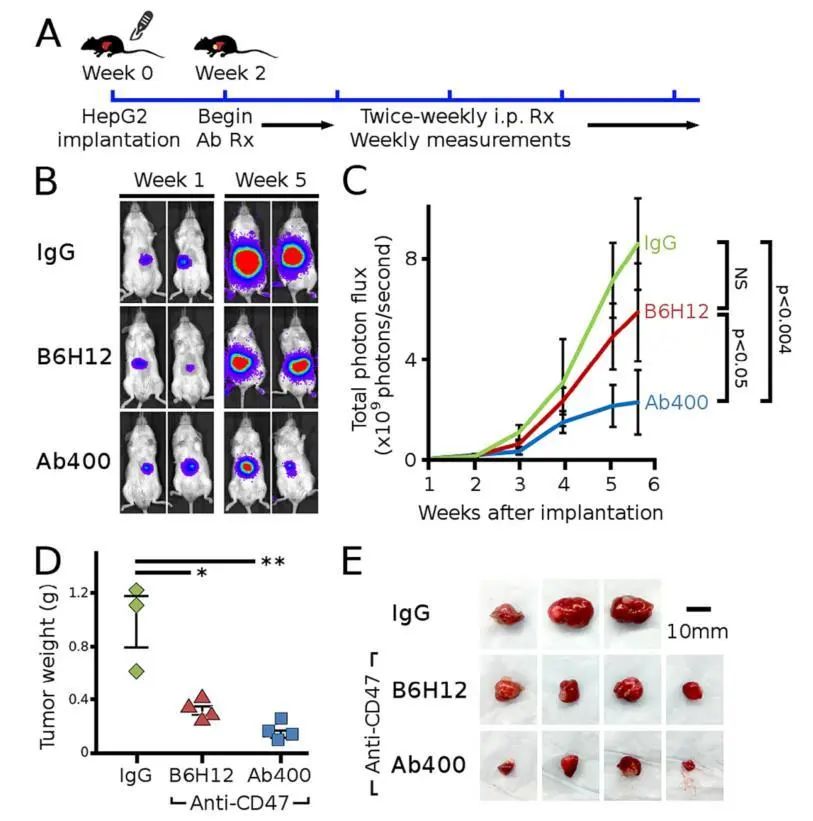
CD47特异性抗体抑制原位肝癌模型中的肿瘤生长[4]
A:HepG2-luc2肿瘤细胞被植入NSG小鼠的肝脏,待其生长2周,然后每周两次腹腔内注射抗体。B:展示第1周和第5周小鼠具有代表性的生物发光图像。C:用CD47抗体Ab400治疗的小鼠肿瘤生物发光值比用IgG抗体治疗的小(p<0.004 IgG vs CD47mAb400)。B6H12组数据趋势低于IgG组,但未达到统计学意义。D:初始肿瘤植入6周后,IgG处理组的小鼠肿瘤显著大于CD47抗体处理组。E:解剖肿瘤展示图。
除此之外,免疫组化的结果显示,巨噬细胞在肿瘤周围空间的密度要高于肿瘤内部,这与临床上肝癌的巨噬细胞分布情况类似,而两种CD47抗体在不同程度上增加了原位肿瘤内部的巨噬细胞密度,解释了抗肿瘤作用的可能机制。
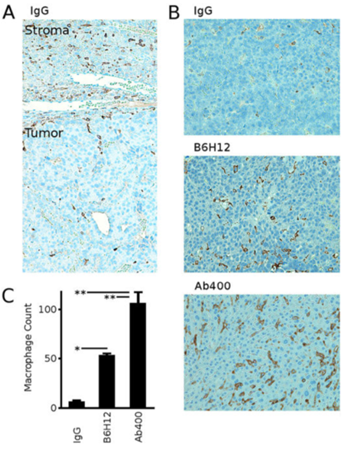
CD47阻断增加HCC肿瘤的巨噬细胞浸润
A:IgG处理小鼠的原位移植HepG2肿瘤的F4/80染色(棕色)显示肿瘤相关巨噬细胞集中在瘤周基质中。B:展示分别用IgG、B6H12和CD47mAb400治疗后小鼠肿瘤的F4/80染色代表性图像。C:用抗CD47抗体治疗的小鼠肿瘤中巨噬细胞计数显著大于IgG组小鼠肿瘤中的数量。
相较于传统的皮下移植肿瘤模型,原位移植肿瘤模型可以使用多种方法对药物药效及疾病进展进行评估,包括小鼠的临床症状、生存期、肿瘤体积(仅限乳腺癌原位模型)以及使用活体发光成像技术对荧光素酶标记的肿瘤细胞进行跟踪,可以实现对肿瘤细胞生长、肿瘤细胞分布和转移的实时跟踪。目前累计超过100篇相关文献中报道了10多种原位模型的构建及使用,这些独特的原位移植模型已被用于创新药物发现和机制研究,并作为连接临床前和临床研究与药物开发的桥梁[5]。
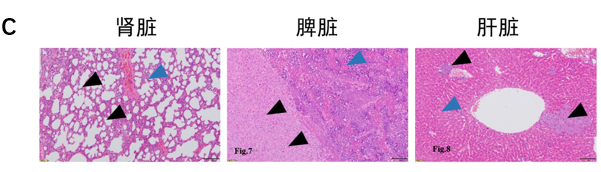
黑色箭头表示肿瘤组织,蓝色箭头表示正常组织
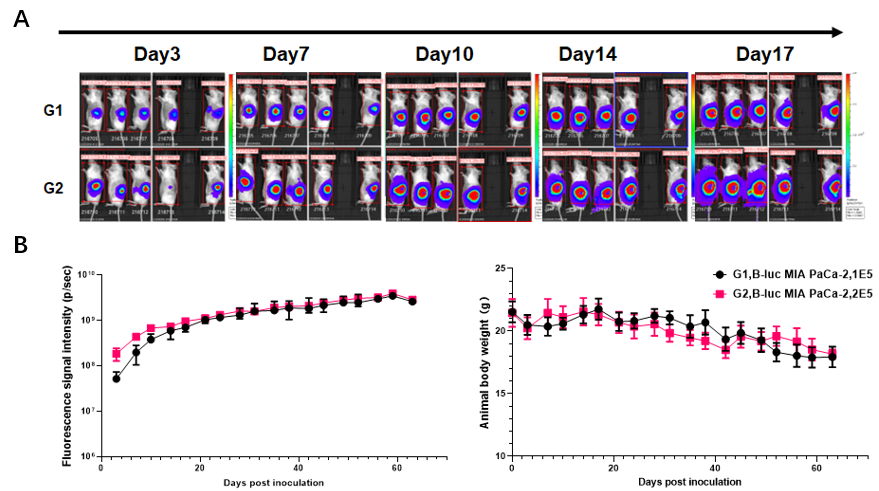
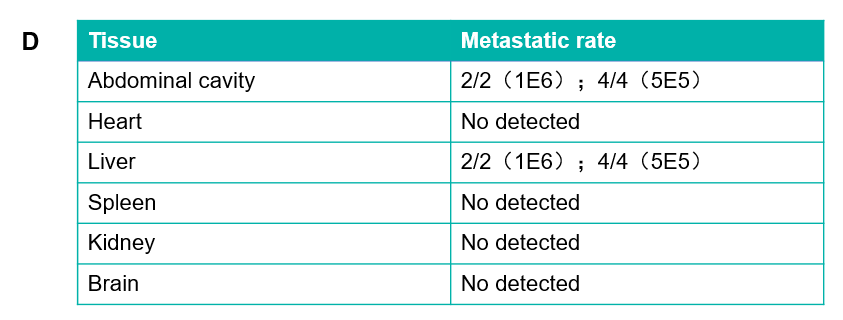
根据这些文献,百奥赛图不断尝试摸索,通过细胞悬液或者瘤块注射的方式成功构建并验证了多个原位肿瘤模型。例如图例所示的B-luc MIA Paca-2胰腺癌原位模型建立。每只小鼠在胰腺部位接种体积不超过40μL的细胞悬液,每周对小鼠体内的体重及肿瘤荧光信号进行成像记录。结果显示荧光信号随肿瘤的生长逐渐增加,小鼠体重随着时间推移有所降低。实验终点对小鼠的大体解剖证实了肿瘤生长部位的正确,而HE染色结果表明肿瘤在肾脏和肝脏等部位发生了转移,表明该细胞系原位移植瘤模型的构建成功。

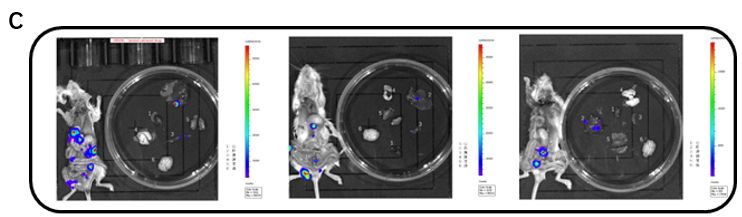
上面展示的是成功建立的B-luc RKO结肠癌原位模型。通过小动物活体成像仪器对生物发光信号的监测,可以看到小鼠体内肿瘤的不断生长,且随着肿瘤的生长小鼠体重逐渐降低。我们还展示了几张典型的实验终点小鼠解剖成像图,可以看到在剥离去除肿瘤所在组织后观察到明显的荧光信号,意味着发生了肿瘤的转移,经过病理结果的确认,我们得出结论,在该结肠癌原位模型中一定会发生肿瘤向肝脏的转移。
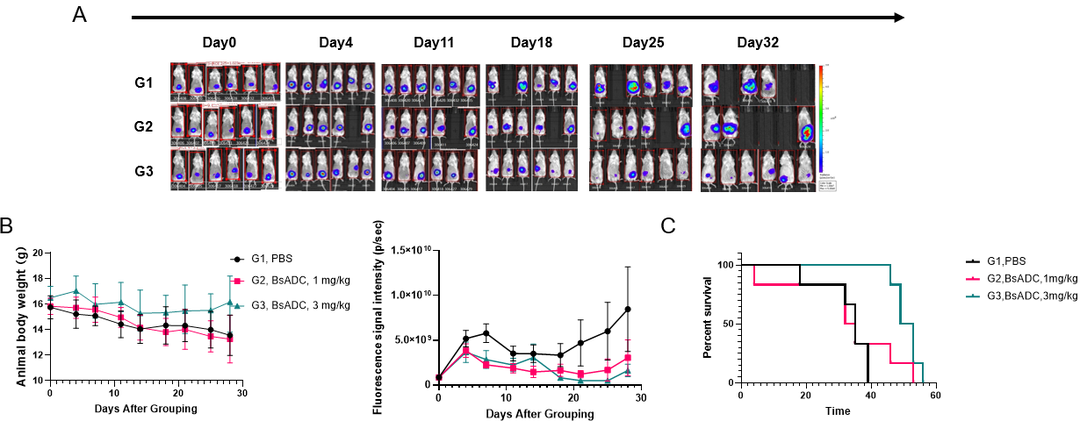
在模型建立成功后,我们尝试利用该RKO结肠癌原位模型进行药效评价。在肿瘤接种的第三天我们根据成像值随机分为PBS组和双抗ADC的两个剂量组。从结果中可以看到,该双抗ADC可以显著抑制RKO原位肿瘤的生长,延长小鼠生存期,且在3 mg/kg剂量下尤为明显。证明该模型可以很好地用来进行临床前药效评价。
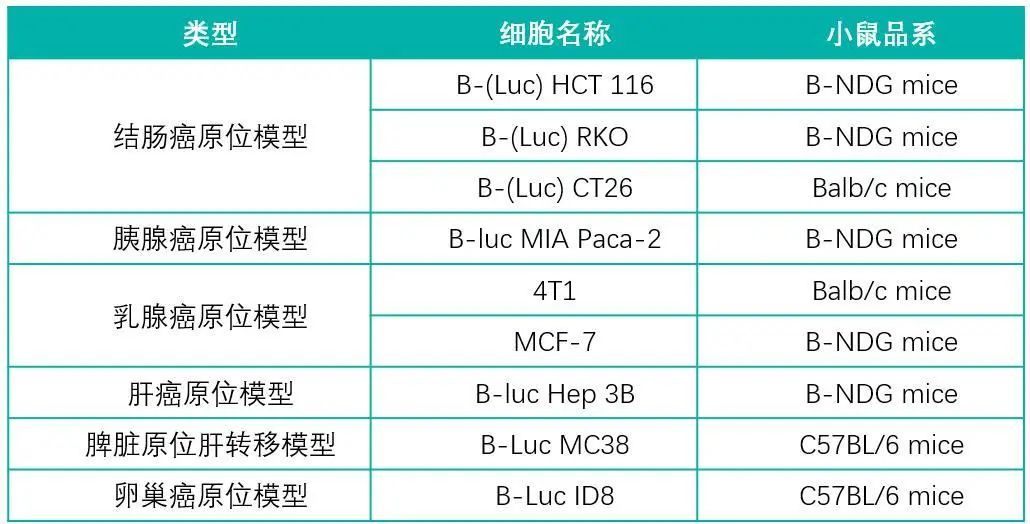
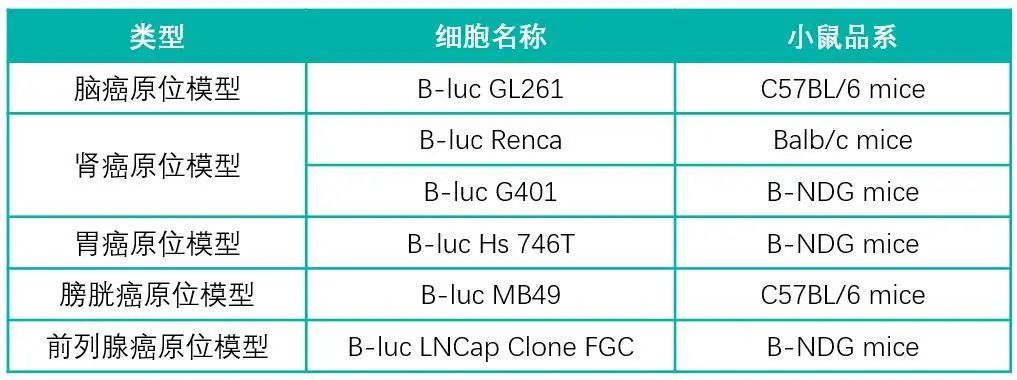
下面展示了百奥赛图建立成功并且可以对外服务的原位模型列表以及正在开发的模型列表。每一个模型的建立都会经过从细胞系的改造及筛选到原位成瘤技术的摸索与验证再到药效的评估一个完整的流程,除此之外,我们还会对同种模型进行TILs检测,以比对不同癌种皮下瘤与原位瘤免疫浸润情况的差异。每一种原位模型都能够实现几乎百分百的接种成功率,更好地满足不同种类药物药效评价的需求。
百奥赛图原位模型
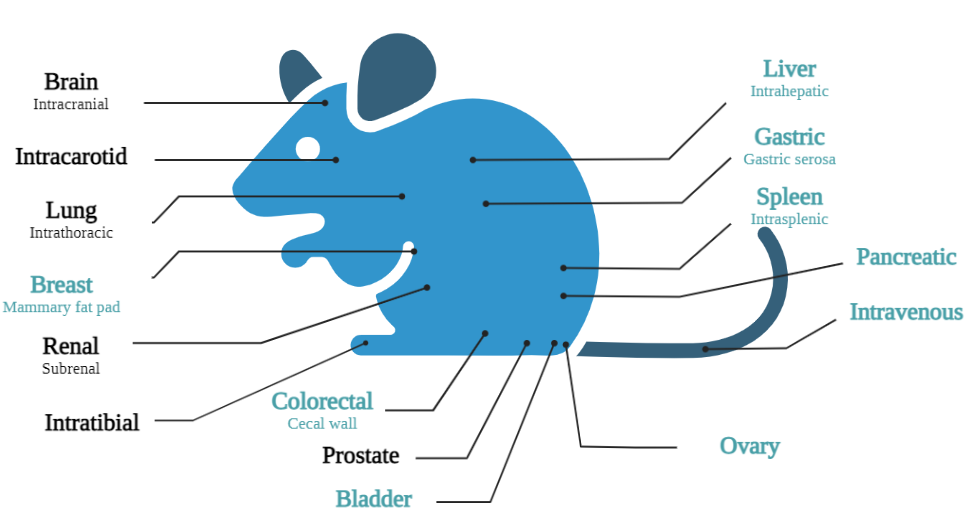
蓝色表示技术成熟,黑色表示正在开发阶段
可提供服务的原位移植模型
开发中的原位移植模型
参考文献:
1. Wilmanns C. Orthotopic and ectopic organ environments differentially influence the sensitivity of murine colon carcinoma cells to doxorubicin and 5-fluorouracil〔J〕. Int J Cancer,1992, 52( 1) : 98-104.
2. Shibuya K, Komaki R, Shintani T, et al. Targeted therapy against VEGFR and EGFR with ZD6474 enhances the therapeutic ef cacy of irradiation in an orthotopic model of human non-small-cell lung cancer〔J〕. Int J Radiat Oncol Biol Phys, 2007, 69( 5) : 1534-1543.
3. Du Q, Jiang L, Wang XQ, Pan W, She FF, Chen YL. Establishment of and comparison between orthotopic xenograft and subcutaneous xenograft models of gallbladder carcinoma. Asian Pac J Cancer Prev. 2014;15(8):3747-52. doi: 10.7314/apjcp.2014.15.8.3747. PMID: 24870787.
4. Xiao Z, Chung H, Banan B, Manning PT, Ott KC, Lin S, Capoccia BJ, Subramanian V, Hiebsch RR, Upadhya GA, Mohanakumar T, Frazier WA, Lin Y, Chapman WC. Antibody mediated therapy targeting CD47 inhibits tumor progression of hepatocellular carcinoma. Cancer Lett. 2015 May 1;360(2):302-9. doi: 10.1016/j.canlet.2015.02.036. Epub 2015 Feb 23. PMID: 25721088; PMCID: PMC4886734.
5. Hoffman RM. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 1999;17(4):343-59. doi: 10.1023/a:1006326203858. PMID: 10759402.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号