骨质疏松症是一种与年龄相关的,慢性全身性代谢性疾病,它主要以骨量减少、骨微结构破坏和骨脆性增加为特征。由于其发病率和死亡率的提高,该病已经成为全球性的公共健康问题。
百奥动物自主研发的B-hRSPO1 、B-hSOST 、B-hRANKL 小鼠,是优质的骨质疏松疾病模型,推进骨质疏松创新药物研发进程。
B-hRSPO1小鼠
基本信息

基因功能介绍
Rspo1(R-spondin 1),又称CRISTIN3,该基因编码一种分泌蛋白,该蛋白由两个富含半胱氨酸残基的类呋喃结构域和一个I型血小板反应蛋白(thrombospondin)结构域组织。Rspo1是经典Wnt信号通路的激活剂,与LGR 4-6(leucine-rich repeat-containing G-protein coupled receptors)结合,并能够激活Wnt信号通路。在骨中,Rspo1与Wnt3a协和增强经典Wnt信号通路以及成骨标志物水平,如碱性磷酸酶活性和骨钙素表达。还能够通过调节成骨细胞的OPG表达来抑制破骨细胞生成。因此,Rspo1被认为是治疗病理和衰老相关骨丢失、炎性骨损伤的潜在治疗靶点。
人纤维化肝脏组织中Rspo1过度表达,此外,Rspo1激活能够促进卵巢肿瘤的发生发展,表明Rspo1可能也是纤维化及卵巢癌肿瘤的治疗靶点。
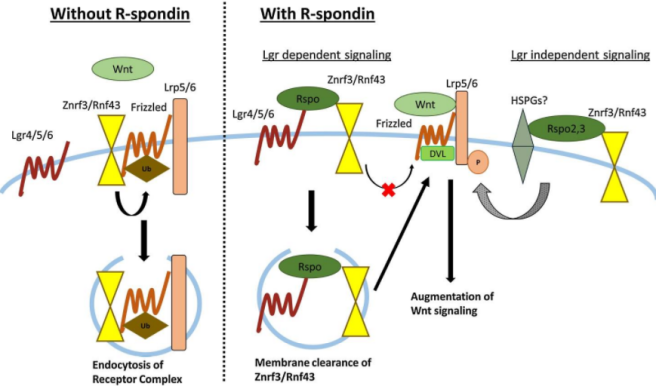
Rspo1介导的Wnt信号通路激活[1]
当Rspo1缺陷时,Frizzled被Znrf3/Rnf43泛素化后被受体复合物内吞,Wnt信号的激活被抑制。Rspo1与其受体Lgr4/5/6结合,该复合物与Znrf3/Rnf43结合,并抑制Frizzled泛素化的发生,从而激活Wnt下游信号。此外,有文章指出,同家族成员Rspo2/3激活Wnt信号通路不依赖于Lgr。
mRNA表达检测
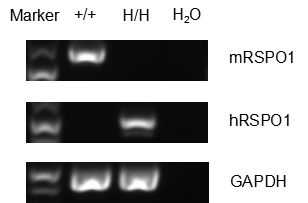
RT-PCR检测野生型C57BL/6和B-hRSPO1纯和鼠中RSPO1 mRNA表达
仅在野生型C57BL/6小鼠肾脏组织中检测到Rspo1 mRNA表达,仅在B-hRSPO1纯和鼠肾脏组织中检测到人RSPO1 mRNA表达。
蛋白表达检测
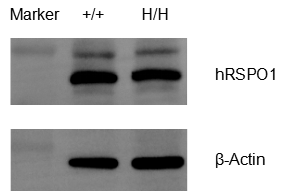
Western blot检测野生型C57BL/6和B-hRSPO1纯和鼠中RSPO1蛋白表达
使用人鼠交叉抗体,在野生型C57BL/6和B-hRSPO1纯和鼠肝脏组织中均检测到RSPO1蛋白表达。
B-hSOST小鼠
基本信息

基因功能介绍
SOST, 又称sclerostin,是由骨细胞分泌的一种糖蛋白,对骨的形成起负性调节作用。成骨细胞主要维持骨的形成,经典的Wnt信号通路对成骨细胞的增殖起到了重要作用。SOST与LRP5及LRP6辅助性受体结合, 抑制卷曲蛋白及Wnt信号与上述受体结合, 从而降低骨的形成。针对SOST,安进的AMG-785(Romosozumab)已经在2019年获批上市,三期临床头对头实验证实其药效好于特立帕肽,礼来的药还在2期,国内恒瑞开发进入一期临床,赛诺菲和诺华的项目还在临床前阶段。
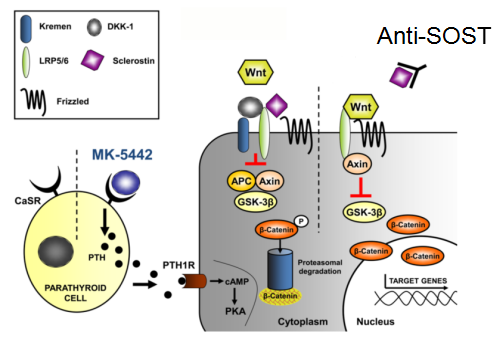
SOST抗体信号通路[2]
使用anti-SOST中和SOST后,Wnt能够与LPR5/6结合,导致GSK-3β降解以及β-catenin的积累和入核,从而上调与成骨相关疾病的表达。
mRNA表达检测

RT-PCR检测野生型C57BL/6和B-hSOST纯和鼠中SOST mRNA表达
仅在野生型C57BL/6小鼠心脏和睾丸组织中检测到Sost mRNA表达,仅在B-hSOST纯和鼠心脏和睾丸组织中检测到人SOST mRNA表达。
蛋白表达检测
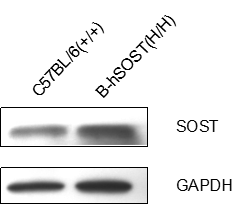
Western blot检测野生型C57BL/6和B-hSOST纯和鼠中SOST蛋白表达
使用人鼠交叉抗体,在野生型C57BL/6和B-hSOST纯和鼠心脏组织中均检测到SOST蛋白表达。
B-hRANKL 小鼠
基本信息

基因功能介绍
RANKL,TNF细胞因子家族成员,是骨保护素的配体,是破骨细胞分化和活化的关键因子。该蛋白被证明是一种树突状细胞存活因子,并参与T细胞依赖性免疫应答的调节。据报道,T细胞活化可诱导该基因的表达,并导致破骨细胞生成和骨丢失的增加。该蛋白通过一个涉及SRC激酶和肿瘤坏死因子受体相关因子(TRAF) 6的信号复合物激活抗凋亡激酶AKT/PKB,这表明该蛋白可能参与了细胞凋亡的调控。在小鼠中靶向破坏相关基因会导致严重的骨质疏松和破骨细胞的缺乏。缺陷小鼠表现出T和B淋巴细胞早期分化的缺陷,在妊娠期间未能形成乳腺小叶肺泡结构。
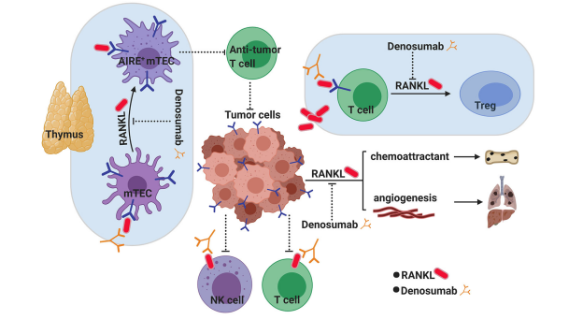
RANK/RANKL信号通路[3]
长期以来,已知RANK/RANKL信号转导能通过促进血管生成和转移的方式支持肿瘤的发生,而RANKL靶点的抑制剂Denosumab能抑制RANKL的功能,从而抑制肿瘤。所以,阻断RANKL有望成为癌症免疫治疗的新途径,可能与已知的免疫检查点抑制剂在抗癌中具有互补和协同效应,但这种抗癌的机制还不是很清楚。
在胸腺中,RANK/RANKL通路对于CD80+ AIRE+ 髓质胸腺上皮细胞(mTEC)的成熟和中枢耐受至关重要,肿瘤微环境(TME)中活化的T细胞和NK细胞表面表达RANKL,可与RANK+的肿瘤细胞相互作用,诱导这些浸润细胞的免疫抑制。另外,肿瘤微环境(TME)中肿瘤来源的RANKL也被认为能将浸润的RANK + 的T细胞转化为免疫调节性T细胞(Tregs)。通过Denosumab阻断RANK/RANKL通路,从而暂时阻断中枢耐受,可能会使抗肿瘤抗原的T细胞数量增加,减少Tregs,克服免疫抑制,发挥抗肿瘤的药效。
蛋白表达分析
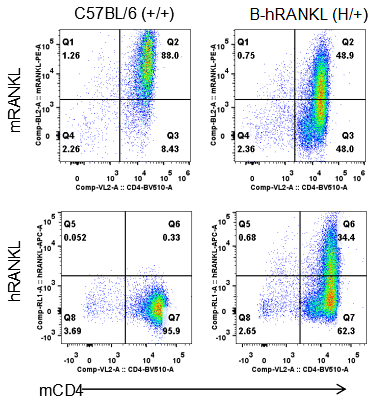
流式细胞术分析杂合B-hRANKL小鼠中种属特异性RANKL的表达
从野生型C57BL/6小鼠(+/+)和杂合B-hRANKL小鼠(H/+)中分离脾细胞。鼠源RANKL在野生型C57BL/6小鼠和杂合B-hRANKL小鼠中均可检测到,人源RANKL只在杂合B-hRANKL小鼠中检测到。
本期骨质疏松小鼠疾病模型合集到此就结束啦,大家可以点击“阅读原文”获取更多小鼠信息。欢迎各位业界同仁联系我们开启战略合作,共同推进创新药物研发进展。
参考文献
[1]Nagano, K. R-spondin signaling as a pivotal regulator of tissue development and homeostasis. The Japanese dental science review 55, 80-87, doi:10.1016/j.jdsr.2019.03.001 (2019).
[2]Modified from Rachner, T. D., Khosla, S. & Hofbauer, L. C. Osteoporosis: now and the future. Lancet (London, England) 377, 1276-1287, doi:10.1016/s0140-6736(10)62349-5 (2011).
[3]Ming, J., Cronin, S.J.F. & Penninger, J.M. Targeting the RANKL/RANK/OPG Axis for Cancer Therapy. Front Oncol 10, 1283 (2020).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号