在现代医学的帮助下,许多不孕小鼠通过体外受精技术在胚胎实验室中完成了它们梦寐以求的生育之旅。
让我们一起来揭开小鼠卵子的体外发育之旅:从排卵开始,一直到移植到母体中,它们在胚胎实验室的全过程!
排卵
超数排卵处理
选择适龄的雌鼠(避开6周龄)进行激素注射,第一次注射FSH(注射剂量根据批次不同进行调整),间隔72h后,第二次注射HCG(7.5IU/只)。
排卵前,在促排卵素HCG作用下卵丘细胞间形成大量细胞外基质,主要包括透明质酸及其各种结合蛋白,这些成分的显著增加使OCC迅速膨胀,从而引发排卵反应[1]。
注射完HCG后15~17h内,雌鼠排卵完成,且在输卵管膨大部中形成卵母细胞团,此时即可进行取卵工作。
液滴准备
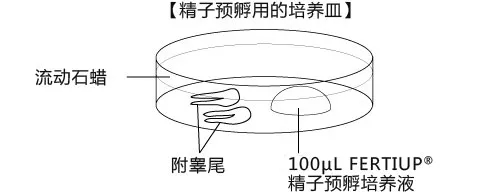
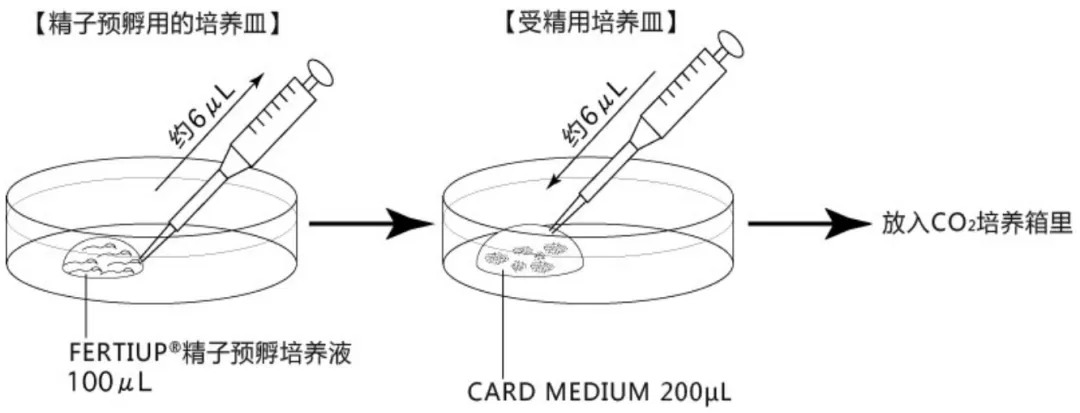
按下图步骤[2],完成相应培养皿的制作,并静置在CO2培养箱中进行预平衡(使培养液中氧气和二氧化碳的含量接近胚胎在体内发育时的液体环境)。
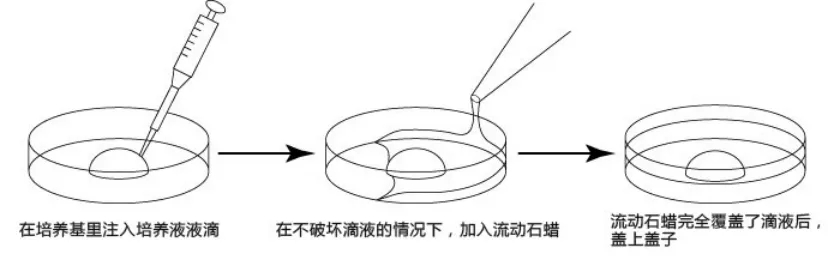
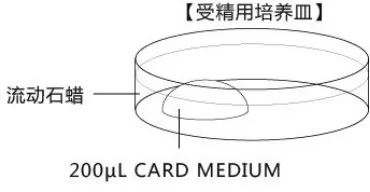
受精培养皿的制作
在采集卵母细胞前30min完成制作,并于CO2培养箱平衡至少30min,也可过夜培养。注意培养液滴的大小与卵母细胞的数量的比较接近100μL:100枚。
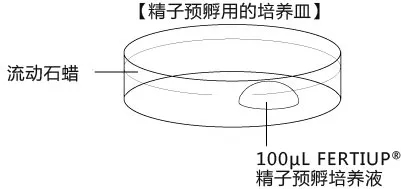
精子获能皿的制作
在采集精子前30min完成制作,并于CO2培养箱平衡至少30min。注意获能液滴的大小不得低于加精量的2倍。
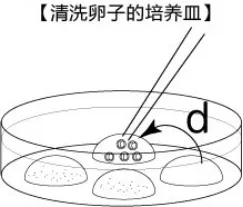
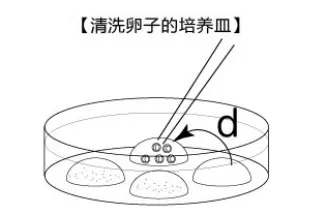
胚胎清洗皿的制作
所用试剂为KSOM培养液,每个培养皿中制作约50μL大小的液滴4~7个,并在皿底进行编号。
取精
精子采集
选用适龄的雄鼠(8周以上,12周龄最佳,经过育性检测),可用CO2安乐死或直接颈椎脱臼安乐死,开腹剪取附睾尾,用大剪刀和大钳子取出附睾管、附睾及一部分脂肪,在滤纸上切除附睾尾及去除血液和脂肪。
把切除的的附睾尾放入精子预孵用培养皿的流动石蜡中;
用精细镊固定附睾尾,维纳斯剪切开尾部中央的附睾管,用维纳斯剪轻压附睾尾,使精子团从切口处挤出后迅速挑起精子团并放入PM获能液滴中(如精子黏在刀尖上,可轻晃使其脱落或用精细镊轻轻将其剥离), 迅速用解剖针挑出精子块,然后放进精子预孵培养基的滴液里;
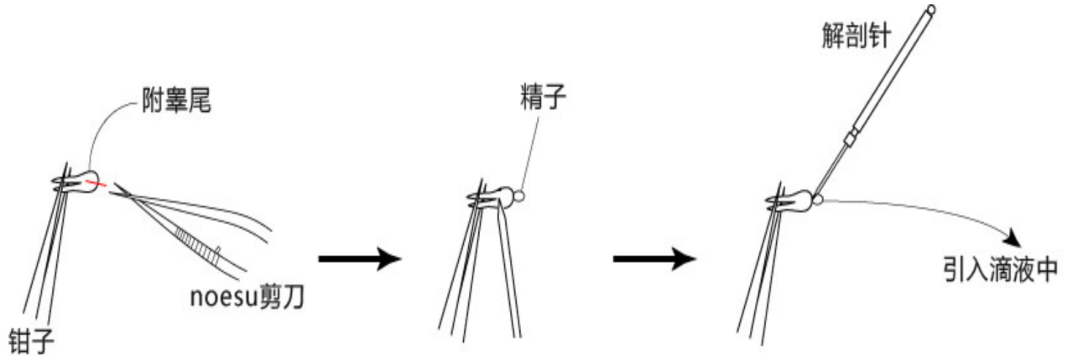
将释放精子后的PM获能皿迅速放回CO2培养箱培养60min,完成精子的体外获能。
取卵
卵子采集
让进行了过量排卵处理的雌性小鼠在注射了hCG的15~17个小时后安乐死,取出小鼠的子宫、输卵管、卵巢、及一部分脂肪;
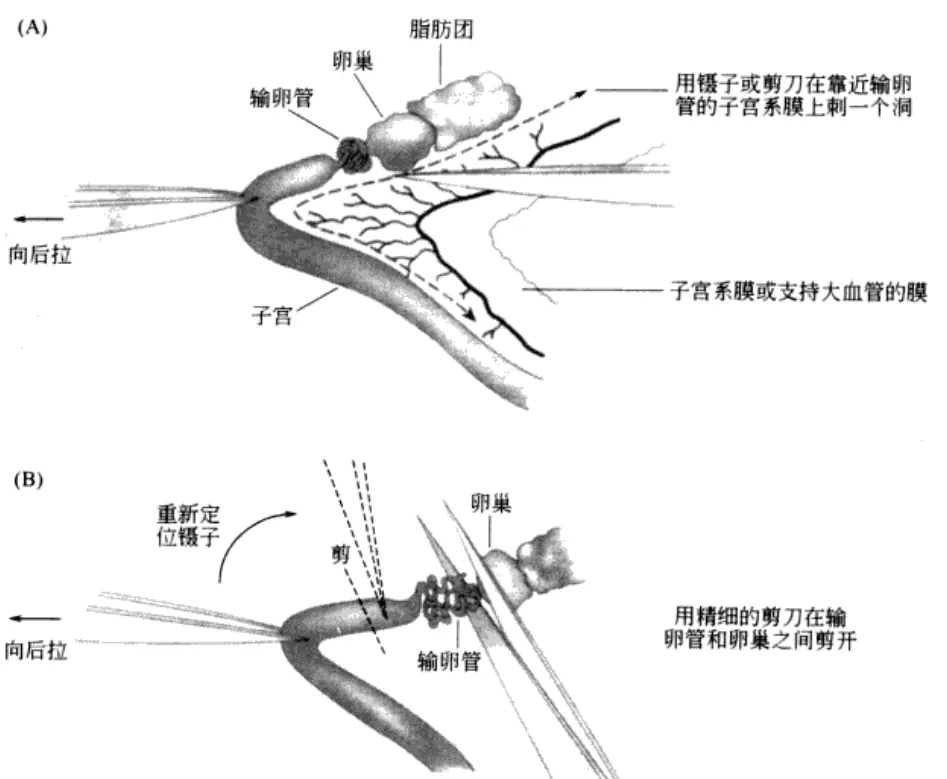
图片来源[3]
然后在滤纸上切除输卵管的尾部及去除血液和脂肪,把输卵管浸入受精用培养皿的流动石蜡中;
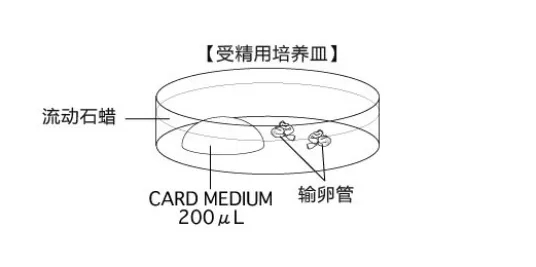
用精细镊把输卵管固定到培养皿底部,用注射器针尖撕破输卵管壁的胀大部分(膨大部),再用针尖挑起流出的卵母细胞团迅速转移到受精液滴中;
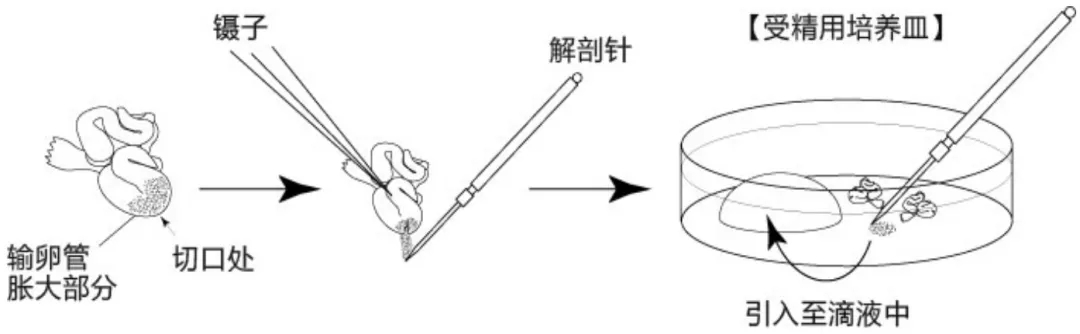
将释放的卵母细胞后的HTF受精皿迅速放回CO2培养箱,控制卵母细胞体外培养时间尽量短。
受精
待精子完成获能,且卵母细胞培养时间达标后,从CO2培养箱中将其取出平铺于37℃热台上,在体视显微镜下用最大倍数观察PM获能液滴边缘的精子活力(良好精子悬液应呈现乳白色,显微镜视野中液滴边缘精子游动迅速,且成群沿边缘移动),根据精子状态确定受精用量,通常单个受精液滴加入的精子悬液在4~8μL之间;
将受精用培养皿放在CO2培养箱里进行培养,将加入精子的受精培养皿放回CO2培养箱中进行培养,加精约19h后大部分2-cell形成。
胚胎挑取
加精24h后挑取计数2-cell、1-cell以及异常卵的数量,并把发育到2-cell阶段的胚胎转移到KSOM清洗皿中;在KSOM清洗皿中将2-cell胚胎至少清洗2次(挑取胚胎转移到另一个KSOM液滴中为1次清洗,尽可能除去挑取时附带的杂质),之后就可以将其用于胚胎移植或冻存实验;
胚胎在体外可继续培养至囊胚阶段,如有需要可继续使用KSOM培养皿进行培养(每天更换一次培养液)。
参考资料
1.小鼠精子透明质酸酶SPAM1在受精过程中的功能研究.
2.小鼠生殖工程学技术——6体外受精.
3.《小鼠胚胎操作实验手册》(原著第三版).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号