近年来随着空气污染、人群吸烟、人口老龄化、呼吸道传染病增多等问题,肺部疾病的发病率越来越高,致死率居高不下,成为了危害人类健康的重要原因之一。了解更多肺部疾病的相关知识,对于相关药物研究有着重要意义。
急性肺损伤
肺部的正常结构有利于肺泡-毛细血管中的O2-CO2交换,其中微血管内皮、间质和肺泡上皮形成完整的肺泡-毛细血管膜(ACM),作为选择性屏障,防止富含蛋白质的液体扩散和非气态溶质通过 [1]。急性肺损伤(ALI)特征是肺外(间接)或肺内(直接)损伤(如肺部感染、创伤和其他非心源性致病因素)导致的肺气体交换功能突然下降[2]。
由于直接或间接的损伤导致ACM的完整性受损,炎症细胞因子的信号传导和免疫细胞(如血小板、白细胞)和蛋白质释放到肺泡空间[3]。气体交换受阻,出现水肿,形成弥漫性肺泡损伤(DAD)和沿肺泡壁形成透明膜[4]。在最初的肺损伤后,自我修复机制会被激活,AEC II 型肺细胞增殖并分化为AEC I 型肺细胞,使水肿液流入间质,巨噬细胞清除细胞碎片[5]。通过这种方法,可以在一定程度上恢复ACM的完整性,改善氧合;也可能无法清除肺泡液,导致低氧血症和高碳酸血症酸中毒,ALI发展为急性呼吸窘迫综合征(ARDS)[6]。
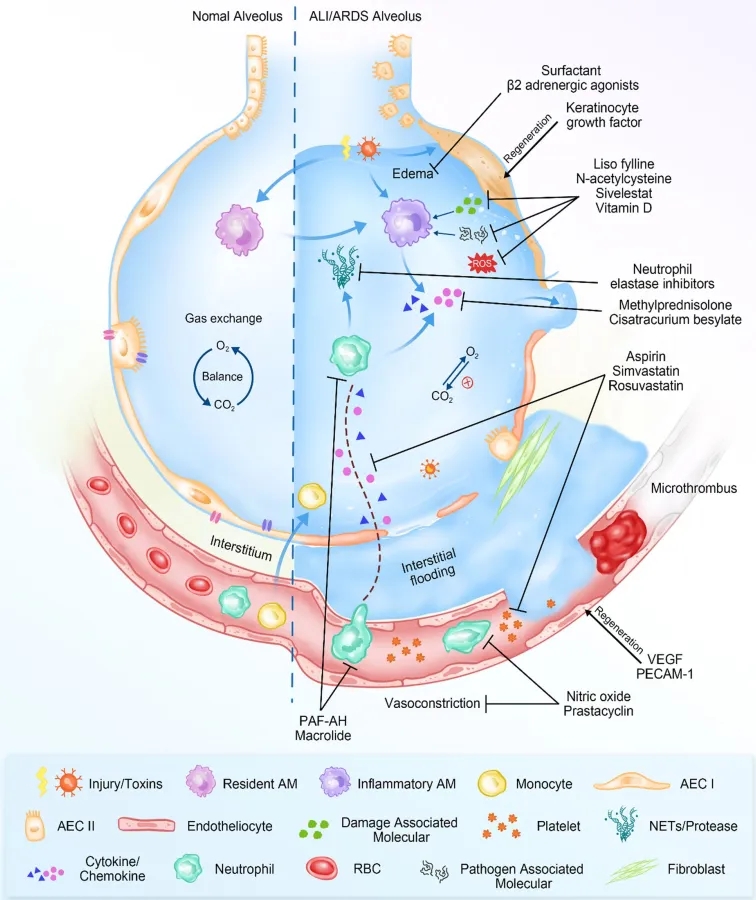
正常肺泡和ALI/ARDS肺泡[7]
急性肺损伤是一种由多种原因引起的复杂疾病,而急性呼吸窘迫综合征是一种弥漫性的严重急性肺损伤,每年在全世界夺去数百万人的生命。在COVID- 19大流行期间,由SARS-CoV-2引起的肺炎进展为ALI/ARDS已成为COVID- 19相关死亡的重要原因。
ALI/ARDS患者的治疗主要包括非药物定量治疗和药物干预。目前药物治疗对ALI/ARDS的失败有部分源于药物输送到肺部位受阻和疾病病变中药量积累不充足,也就是系统性给药问题。为了解决这个问题,利用纳米技术进行药物修饰为改善药理学结果同时减少副作用开辟了一条新的途径。从好的方面来看,由先进的生物或合成材料制成的纳米级输送系统,对于精确靶向和控制抗炎药物在肺部的释放有着很好的效果。然而,这些给药方式是否会引起局部/全身毒性或任何长期毒性影响,还需要继续研究和长期实验加以验证。
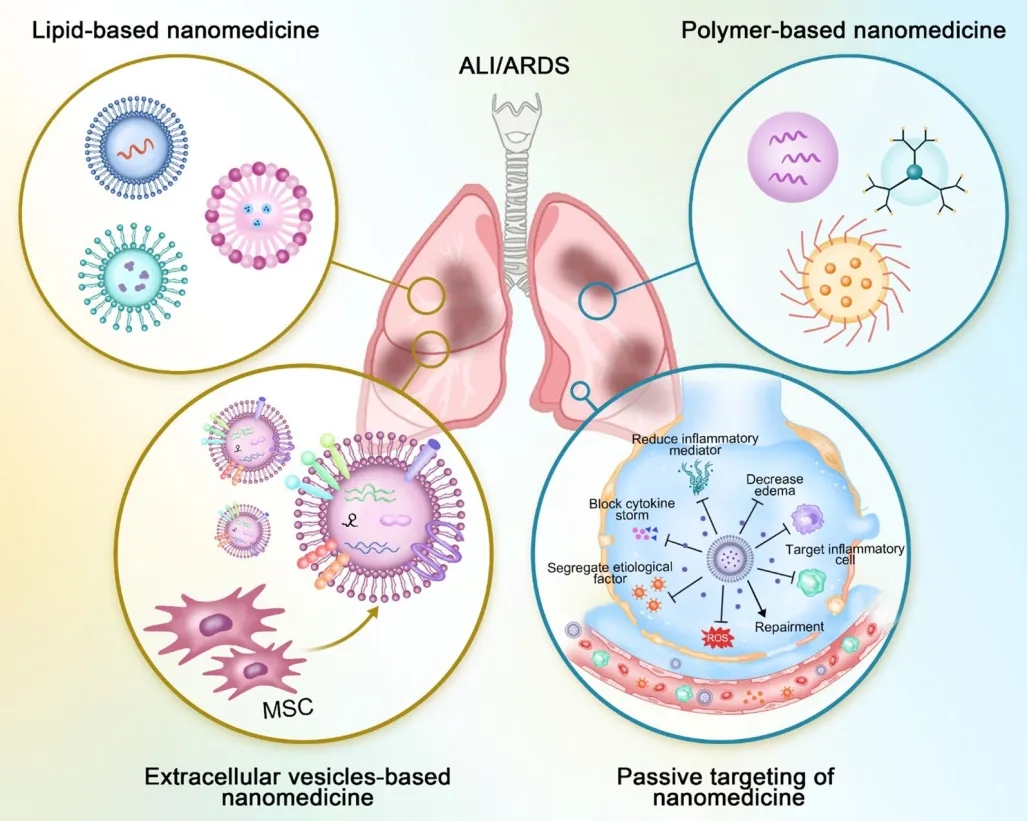
ALI/ARDS的纳米药物治疗策略[7]
ALI/ARDS药物研发的困境主要源于ALI疾病的异质性,以及人类ALI和动物模型之间的病理生理差异。ALI药物的研究中仍有许多未解决的问题,如特定的信号通路,环境和遗传的影响,以及通气和药物的联合策略,未来还需要更多的实验验证,以期得到更有效更安全的治疗药物。
肺纤维化
肺纤维化(PF,Pulmonary Fibrosis)属于肺间质性疾病的主要的类型。其特点是成纤维细胞增殖、细胞外基质聚集、炎症损伤和组织结构破坏[8]。近年来PF发病率呈逐年上升趋势,好发于40~50岁男性,由于其不可逆性,被称为“不是癌症的癌症”。据不完全统计,全球已有超500万患者受肺纤维化影响,尚无治愈方法。其中特发性肺纤维化(IPF)则是最典型的一类,症状上和其它普通的间质性肺炎无异,但后果严重很多,除了肺移植无有效治疗方案,后果是肺衰竭直至死亡。
肺纤维化的形成是机体对抗病原体和正常伤口愈合的基本反应[9]。在肺纤维化中,通常是各种疾病特异性的因素引发炎症和纤维化过度级联反应,导致下游纤维化组织重塑和细胞外基质沉积,进而使纤维化形成。目前已经确定多种与肺纤维化易感程度增加相关的因素,包括毒性、自身免疫、药物诱导、感染性或外伤性损伤均可引起肺纤维化。
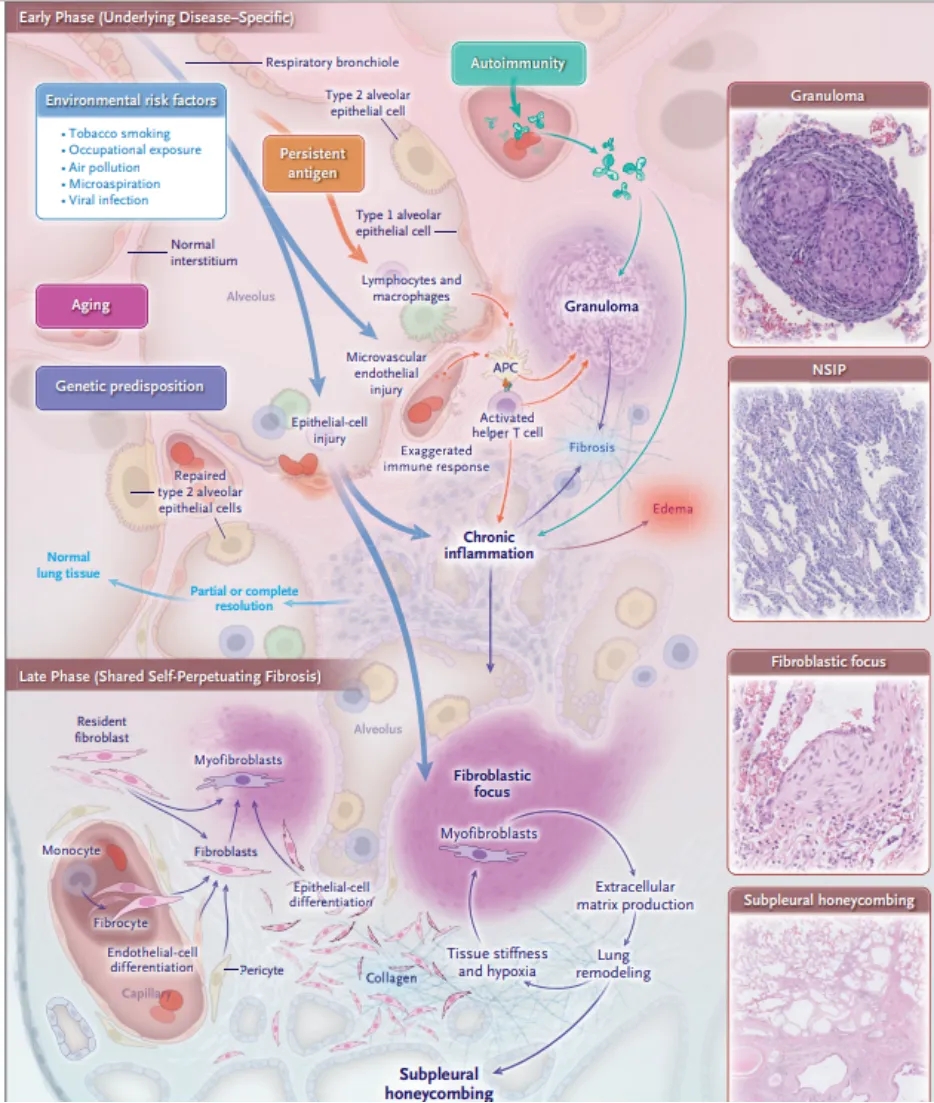
肺纤维化的发病机制和自我维持[10]
药物治疗通常包括糖皮质激素与免疫抑制剂等,目前上市药物只有两个,分别是:尼达尼布和吡非尼酮。其中,尼达尼布是多靶点激酶抑制剂,存在毒性大、副作用多等问题,吡非尼酮也存在机制不明等不足。此外,这两种药物仅能改善肺功能指标如FVC(用力肺活量)和DLCO(一氧化碳弥散量),治疗效果有限,虽然在延缓疾病进展、减轻临床症状方面有疗效,但不良反应也较为常见且严重,已发生纤维化的肺组织无法用通过现有药物疗法进行逆转。
建立合适的动物模型,对于更深入探索与理解急性肺损伤以及肺纤维化的发病机制与病因、以及开发新的治疗药物与疗法,具有重要意义与参考价值。百奥动物自主研发多种急性肺损伤、肺纤维化小鼠模型,助力相关疾病药物研发。
急性肺损伤模型展示
➤ 木瓜蛋白酶诱导的急性肺损伤小鼠模型
木瓜蛋白酶诱导急性肺损伤小鼠模型的建立
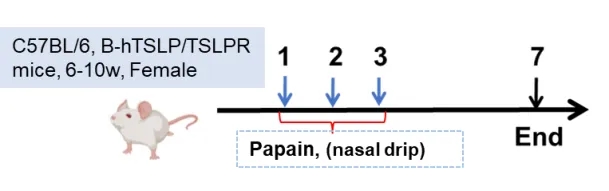
木瓜蛋白酶诱导的急性肺损伤模型
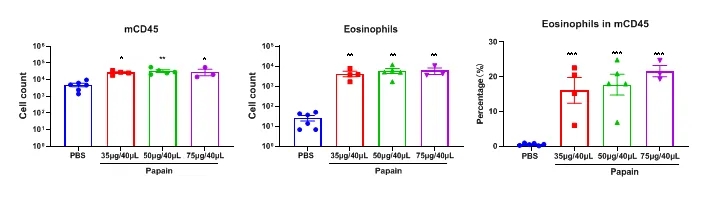
木瓜蛋白酶诱导急性肺损伤小鼠模型BALF嗜酸性粒细胞在 mCD45 中百分比升高。数值以平均值±SEM表示。
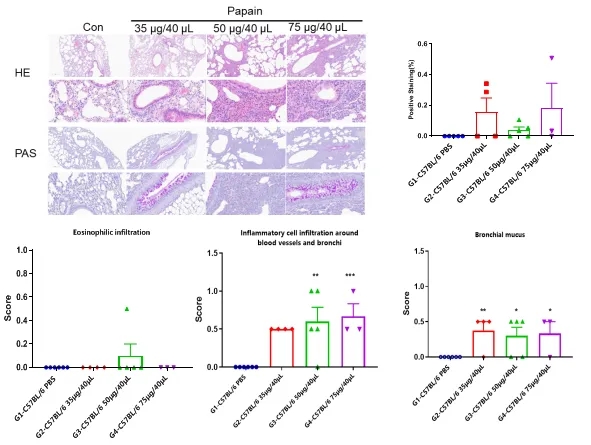
基于C57BL/6小鼠的木瓜蛋白酶诱导急性肺损伤小鼠模型炎症细胞浸润及血管、支气管周围支气管粘液评分。数值以平均值±SEM表示。*** p<0.001, **p<0.01, *p<0.05。
➤ ALT诱导急性肺损伤小鼠模型
ALT诱导急性肺损伤小鼠模型的建立
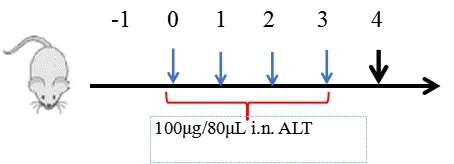
连续4次经鼻给药ALT (100μg/80μL)或PBS(对照组)诱导C57BL/6小鼠急性肺损伤。
支气管肺泡灌洗液(BALF)中免疫细胞变化
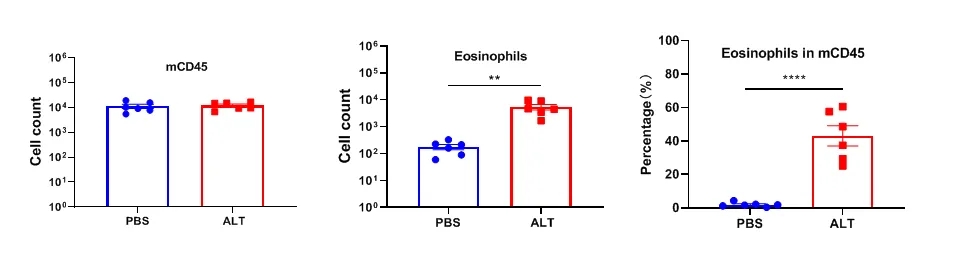
急性肺损伤小鼠模型BALF嗜酸性粒细胞在 mCD45 中的百分比升高。数值以平均值±SEM表示。
➤ LPS诱导急性炎症小鼠模型
LPS诱导急性炎症小鼠模型的建立
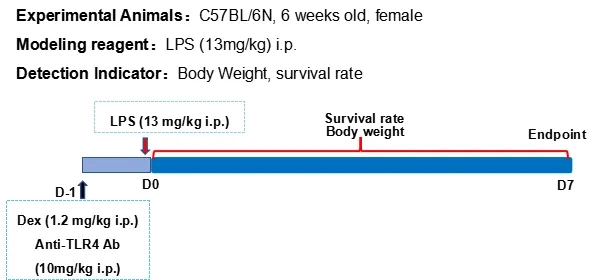
抗 TLR4 抗体(内部制备)在急性炎症小鼠模型中的有效性验证

(A) 小鼠的体重及LPS处理后的体重变化;(B) LPS诱导的急性炎症小鼠模型的存活率得到改善;(C) LPS 诱导的急性炎症中 Dex 和抗 TLR4 抗体(内部制备)处理后血清中 IL6 的水平显著降低。
➤ LPS诱导急性肺损伤小鼠模型
LPS诱导急性肺损伤小鼠模型的建立
支气管肺泡灌洗液(BALF)中的免疫细胞
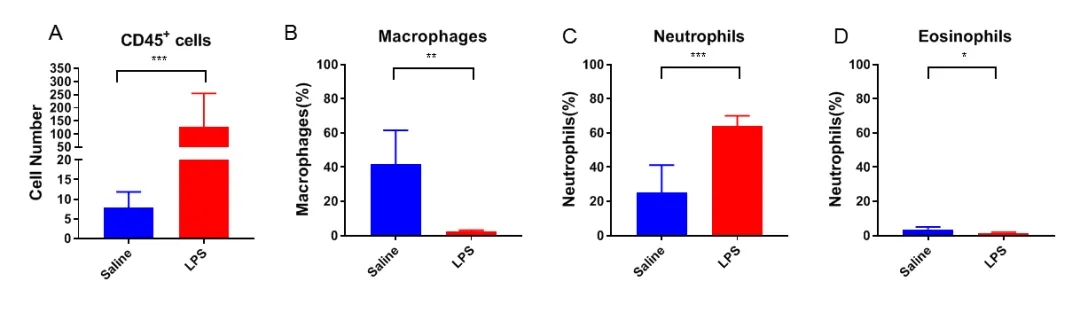
通过鼻内给药(IN)用盐水(蓝色)或LPS(红色)处理小鼠,收集支气管肺泡灌洗液(BALF)。(A)每毫升BALF的细胞总数和(B)巨噬细胞、(C)嗜中性粒细胞和(D)嗜酸性粒细胞的百分比。
肺纤维化模型展示
➤ 博来霉素(BLM)诱导的肺纤维化小鼠模型
BLM诱导的肺纤维化小鼠模型的建立
BLM诱导C57BL/6J小鼠肺纤维化
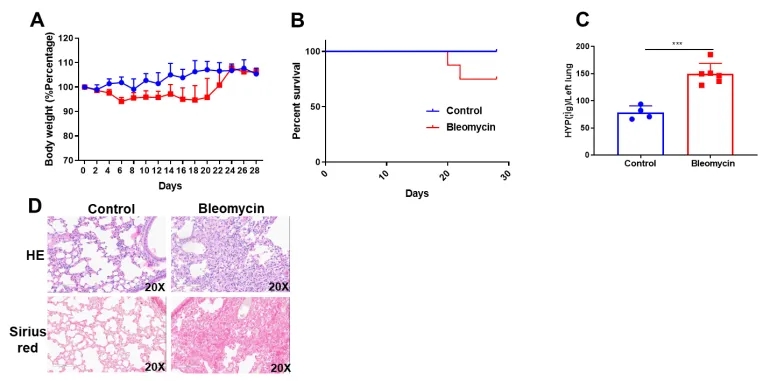
C57BL/6J小鼠在第0天给予BLM,每天记录体重。实验结束时采集肺组织,测定肺组织中羟脯氨酸(HYP)含量。BLM导致体重减轻(A),生存率缩短(B), HYP含量增加(C)。病理检查显示明显的肺纤维化(D)。
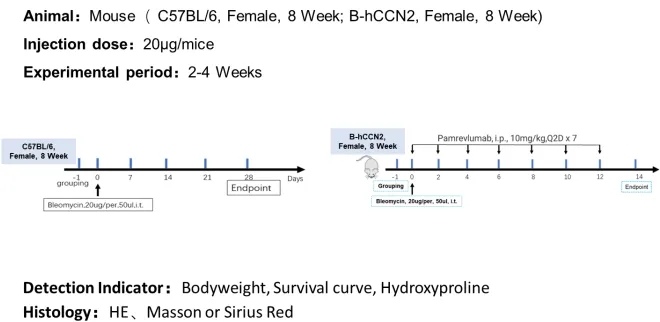
Pamrevlumab在BLM诱导的B-hCNN2小鼠肺纤维化模型中的疗效验证
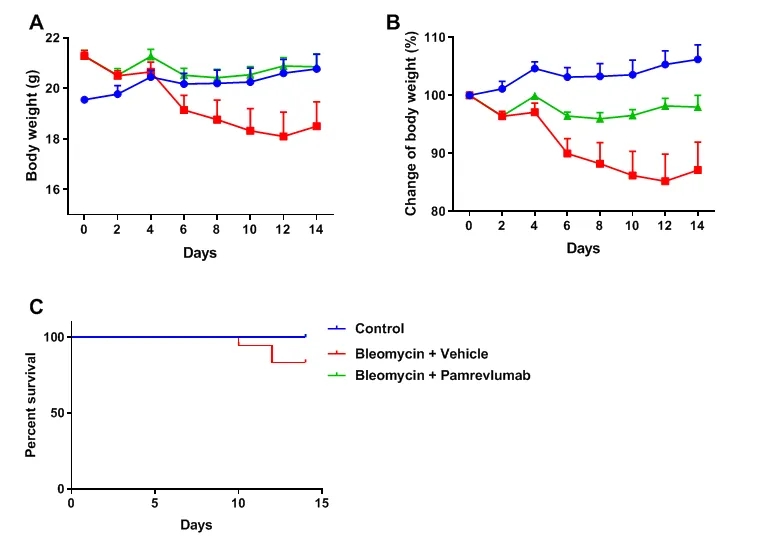
Pamrevlumab对BLM诱导的体重减轻的影响。B-hCCN2小鼠在第0天给予BLM,然后每2天注射pamrevlumab或对照,共7次。每天记录体重。在实验结束时,pamrevlumab治疗能够改善BLM诱导的B-hCCN2小鼠的体重减轻,pamrevlumab有效降低BLM导致的死亡率。
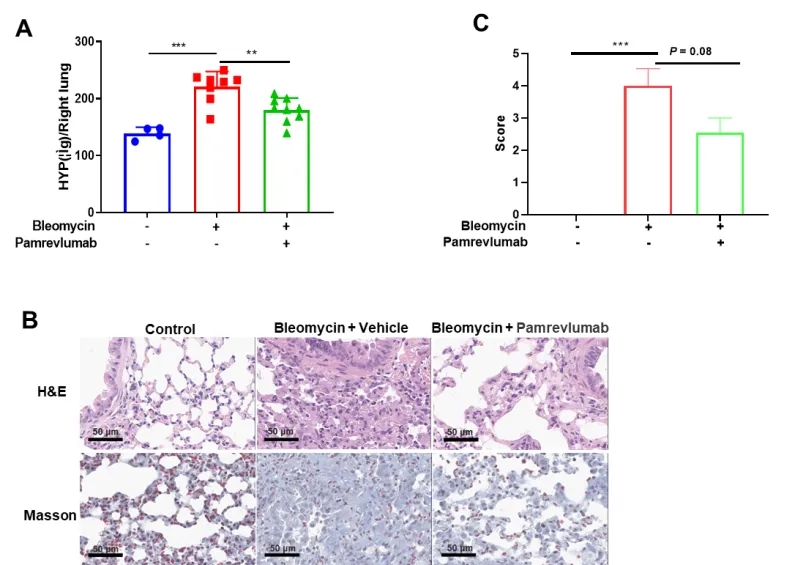
Pamrevlumab对BLM诱导肺纤维化的影响。BLM诱导小鼠肺纤维化严重程度的组织学分析。采用肺总羟脯氨酸(HYP)标准测定及病理检查对肺纤维化进行评分。BLM诱导HYP含量升高,pamrevumab治疗降低了肺组织中HYP的含量。数值以均数±SEM表示,n=4-8。
参考文献
[1]Knudsen L, Ochs M. The micromechanics of lung alveoli: structure and function of surfactant and tissue components. Histochem Cell Biol. 2018; 150(6): 661–76.
[2]Murray D, Itenov T, Sivapalan P, Eklöf J, Holm F, Schuetz P, Jensen J. Biomarkers of acute lung injury the individualized approach: for phenotyping, risk stratification and treatment surveillance. J Clin Med.2019;8(8):1163.
[3]Matthay MA, Zemans RL, Zimmerman GA, Arabi YM, Beitler JR, Mercat A, Herridge M, Randolph AG, Calfee CS. Acute respiratory distress syndrome. Nat Rev Dis Primers. 2019; 5(1): 18.
[4]Obadina ET, Torrealba JM, Kanne JP. Acute pulmonary injury:high-resolution CT and histopathological spectrum. Br J Radiol.2013; 86(1027): 20120614
[5]Wu A, Song H. Regulation of alveolar type 2 stem/progenitor cells in lung injury and regeneration. Acta Biochim Biophys Sin.2020;52(7): 716–22
[6]Butt Y, Kurdowska A, Allen TC. Acute lung injury: a clinical and molecular review. Arch Pathol Lab Med. 2016; 140(4): 345–50.
[7]Jianguo Zhang, Yumeng Guo, Michael Mak
and Zhimin Tao.Translational medicine for acute lung injury.Journal of Translational Medicine. 2024; 22:25.
[8]VD Latta,Cecchettini A,Ry SD.Bleomycin in the setting of lung fibrosis induction:From biological mechanisms to counteractions.Pharmacol Res.2015, 97:122-30.
[9]Thannickal, V.J., et al., Fibrosis: ultimate and proximate causes. J Clin Invest, 2014. 124(11): p. 4673-7.
[10]Wijsenbeek, M. and V. Cottin, Spectrum of Fibrotic Lung Diseases. N Engl J Med, 2020. 383(10): p. 958-968.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号