当前,全世界有数百万人患有神经系统类疾病,靶向中枢神经系统(Centarl Nervous System, CNS)疾病治疗的难点在于血脑屏障(Blood Brain Barrier, BBB)阻碍了药物向大脑的递送。血脑屏障是循环系统和中枢神经系统之间的物理屏障,通常只允许相对分子质量较小的气体分子和脂溶性分子(如氨基酸、葡萄糖、核苷和脂肪酸等)通过,以维持脑内环境稳态。大多数药物对脑部疾病无效,是由于其极低的BBB穿透效率,难以在脑内达到有效的治疗浓度。
BBB上高度富集的受体和转运体包括转铁蛋白受体(Transferrin Receptor, TfR)、低密度脂蛋白受体(LDL receptor, LDLR)和葡萄糖转运蛋白-1(Glucose Transporter-1, GLUT1)等可传输营养物质和能量,对于脑部疾病相关治疗药物的输送具有很大潜力。
开发利用BBB特性的非侵入性或微创性纳米药物递送系统是治疗CNS疾病的最佳选择。为改善 BBB 穿透性,研究者们做了许多尝试:1) 利用 BCECs(Brain Capillary Endothelial Cells) 上高表达某些受体或转运体,相应的配体通过受体介导或转运体介导的转运进行摄取;2) 利用内皮细胞膜的负电荷或细胞穿透肽的跨膜特性,阳离子或肽通过修饰后,经吸附介导的转运增强 BBB 穿透;3) 利用细胞或病毒的固有特性,提取的病毒外体、细胞膜或蛋白质外壳被用作载体,通过细胞介导的转运穿过BBB。其中,以受体介导的胞吞作用(Receptor Mediated Transcytosis, RMT)在药物跨血脑屏障运输方面取得了快速进展。
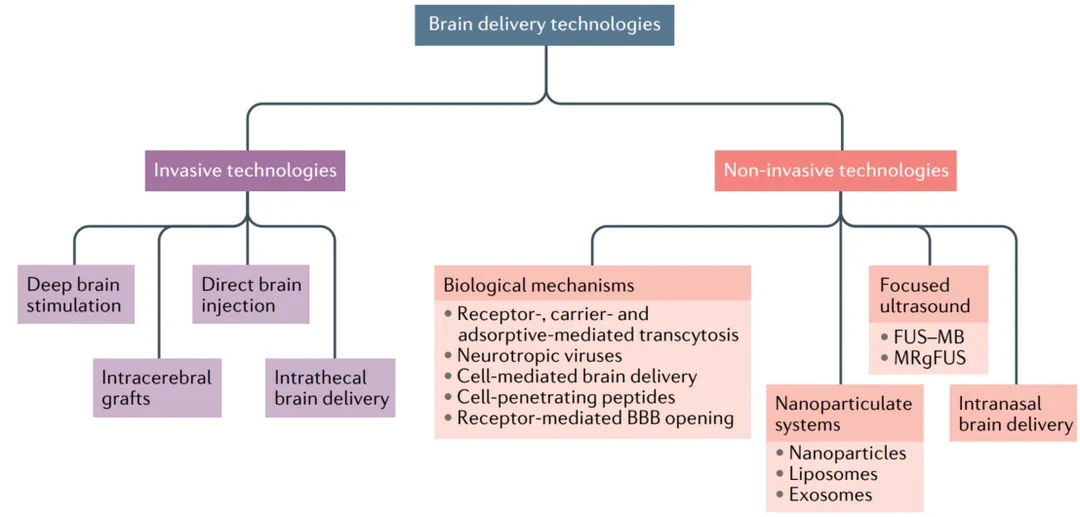
图1. 脑递送技术[1]
Tf/TfR1简介
TfR是基于RMT的脑递送方法中研究最广泛的靶蛋白,有两种类型:TfR1和TfR2。TfR1也称被为TFRC或CD71,是一种97-kDa的2型膜蛋白,在细胞膜上以同源二聚体的形式存在,广泛表达在各种细胞中,特别是快速增殖的细胞和需要能量的细胞,如癌细胞、破骨细胞、活化淋巴细胞和红母细胞等;在哺乳动物中,TfR1是红细胞生成和神经发育所必需的。TfR2则不太常见,主要表达在肝细胞中。
转铁蛋白(Tf, Transferrin)可通过循环将铁递送到细胞中。血清中的大部分铁与Tf一起存在,血清Tf有非铁结合型(apo-Tf)、单铁结合型或双铁结合型(holo-Tf)三种形式。Tf结合的铁通过TfR1介导的内吞作用将铁离子转运到需铁的细胞。TfR1和Tf之间的相互作用依赖于pH; 在pH 7.4时,TfR1与铁饱和的holo-Tf结合,但不与无铁的apo-Tf结合。相反,核内体内pH值较低时,TfR1与apo-Tf结合,但不与holo- Tf结合。
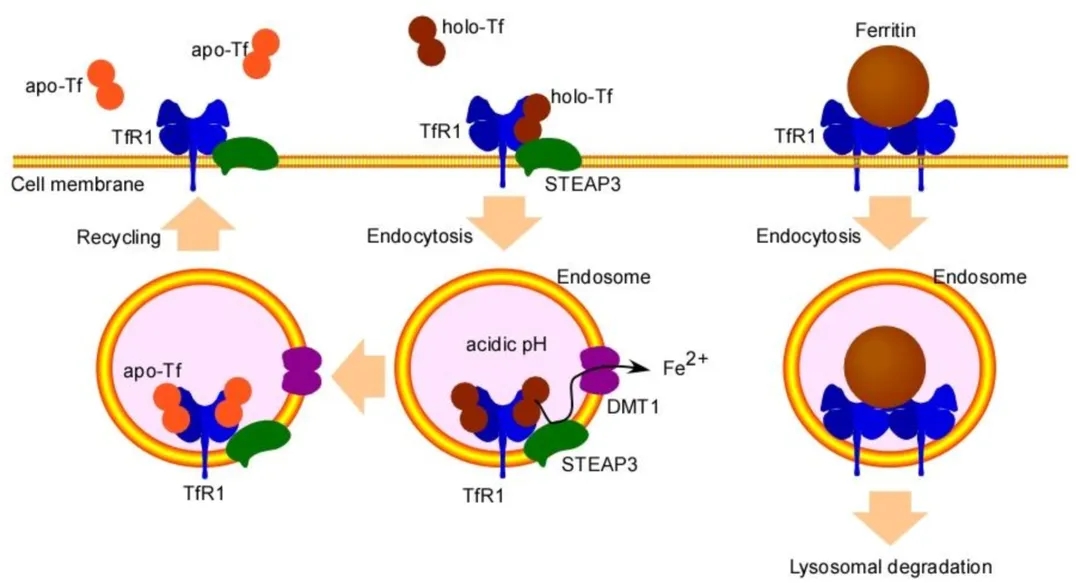
图2. 转铁蛋白受体1 (TfR1)介导的转铁蛋白(Tf)和铁蛋白摄取[2]。(左)Tf摄取。在细胞表面,铁饱和的holo-Tf与TfR1结合,该复合物通过网格蛋白介导的内吞作用被内化。在核内体酸性的环境中,Fe3+与Tf解离,并被金属还原酶如前列腺六跨膜上皮抗原3 (STEAP3)还原为Fe2+,然后被二价金属转运蛋白1 (DMT1)转运到细胞质中。核内体中的apo-Tf /TfR1复合体通过循环被转运到细胞表面,apo-Tf被释放到血流中。STEAP3在幼红细胞中高表达,并与TfR1相互作用,但在淋巴细胞中低表达。(右)铁蛋白摄取的假设方案。铁蛋白已被证明是TfR1的另一个配体。人细胞质铁蛋白由24个不同比例的H亚基和l亚基组成,只有H亚基可以与TfR1相互作用。只有TfR1表达超过一定阈值水平的细胞,如幼红细胞,才能通过TfR1结合铁蛋白;因此,可能需要多个TfR1复合体来摄取铁蛋白复合体。
TFR1的高效细胞摄取特性已被用于靶向递送抗癌药物和生物制剂,以及靶向递送治疗基因到过表达TFR1的恶性细胞中。这种递送可通过多种方法实现,包括转铁蛋白与治疗剂的化学偶联、转铁蛋白与肽的基因融合以及抗TFR1抗体等。靶向TFR1也可极大地促进药物通过血脑屏障递送至中枢神经系统(CNS)。
针对TFR1的靶点药物主要有两个方向:作为TAA开发ADC药物、CAR-T;作为穿过BBB向大脑定向运输大分子药物的“特洛伊木马”,对于治疗阿尔茨海默症、帕金森、溶酶体贮积症、脑癌等多种脑部疾病具有重要意义。
百奥赛图成功构建了人源化B-hTFR1小鼠模型,助力靶向TFR1的相关研究临床前评估。
2024年5月16日,麻省/哈佛博德研究所Bejamine Deverman团队在Science杂志上发表了重要的前沿性研究成果,设计出了一种有潜力的新型腺相关病毒(AAV)基因治疗递送载体,BI-hTFR1,通过与人BBB中的TFR1结合,能够高效穿越BBB。该研究使用了我司自主开发的B-hTFR1小鼠进行体内实验。实验中作者将BI-hTFR1注射到表达人转铁蛋白受体的人源化小鼠(即B-hTFR1 小鼠)血液中,结果显示BI-hTFR1在B-hTFR1小鼠CNS中的报告基因表达水平比FDA批准的用于CNS疾病治疗的AAV9高出40-50倍。这种增强的趋向性是CNS特异性的,在野生型小鼠中不存在。当用于递送人类基因葡糖神经酰胺酶β1(GBA1)时(该基因突变可引起戈谢病且与帕金森病有关),与AAV9相比,BI-hTFR1可大量增加脑和脑脊液葡糖脑苷脂酶活性。这些发现表明BI-hTFR1是一种很有前景的人类CNS基因治疗载体。

图3.Science官网截图
BI-hTFR1的CNS趋向性
为研究BI-hTFR1是否可以通过与人TfR1结合在体内穿过BBB,作者使用TFRC敲入(KI)C57BL/6J小鼠(即B-hTFR1小鼠),该人源化小鼠的Tfrc编码细胞外域的4-19号外显子被人的TFRC的相应区域取代(图4A),且小鼠-人嵌合基因mRNA和蛋白产物水平与野生型C57BL/6J小鼠相似,因此该人源化小鼠适合用于针对人TfR1的AAVs的趋向性评估。作者将BI-hTFR1或AAV9:CAG-NLS-mScarlet-P2A-Luciferase-WPRE-SV40pA静脉注射5×1011vg/mouse到成年雌性C57BL/6J或TFRC KI小鼠(图4B)。注射后三周,观察到BI-hTFR1在TFRC KI小鼠的脑和脊髓的生物分布和转导增强,但在对照C57BL/6J小鼠中没有观察到这种现象(图4C和4D)。相对于AAV9处理组,作者在BI-hTFR1处理的TFRC KI小鼠中并未观察到评估的其他任何器官中生物分布和转导的增加,这表明BI-hTFR1与人TfR1的互作选择性地增强了CNS趋向性。
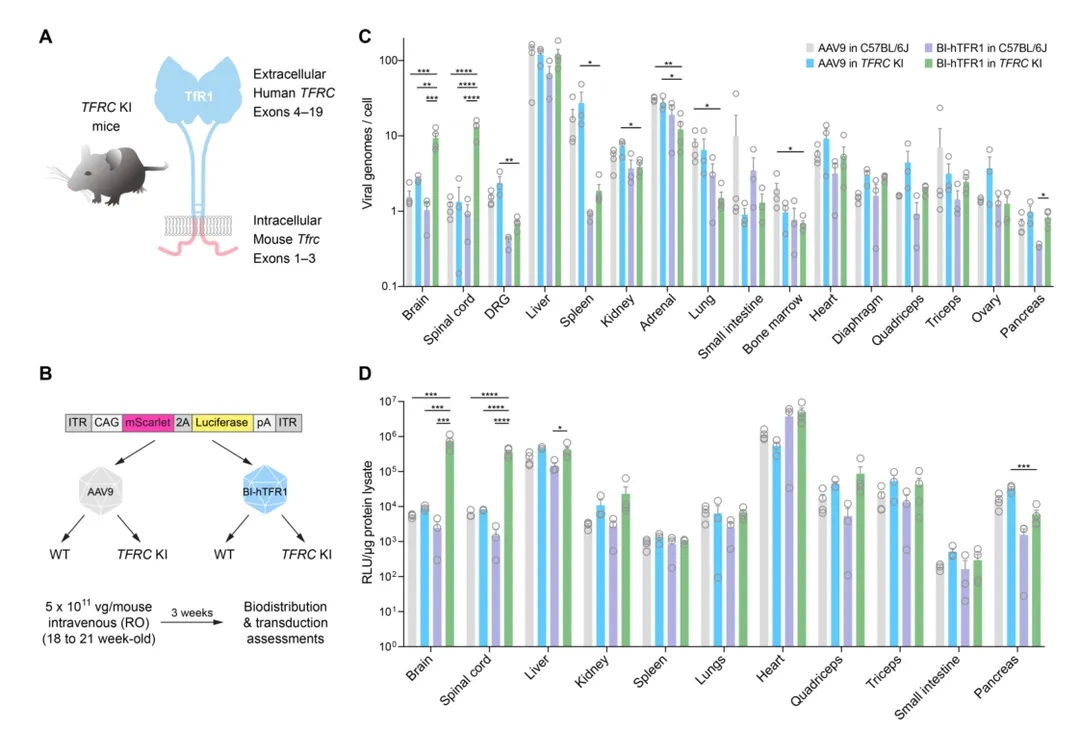
图4. BI-hTFR1高效地将基因递送到TFRC KI小鼠的中枢神经系统
BI-hTFR1在整个大脑中介导GBA表达
作者还评估了BI-hTFR1将人GBA1递送到TFRC KI小鼠的能力。构建了一个单链AAV基因组,该基因组包含一个混合巨细胞病毒增强子-鸡β肌动蛋白(CMV-CBA)启动子,该启动子驱动驱动带有C末端流感病毒血凝素(HA)标签的人GBA1表达(图5A)。基因组被包装到AAV9或BI-hTFR1中,并以1 × 1014 vg/kg的剂量静脉给药TFRC KI小鼠,该剂量与FDA批准的基于AAV9的Zolgensma基因疗法用于脊髓性肌萎缩的体重调整后剂量相当。此外,作者还以低20倍的剂量(5 × 1012 vg/kg)将BI-hTFR1:GBA1给药另一组TFRC KI小鼠。对于未处理的对照组小鼠,使用与TFRC KI小鼠具有相同遗传背景的C57BL/6J小鼠。给药后3周,与接受AAV9的小鼠相比,在接受BI-hTFR1治疗的小鼠大脑中检测到约30倍的AAV基因组(图5B)。
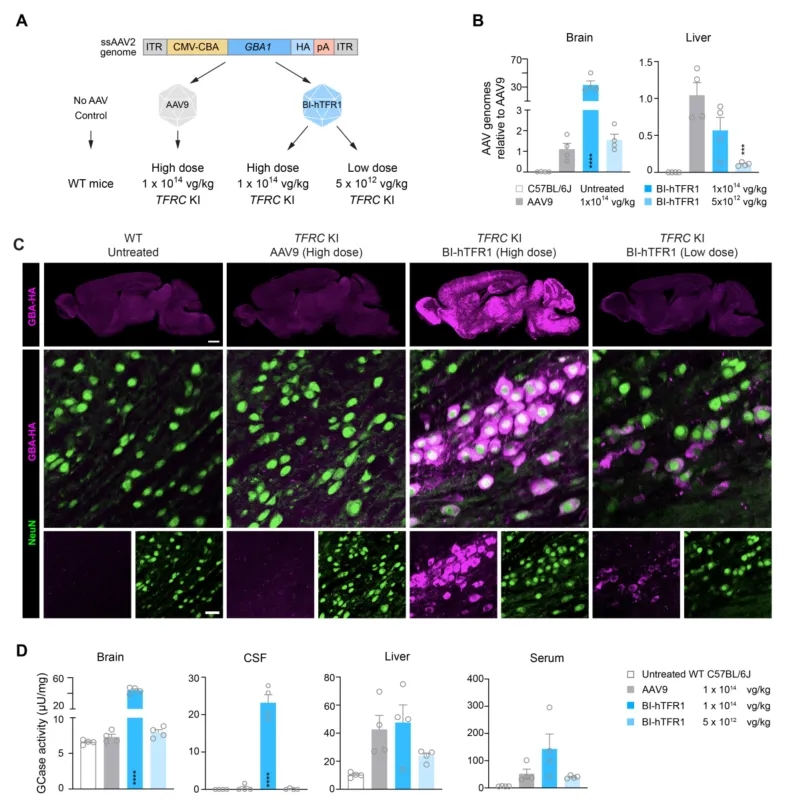
图5. BI-hTFR1高效地递送GBA1并增加TFRC KI小鼠大脑中GCase的活性
与注射高剂量AAV9的小鼠或对照C57BL/6J小鼠相比,作者观察到通过HA免疫染色评估的GBA-HA在全脑范围内的高表达(图5C),并且在脑组织溶解物和脑脊液(CSF)中显著升高了葡萄糖脑苷脂酶(GCase)活性(图5D)。与注射高剂量BI-hTFR1的小鼠相比,在注射高剂量AAV9的小鼠中观察到脑内GBA表达极低,但肝脏中的病毒基因组、GBA表达和GCase活性的数量相似(图5B和5D)。如预期,与高剂量AAV9组相比,在注射低剂量BI-hTFR1的小鼠中,肝脏中的病毒基因组数量减少。
靶向人类受体AAV衣壳的优势
通过靶受体结合筛选开发的BI-hTFR1和其他AAV衣壳的一个关键优势是它们的作用机制(MOAs)已经建立,其物种趋向性可预测,可为大动物实验提供信息。而传统筛选的AAV衣壳MOAs未知,其转化到包括人在内的其他物种的潜力未知。了解AAV衣壳的精确靶点也有助于预测其在人类患者中的功能。
靶向人类受体AAV衣壳的第二个优势是利用这些载体的基因疗法可以在同时具有人类靶受体和疾病相关突变的KI小鼠模型中进行测试。疾病模型通常使用小鼠创建,并且在没有跨物种转化的增强CNS趋向性AAV衣壳的情况下,研究将需要使用小鼠BBB交叉衣壳的替代物递送,并在这些疾病模型中测试其潜在治疗载荷。而使用BI-hTFR1,可以在与TFRC KI小鼠杂交的小鼠疾病模型中对将用于人类患者的基因治疗产品进行测试,无需将衣壳换成替代剂。
实验结果表明,BI-hTFR1可以利用人类TfR1的RMT活性,穿过BBB,并将基因广泛高效地传递到CNS。这些特性为进一步探索BI-hTFR1作为载体应用于人CNS基因疗法提供了强有力的支持。
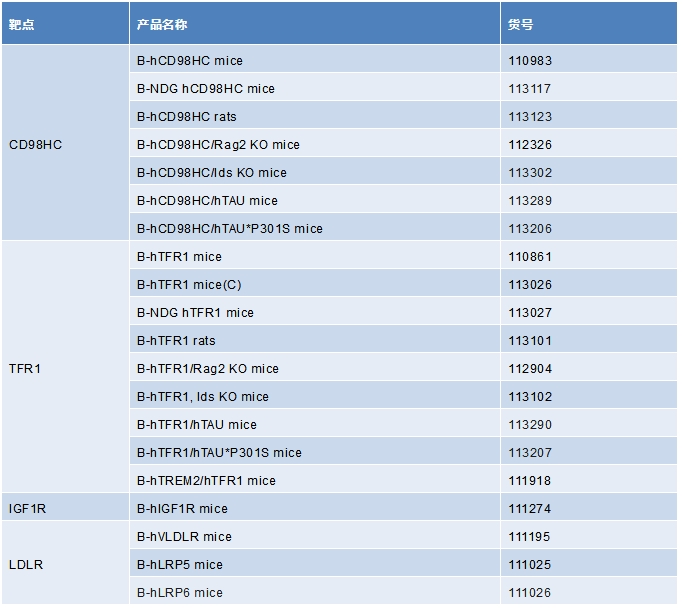
百奥赛图开发了一系列血脑屏障相关靶点人源化小鼠,欢迎联系我们获取更多信息。
参考资料
[1]. https://doi.org/10.1038/s41573-021-00139-y
[2]. https://doi.org/10.1016/j.freeradbiomed.2018.06.037
[3]. https://doi.org/10.12677/pi.2022.113017
[4]. https://doi.org/10.1101/2023.12.20.572615
[5]. https://doi.org/10.1016/j.apsb.2020.11.023
[6]. doi: 10.3389/fimmu.2021.607692






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号