一般来说,体检报告里的血脂检查包含4个检测指标,即甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)。其中,LDL-C被人们所熟知为“坏胆固醇”,LDL也是目前动脉粥样硬化性心血管疾病(ASCVD)药物的主要作用靶点。然而,近年来,人们发现,Lp(a)【Lipoprotein(a),脂蛋白(a)】是独立于LDL的ASCVD风险因素。即使LDL-C保持在较低水平,Lp(a)水平升高也会增加心血管事件的风险。
Lp(a)结构与LPA多态性
Lp(a)主要在肝脏合成,由脂质和蛋白质两部分组成(图1):脂质部分主要是位于核心部位的LDL样微粒;蛋白质部分则位于外周,由两种载脂蛋白【Apo(a)和ApoB100】通过二硫键连接而成。
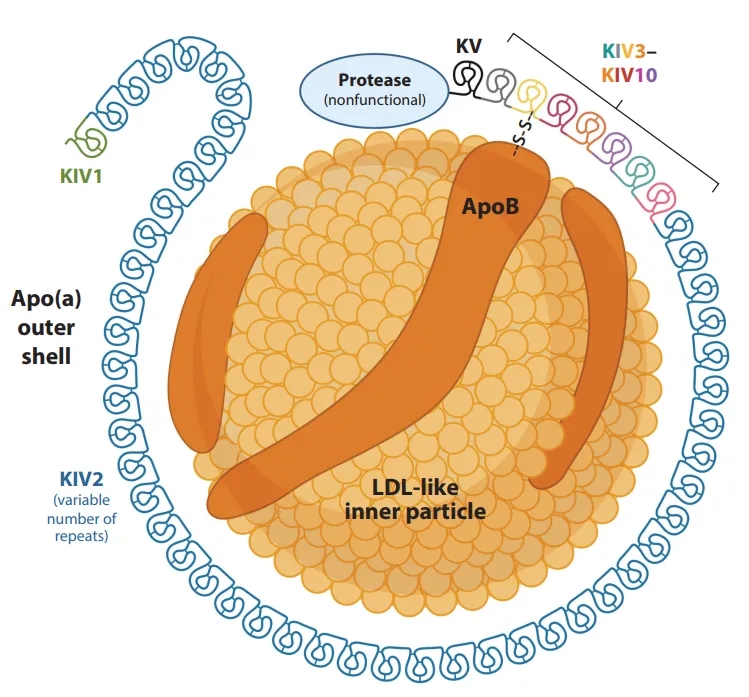
图1. Lp(a)结构1
Apo(a)蛋白由LPA基因编码,由KIV1-10结构域、KV结构域和蛋白酶样结构域组成。其中KIV2具有拷贝数多态性(1到>40拷贝),所以LPA也成为人类基因中多态性最高的基因之一。KIV2拷贝数越少,Apo(a)肽链越短,合成速度越快,血浆Lp(a)水平越高。人群中Lp(a)水平差异极大,可达到1000倍以上,主要取决于LPA基因多态性,几乎不受年龄、体重、饮食、运动和传统降脂药物的影响。
Lp(a)与心血管疾病关联
Lp(a)与动脉粥样硬化、血栓、主动脉瓣钙化风险增加有关。目前尚未确定引起心血管疾病风险的Lp(a)阈值,但一般以50mg/dL为界。据统计,全球有14亿人Lp(a)高于50mg/dL。
尽管Lp(a)水平升高常见,但缺乏针对性治疗药物。他汀类可有效降低LDL-C,而对Lp(a)效果不明确,甚至有证据显示其可增加Lp(a)水平。烟酸及PCSK9抑制剂可一定程度降低Lp(a)水平,但降幅仅为20%~30%。鉴于Lp(a)水平呈高度偏态分布(图2),心血管病患者的Lp(a)水平可能很高,20%~30%的降幅往往不足以使患者达标。

图2. 人群中Lp(a)血浆水平分布2
降Lp(a)药物研发
当下,针对Lp(a)的药物研发主要集中在小核酸领域,通过皮下注射ASO或siRNA,来降低LPA的基因表达(图3):
ASO(antisense oligonucleotides)是短的单链反义核苷酸分子(18~30nt),可靶向特定的RNA,形成双链导致其降解。
siRNA(small interfering RNA)是短的双链RNA分子,可与RNA诱导沉默复合体(RISC,RNA-induced silencing complexes)形成复合物来裂解互补的mRNA序列。

图3. 降Lp(a)药物的作用机制1
进展较快的降低Lp(a)的在研药物有:
Pelacarsen(TQJ230)
ASO药物,通过GalNAc递送系统,进入肝细胞。目前正在进行HORIZON关键性临床III期试验,完成入组8325受试者,预计数据将于2025年公布。II期临床研究显示80mg/月的给药剂量可将98%的病人的LP(a)水平降到50 mg/dL以下3。
该药物由Ionis Pharmaceuticals研发,并于2019年授权给诺华进行全球独家开发、生产和商业化。2023年双方进一步加深合作,开发下一代LP(a)疗法,Ionis将从诺华获得6000万美元的预付款。
Olpasiran(AMG 890)
siRNA药物。OCEAN(a)-DOSE(NCT04270760)针对281例LP(a)浓度高于60mg/dL的ASCVD患者的II期临床研究显示,在36周时,≥75 mg剂量、Q12W频次的olpasiran可使患者LP(a)水平降低>95%4。
Amgen于2016年9月29日从Arrowhead引进该药物,交易包括3500万美元首付款、2150万美元股权投资,以及最高6.17亿美元的后续里程碑、选择权款项。
Lepodisiran(LY3819469)
长效siRNA药物,由礼来研发。2024年3月启动临床III期试验(NCT06292013),计划入组12500例患者,预计2029年3月完成。2022年底,该药物在中国获批进入临床。临床I期研究表明,单次注射608 mg可使患者LP(a)水平降低94%并维持1年5。
Zerlasiran(SLN360)
siRNA药物,由Silence Therapeutics研发。II期临床试验(ALPACAR-360)的初步数据显示,300 mg Q16W或Q24W,450 mg Q24W的剂量在36周时,可将中位LP(a)水平降低≥90%6。
Muvalaplin
LP(a)小分子抑制剂,由礼来研发,是目前唯一一款口服LP(a)药物。该药物结合apo(a)的KIV7和KIV8,进而阻止apo(a)和apoB100结合。I期临床试验显示,持续14天每日口服Muvalaplin可将血液中LP(a)水平最多降低65%,无显著的不良反应7。
体内基因编辑疗法
使LP(a)基因失活,具有一次性治疗的潜力。
2023年6月,礼来支付6000万美元首付款与Verve达成合作开发,交易总额超5亿美元8。
国内的Lp(a)药物研发尚处于临床前阶段。
为助力Lp(a)药物研发,百奥动物自主研发了LPA人源化小鼠模型,可高表达人LPA蛋白,用于Lp(a)药物的体内药效评估。
B-hLPA mice
品系名称:C57BL/6-Gt(ROSA)26Sortm1(LPA) Bcgen/Bcgen
背景:C57BL/6
货号:112723
该小鼠携带人LPA基因的完整编码区。

B-hLPA小鼠的种属特异性Apo(a)的ELISA蛋白表达分析。取7周龄野生型C57BL/6小鼠(+/+),杂合B-hLPA mice (H/+)和纯合B-hLPA mice (H/H)血清进行分析。结果表明只能在杂合和纯合B-hLPA mice中检测到人Apo(a)的表达,野生型小鼠中检测不到。
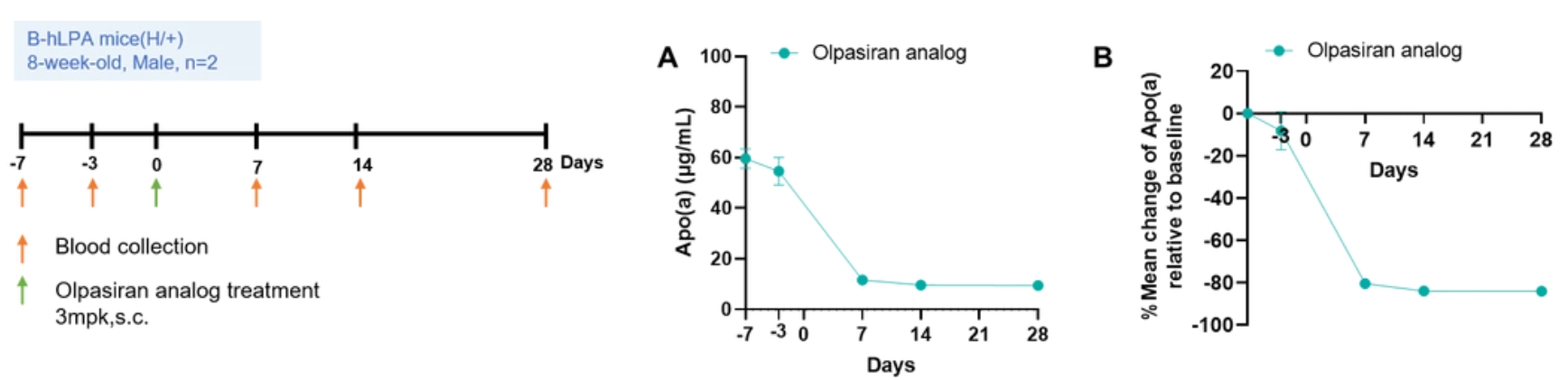
杂合B-hLPA mice对olpasiran类似物响应引起的血浆Apo(a)水平变化。如图所示,olpasiran类似物单次给药降低了杂合B-hLPA小鼠的Apo(a)浓度(A),实现了比基线(B)高达80%以上的降低。说明该小鼠可用于临床前药效评估。
B-hLPA mice plus
品系名称:C57BL/6-Gt(ROSA)26Sortm2(LPA)Bcgen/Bcgen
背景:C57BL/6
货号:112845
该小鼠携带人LPA基因的完整编码区及UTR区。
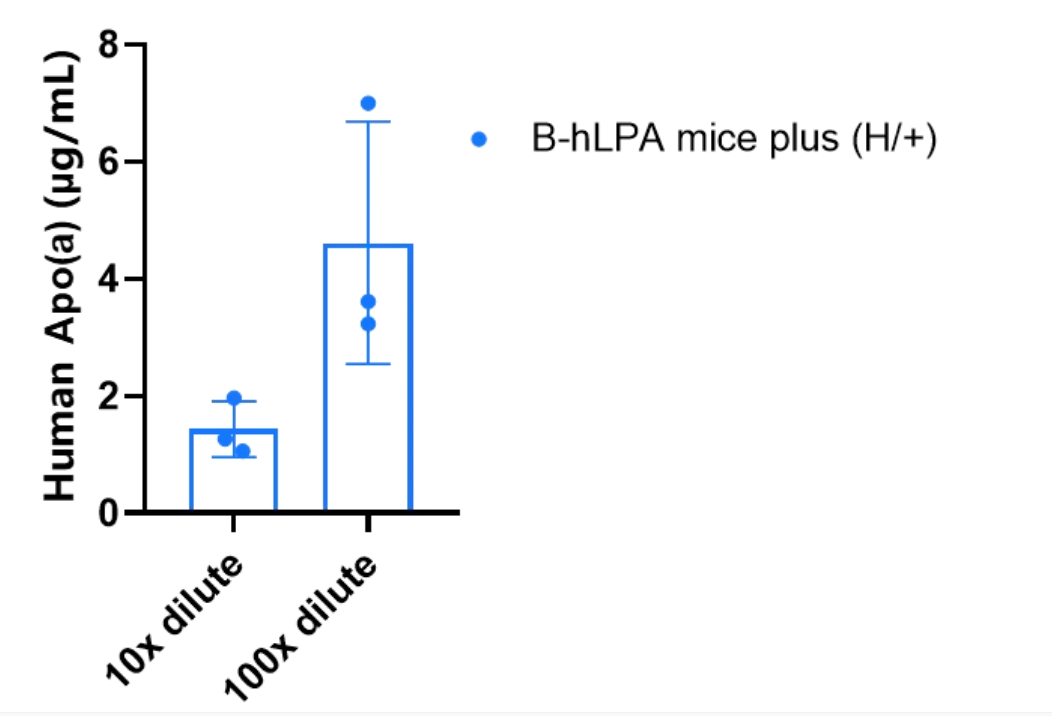
B-hLPA mice plus小鼠的种属特异性Apo(a)的ELISA蛋白表达分析。在杂合B-hLPA mice plus (H/+)(n=3,雌性,6周龄)中可检测到人Apo(a)的表达。
未来,我们还将开发LPA和APOB双人源化小鼠。
参考资料:
1. Tasdighi, Erfan et al. “LP(a): Structure, Genetics, Associated Cardiovascular Risk, and Emerging Therapeutics.” Annual review of pharmacology and toxicology vol. 64 (2024): 135-157. doi:10.1146/annurev-pharmtox-031023-100609
2. Nordestgaard, Børge G et al. “Lipoprotein(a) as a cardiovascular risk factor: current status.” European heart journal vol. 31,23 (2010): 2844-53. doi:10.1093/eurheartj/ehq386
3. Tsimikas, Sotirios et al. “Lipoprotein(a) Reduction in Persons with Cardiovascular Disease.” The New England journal of medicine vol. 382,3 (2020): 244-255. doi:10.1056/NEJMoa1905239
4. https://www.amgen.com/newsroom/press-releases/2023/08/amgen-presents-late-breaking-phase-2-olpasiran-data-at-esc-2023
5. Nissen, Steven E et al. “Lepodisiran, an Extended-Duration Short Interfering RNA Targeting Lipoprotein(a): A Randomized Dose-Ascending Clinical Trial.” JAMA vol. 330,21 (2023): 2075-2083. doi:10.1001/jama.2023.21835
6. https://www.businesswire.com/news/home/20240313160113/en/Silence-Therapeutics-Announces-Positive-Topline-36-Week-Data-from-Ongoing-Phase-2-Study-of-Zerlasiran-in-Patients-with-High-Lipoprotein-a
7. Nicholls, Stephen J et al. “Muvalaplin, an Oral Small Molecule Inhibitor of Lipoprotein(a) Formation: A Randomized Clinical Trial.” JAMA vol. 330,11 (2023): 1042-1053. doi:10.1001/jama.2023.16503
8. https://ir.vervetx.com/news-releases/news-release-details/verve-establishes-global-collaboration-lilly-advance-verves-vivo






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号