TIPS
司美格鲁肽获批时间节点及适应症:
2017年12月,美国食品与药物管理局(FDA)批准司美格鲁肽注射液上市,用于成人2型糖尿病患者的血糖控制。
2020年1月,FDA批准用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件风险。
2021年4月,国家食品药品监督管理局(NMPA)批准,用于治疗成人2型糖尿病及降低T2DM合并心血管疾病患者的心血管不良事件风险。
2021年6月,FDA批准司美格鲁肽用于治疗肥胖(每周皮下注射1次的2.4 mg)。
2021年11月,欧洲药品管理局(EMA)批准用于治疗有至少一种体重相关合并症(如2型糖尿病、高血压或CV疾病)的慢性肥胖患者。
2023年1月,FDA批准新适应症:作为低热量饮食和增加体力活动的辅助药物,用于年龄和性别(肥胖)初始体重指数(身体质量指数)在95%或以上的12岁及以上儿科患者的慢性体重管理。
司美格鲁肽是一种胰高血糖素样肽-1受体激动剂(GLP-1 RA),通常缩写为GLP-1 RA,可模拟体内自然产生的胰高血糖素样肽-1 (GLP-1)的作用。GLP-1通过刺激胰岛素分泌和抑制胰高血糖素释放来调节血糖水平。司美格鲁肽除了具有刺激葡萄糖依赖性胰岛素分泌和抑制胰高血糖素释放的能力外,还可降低食欲及对高脂食物的偏好。这些特性促使人们研究其在体重管理和治疗心血管(CV)类疾病风险方面的潜力,从而将其治疗范围扩大到控制血糖之外。
糖尿病、胰岛素抵抗和肥胖是非酒精性脂肪性肝炎(NASH)的病理表现。大脑中的胰岛素抵抗也是神经变性和认知功能受损的原因。多项临床前和临床研究揭示了司美格鲁肽在NASH中的肝保护作用,以及在神经退行性疾病(如帕金森病和阿尔茨海默病)中的神经保护作用。司美格鲁肽有望成为一种具有多种治疗用途的药物。
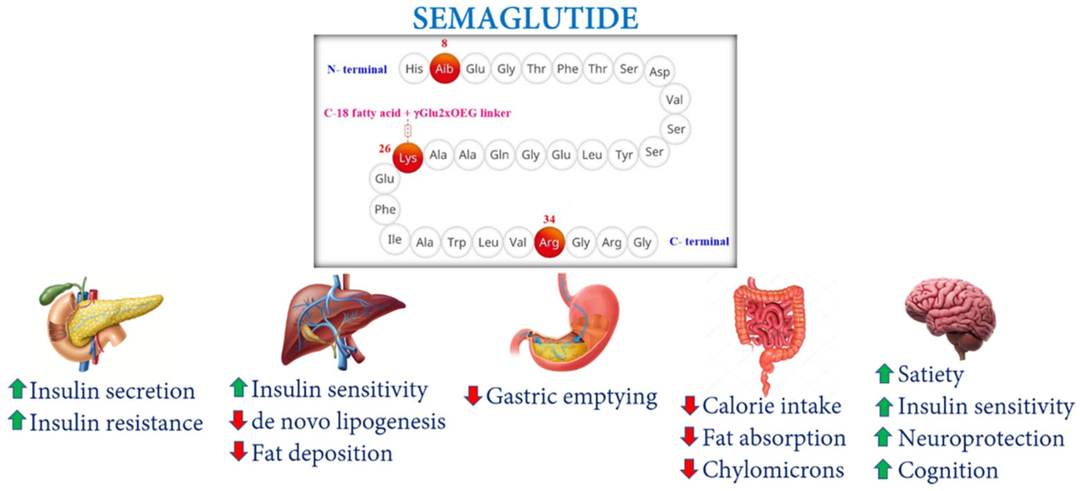
图1. 司美格鲁肽治疗肥胖、NASH和神经退行性疾病的机制[1]
1、GLP-1/GLP-1R简介
胰高血糖素样肽-1 (GLP-1)是一种由远端回肠和结肠L细胞在进食后分泌的肠促胰岛素。该分子的合成是通过许多激素前转化酶对前胰高血糖素分子进行蛋白水解产生。前胰高血糖素的裂解可产生两种30或31个氨基酸长的活性肽:GLP-1(7-36)-NH2(最常产生的分子)和GLP-1(7-37)(第二最常产生的分子)。GLP-1的半衰期很短(约2分钟),这是由于二肽基肽酶-4 (DPP-4,一种丝氨酸氨基肽酶)的作用,以及其低分子量可以被肾脏清除。
GLP-1通过与GLP-1R结合发挥生物学效应,GLP-1R属于跨膜G蛋白偶联受体B家族,最初发现于胰岛B细胞但广泛表达在胰腺外组织,包括肺、肾、中枢神经系统、肠神经系统、淋巴细胞、血管和肾脏。GLP-1和GLP-1R之间的相互作用激活不同的下游信号分子,发挥多种生理功能,包括促进胰岛素合成和分泌、抑制胰岛细胞生成和释放胰高血糖素、减少肝糖原输出、作用于中枢神经系统、增加饱腹感、减少摄食量。GLP-1在肾脏的作用包括轻度的钠尿。GLP-1能增加心脏的收缩力和心率,并具有保护血管的效果。
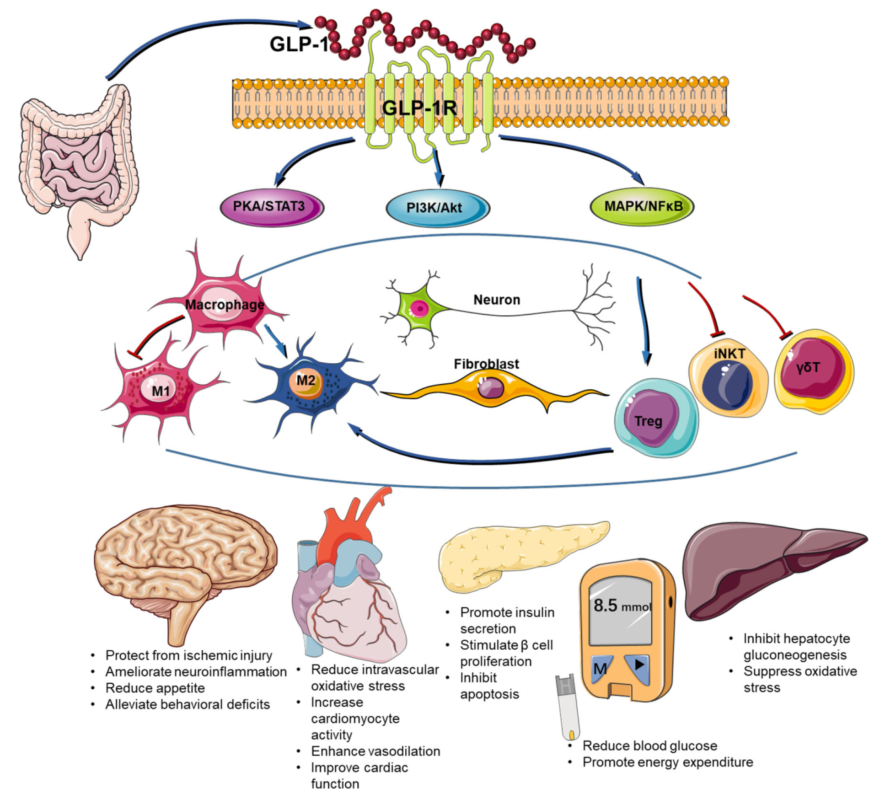
图2. GLP-1/GLP-1R免疫调节机制[2]
2、、GLP-1R激动剂
GLP-1R激动剂(GLP-1RAs)是GLP-1类似物,对DPP-4介导的降解具有抵抗性,根据作用时间和注射量可分为短效和长效制剂。短效制剂包括贝那鲁肽(BN)和艾塞那肽(EX) ,一般需要每天注射2 ~ 3次;长效制剂包括利西拉肽(LIXI)和LIR,每天注射一次。司美格鲁肽(SMG)、度拉鲁肽(DUL)、艾塞那肽长效释放制剂(EXLAR)和聚乙二醇洛塞那肽(PEX-168),一般需要每周注射1次。
司美格鲁肽(C187H291N45O59)与天然GLP-1的结构相似性为94%,可安全地用于患肾脏、肝脏或心血管(CV)疾病的成人和老年患者。司美格鲁肽作为Ozempic®(皮下注射,每周一次剂量;0.5、1.0 mg剂量)和Rybelsus®(口服片剂,每日一次给药;3、7、14 mg剂量),均被美国食品药品监督管理局,加拿大卫生部,欧洲药品管理局,日本卫生部批准用于治疗2型糖尿病。
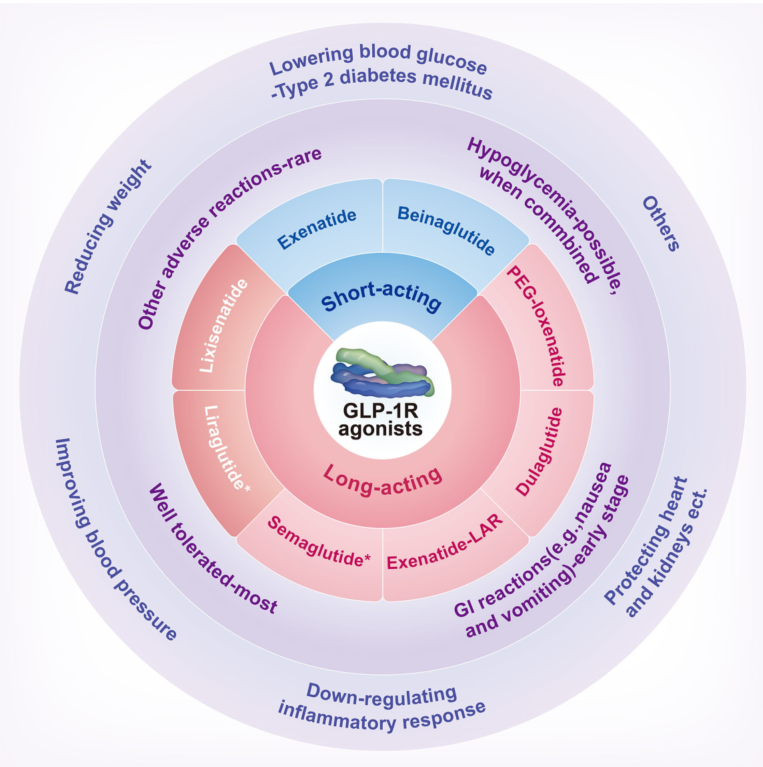
图3. GLP-1受体激动剂分类、药物安全性和有效性概括。Gl,胃肠道、肠胃;GLP-1R,胰高血糖素样肽-1受体;PEG,聚乙二醇。*利拉鲁肽和司美格鲁肽已被美国食品药品监督管理局批准用于减肥。[3]
3、司美格鲁肽研究进展
抗肥胖作用
与度拉鲁肽和利拉鲁肽相比,司美格鲁肽在各种3期SUSTAIN和PIONEER试验中显示出显著的减重特性。这些结果鼓励了研究者们进行每周一次皮下注射司美格鲁肽的试验,以探索更好地治疗肥胖。研究显示,体重减轻的原因是由于能量摄入减少,司美格鲁肽不影响能量消耗,也不提高静息代谢率。它还可改善食物摄入的享乐特征,即增强饱腹感以减少对食物的渴望,减少对高脂肪食物的喜爱。虽然肠道-大脑通信参与了司美格鲁肽介导的降低食欲和能量摄入,但具体机制仍不清楚。
非酒精性脂肪性肝炎(NASH)
在不饮酒或少量饮酒的情况下,过量脂肪在肝细胞内蓄积,通常被称为非酒精性脂肪性肝病(NAFLD),可进展为肝硬化甚至肝细胞癌。根据病理结果可分为两种类型:单纯性脂肪变性或伴有肝细胞气球样变的非酒精性脂肪肝(NAFL)或不伴有肝细胞气球样变的非酒精性脂肪性肝炎(NASH)。
糖尿病、肥胖、高血压、动脉粥样硬化和血脂异常等各种代谢综合征通常与NAFLD相关。但迄今为止,除了饮食和生活方式管理之外,还没有任何治疗方法被批准用于NASH/NAFLD。有报道NASH患者的GLP-1分泌受损,各种GLP-1受体激动剂如利拉鲁肽、度拉鲁肽、司美格鲁肽被证明可改善NASH的发病机制。司美格鲁肽可通过刺激GLP-1受体和减轻炎症来减少肝脂肪变性,许多试验已经在研究司美格鲁肽治疗NASH/NAFLD的有效性。司美格鲁肽单药治疗或联合治疗是成功治疗NASH的一线希望。
神经退行性疾病
帕金森和阿尔茨海默症是进行性神经退行性疾病的常见形式,会使人丧失精神能力。GLP-1受体存在于脑内,还参与认知、海马神经元的突触传递和细胞凋亡。该受体的过度表达负责认知增强和神经保护,而缺乏则增加癫痫发作和神经变性的机会。因此,GLP-1受体被认为是探索神经保护和认知增强能力的有效靶点。
基于药物再利用策略,研究者们关注了FDA已批准的具有安全性的GLP-1受体激动剂,以探索其的神经保护作用。但迄今为止没有数据证实司美格鲁肽可通过人类的血脑屏障(BBB)。然而,有报道非蛋白形式的司美格鲁肽可能通过BBB中的渗漏进入脑内的GLP-1受体,从而执行其中枢介导的作用。
百奥动物在C57BL/6、B-ob/ob小鼠上构建了肥胖和糖尿病小鼠模型,并使用司美格鲁肽进行了药效验证,结果显示我们构建的肥胖和糖尿病小鼠模型非常适合用于临床前药物疗效研究。
4、高脂饮食诱导肥胖(DIO)小鼠模型
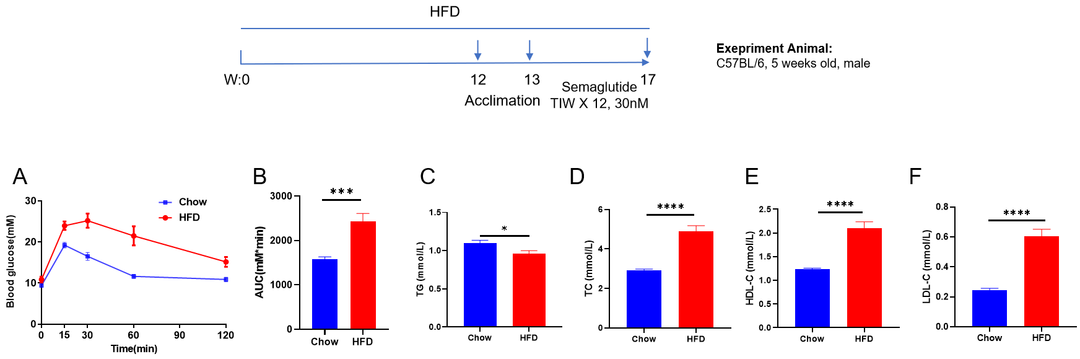
高脂饮食诱导肥胖(DIO)小鼠模型。(A-B)HFD诱导后的葡萄糖耐受能力。(B)A曲线下面积。(C-F)HFD诱导后的血生化分析。数据以平均值±SEM表示。N=10只/组,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
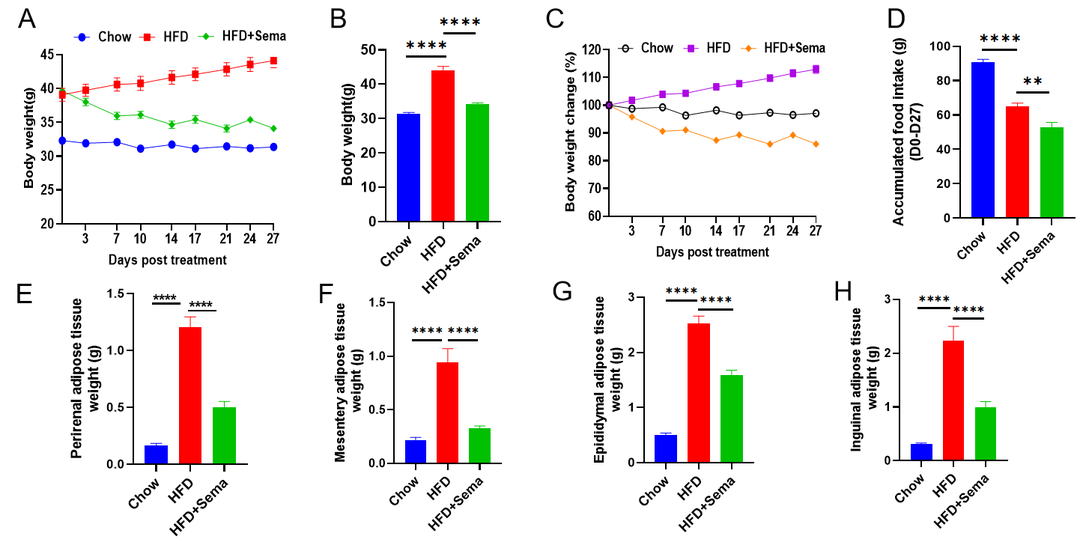
司美格鲁肽在高脂饮食诱导的小鼠模型中的药效研究。(A-C)Semaglutide治疗后的体重变化和终末体重。(D)治疗期间的累计食物摄入量。(E-H)治疗后的脂肪组织重量。数据以平均值±SEM表示。N=10只/组,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
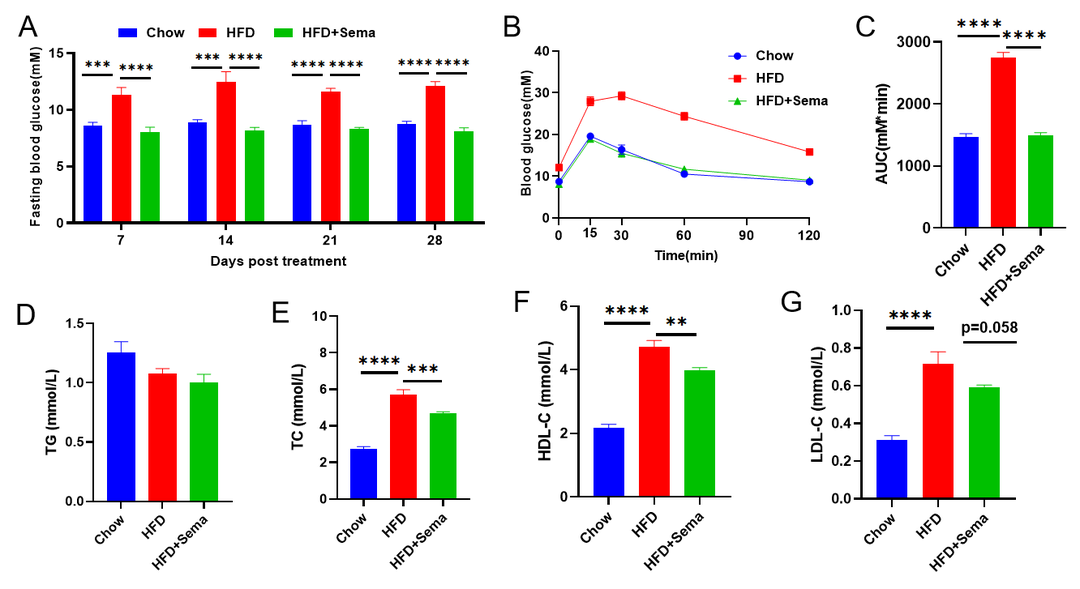
司美格鲁肽在高脂饮食诱导的小鼠模型中的药效研究。(A)Semaglutide治疗后血糖变化。(B)治疗后的葡萄糖耐受能力。(C)B曲线下面积。(D-G)治疗后血生化分析曲线。数据以平均值±SEM表示。N=10只/组,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
5、GAN饮食诱导的NASH小鼠模型
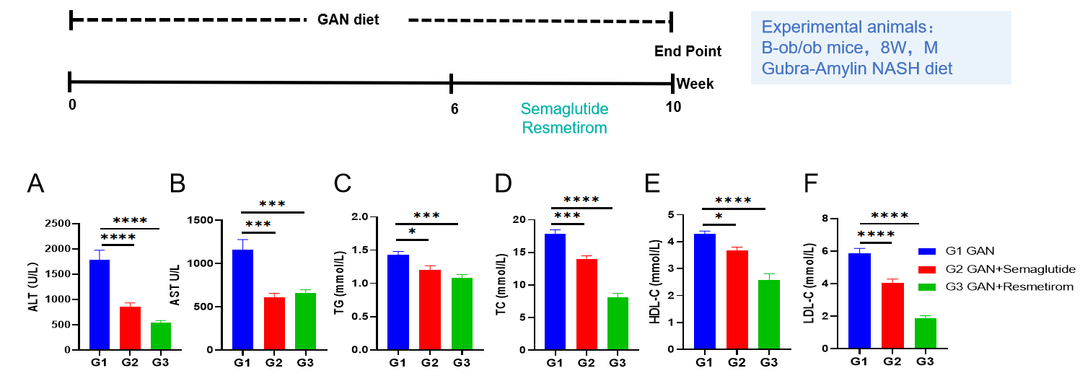
Gubra-Amylin饮食诱导B-ob/ob小鼠NASH模型。(A-B)造模组和治疗组ALT和AST水平。(C-F)建模和治疗组的TG、TC、HDL-C、LDL-C水平。数据表示为平均值±SEM。N=9只/组,*p<0.05,**p<0.01,***p<0.001。
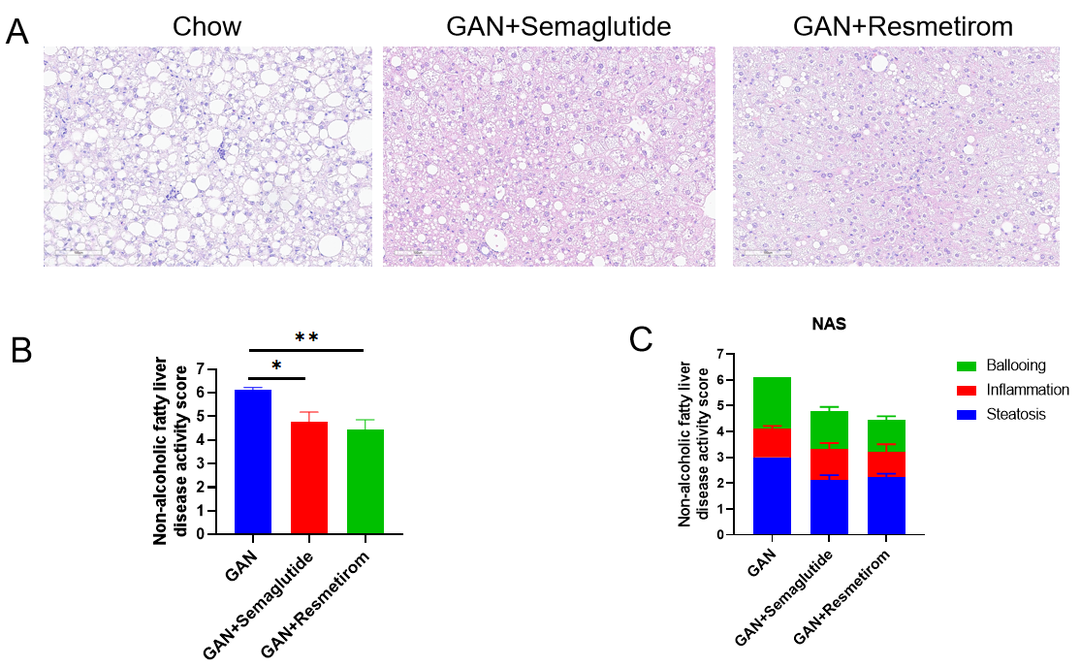
司美格鲁肽和Resmetirom降低了GAN饮食诱导的B-ob/ob小鼠的NAS评分。(A)H&E染色显示NASH程度的代表性图片。(B-C)由外部病理专家评估的NAFLD活动评分(NAS)。数据表示为平均值±SEM。N=9只/组,*p<0.05,**p<0.01。
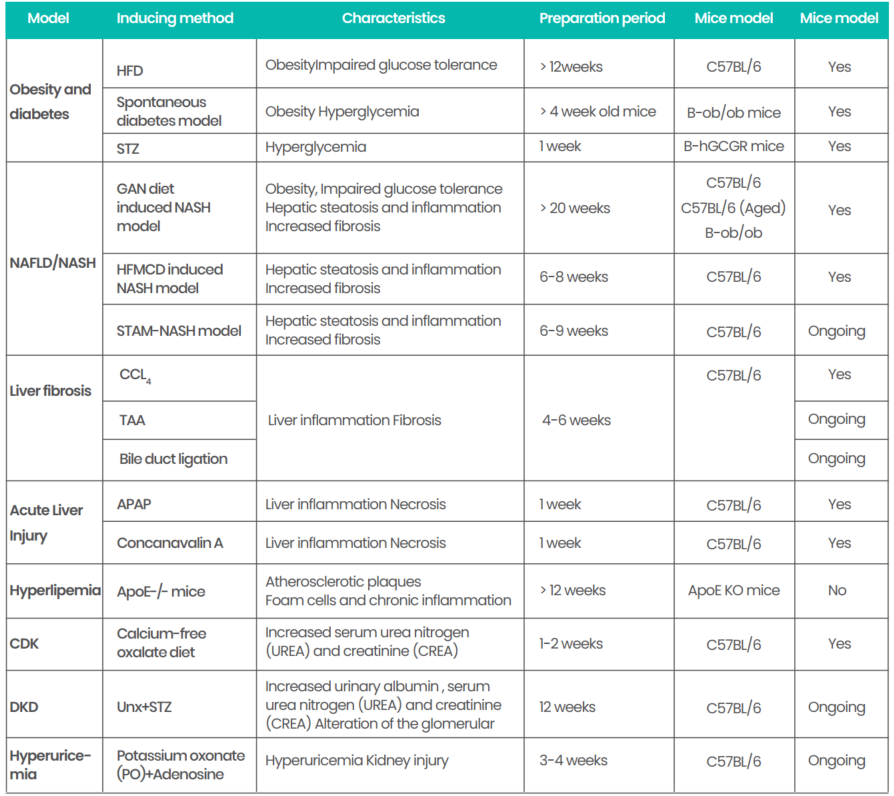
6、百奥动物代谢类疾病模型汇总
参考资料
[1].https://doi.org/10.1007/s11095-022-03302-1
[2].DOI:10.3389/fimmu.2022.997578
[3].DOI:10.3389/fendo.2023.1085799
[4].https://doi.org/10.3390/ijms23020739
[5].DOI:10.7759/cureus.46510
[6].https://www.novonordisk.com.cn/






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号