骨骼的生长、发育和和代谢是成骨细胞和破骨细胞共同作用的结果。骨重建过程包括破骨细胞分泌蛋白酶、消化骨基质的骨吸收过程和成骨细胞分泌骨基质、形成新骨的过程。破骨细胞和成骨细胞的功能平衡是维持正常骨量的关键。如果骨形成与骨吸收的平衡被打破,极易造成骨量丢失,进而导致骨质疏松等疾病。
因此,研究对成骨细胞和破骨细胞的分化、活性和功能的调控机制对于更好地了解骨质疏松的发病原理以及发现新的治疗方案至关重要。
骨骼发育中的信号通路
成骨细胞谱系的分化受多种信号通路调节(图1)。Hedgehog信号通路,Notch信号通路,经典的WNT信号通路,BMP信号通路,FGF信号通路等,这些途径以协调的方式起作用,以确保适当的骨骼发育和修复。
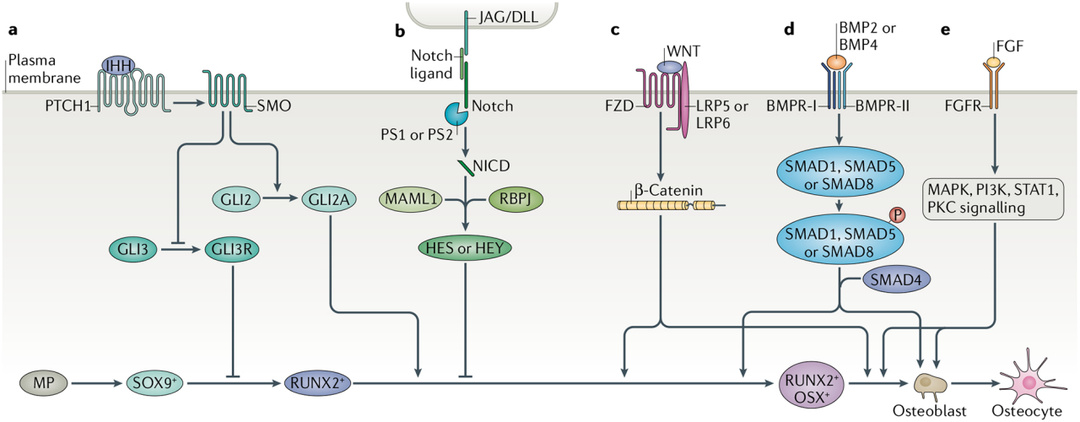
图1 调节成骨细胞分化的发育信号通路[1]
从干细胞分化为成熟的成骨细胞需要许多步骤。间充质干细胞(MSCs)和骨骼干细胞(SSCs)均可产生成骨细胞。然而,这两个干细胞群之间的关系尚未精确确定。因此,为了研究每种中间细胞类型的功能,可使用转基因小鼠来了解谱系指定过程。Cre重组酶(Cre)–loxP系统可实现条件基因的失活,从而Cre切除与目标基因相对应的“目标” DNA序列,该序列侧翼有两个称为“ loxP位点”的34bp DNA序列。百奥动物发开了B-Sp7-iCre mice、B-Prrx1-iCre mice、B-Col2a1-iCre mice、B-Dmp1-iCre mice等可用于研究成骨细胞分化过程中特定细胞类型的Cre工具鼠模型。
B-Sp7-iCre mice
模型应用
当Sp7iCre模型与不同loxP位点侧翼基因的小鼠杂交时,它是研究此基因功能的有效工具,特别是在骨发育、成骨细胞谱系和Hedgehog/Wnt信号传导的研究中。
表达
1)表达的基因
iCre,改良的Cre重组酶,噬菌体P1
2)表达部位
成骨细胞谱系,胚胎软骨膜,骨小梁,骨领
基因编辑策略
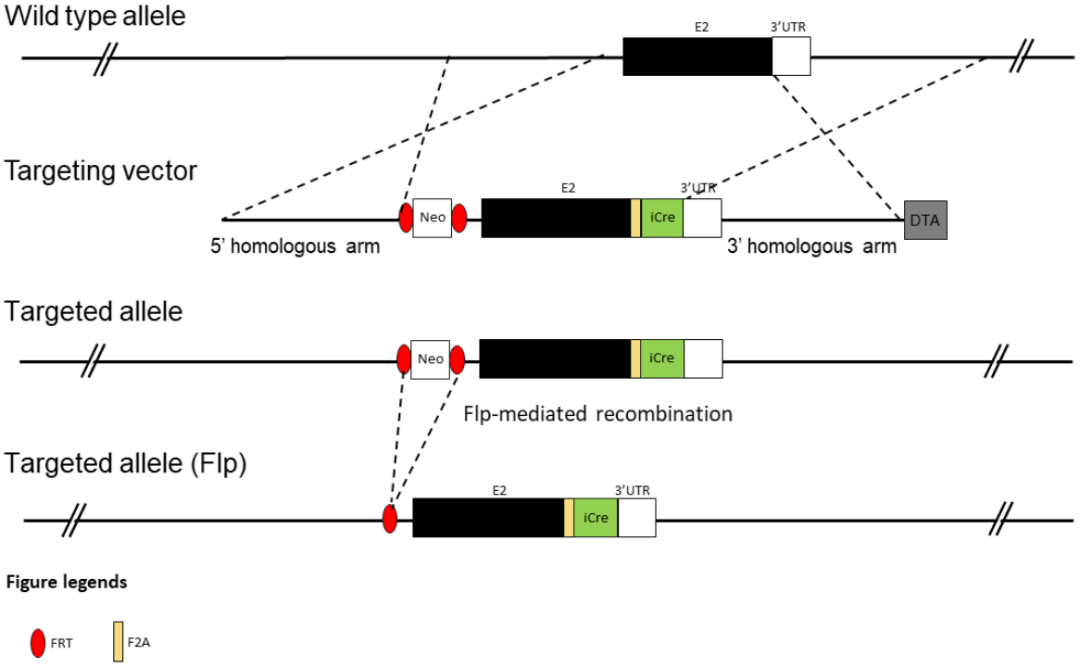
在C57BL/6 ES细胞Sp7基因外显子2和3'UTR编码序列之间放置F2A-iCre序列盒。该种属保持在C57BL/6遗传背景上。
表型分析
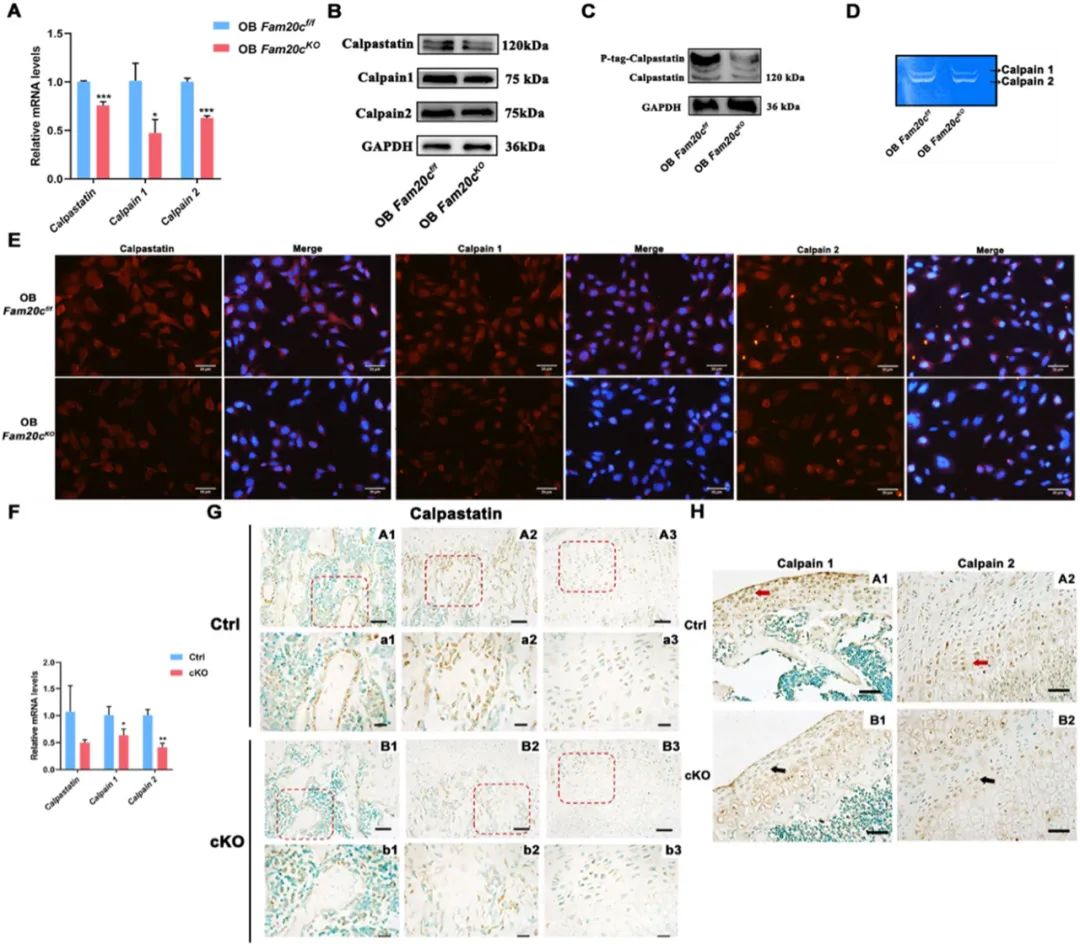
图2 Fam20c影响Calpastatin/Calpain蛋白水解系统
如上图,A.Calpastatin、Calpain 1和Calpain 2在OB Fam20cf/f和OB Fam20cKO的表达(qPCR)。*P<0.05、***P<0.001。B.通过Western blot分析Calpastatin、Calpain 1和Calpain 2在Fam20cf/f和OB Fam20cKO的表达。GAPDH作为内部对照。C.Phos-Tag十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(P-Tag)证明Fam20cf/f和OB Fam20cKO中的钙蛋白酶抑制剂磷酸化水平。GAPDH作为内部对照。D.Calpain 1和Calpain 2在Fam20cf/f和OB Fam20cKO中的酪蛋白酶谱图。E.Fam20cf/f和OB Fam20cKO中Calpastatin、Calpain 1和Calpain 2的免疫荧光染色。比例尺=20μm。F.Calpastatin、Calpain 1和Calpain 2在Ctrl和cKO小鼠股骨中的基因表达。*P<0.05,**P<0.01。G.Calpastatin在4周龄的Ctrl和cKO小鼠股骨中的免疫组织化学染色。(A1)和(B1)是骨中的游离骨小梁。(A2)和(B2)是钙化软骨中的骨形成部位。(A3)和(B3)是软骨增殖区和肥大区的交界处。红框表示局部放大,比例尺=50μm。(a1)、(a2)、(a3)、(b1)、(b2)、(b3)是相应的放大区域,比例尺=20μm。H.4周龄Ctrl和cKO小鼠股骨中Calpain 1 和 Calpain 2的免疫组织化学染色。比例尺=50μm。
实验结果表明Calpain1和Calpain2基因的表达显著降低(图2F)。免疫组织化学(IHC)染色分析显示,在cKO小鼠的骨小梁表面和软骨钙化区的前成骨细胞中,Calpastatin免疫反应性较低(图2G)。对于Calpain1和Calpain2的表达,IHC染色显示免疫反应性显著降低(图2H)。[2]
发表文章
Distinct roles for Hedgehog and canonical Wnt signaling in specification, differentiation and maintenance of osteoblast progenitors.
B-Prrx1-iCre mice
模型应用
当Prrx1iCre模型与不同loxP位点侧翼基因的小鼠杂交时,它是研究此基因功能的有效工具,特别是在研究中胚层发育,如心脏、骨骼发育和信号传导方面。
表达
1)表达的基因
iCre,改良的Cre重组酶,噬菌体P1
2)表达部位
老鼠胚胎、心脏、骨骼和成人平滑肌组织的中胚层
基因编辑策略
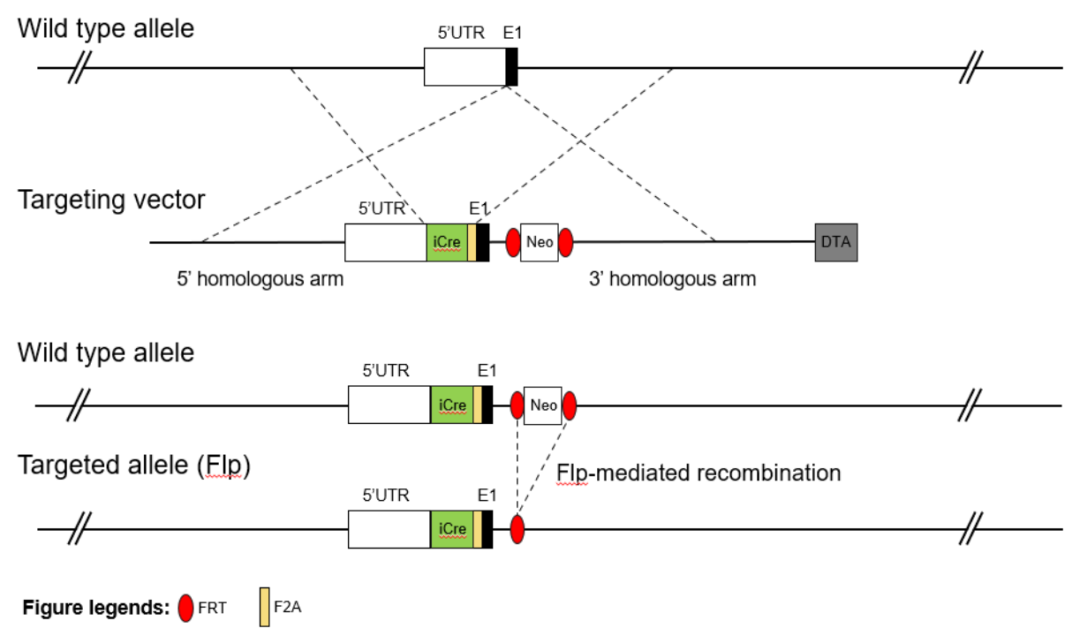
在C57BL/6 ES细胞Prrx1基因外显子1和5'UTR编码序列之间放置F2A-iCre序列盒。该种属保持在C57BL/6遗传背景上。
表型分析
将Prrx1-Cre (C57BL/6-Prrx1tm1(iCre)/Bcgen) (来自百奥赛图)小鼠与ALPL-floxed等位基因杂合的小鼠进行配对获得组织特异性Cre介导的ALPL敲除模型。
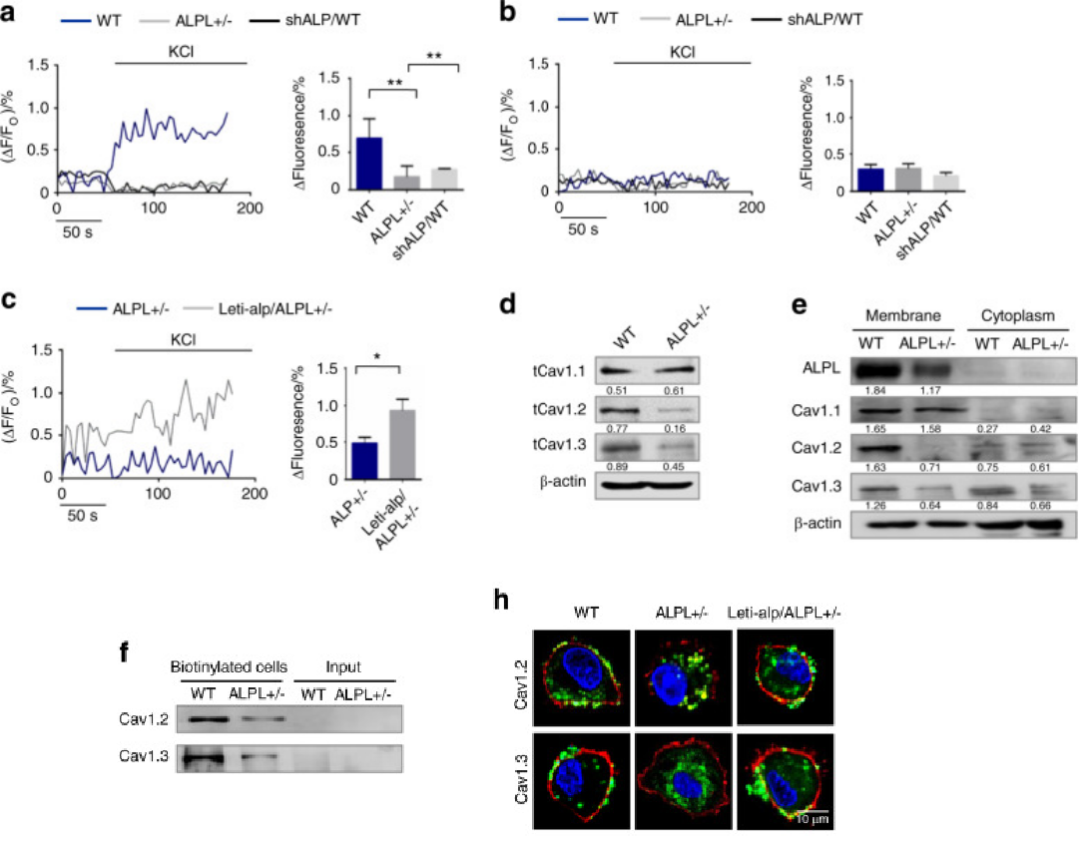
ALPL缺乏导致骨髓间充质干细胞中l型Ca2+通道的膜表达降低。a. Ca2+成像显示,转染shALP的alpl+/−BMSCs和WT BMSCs (shALP/WT)在30 mmol·L−1 KCl刺激3 min (n = 10)后,Ca2+内流减少。b .经10 mmol·L−1 EGTA处理3 min(n = 10),培养的WT、alpl+/−和shALP/WT BMSCs均未检测到KCl诱导的Ca2+内流。c. 在alpl+/−(Lenti-alp/alpl+/−)骨髓间充质干细胞中,ALPL过表达是由慢病毒介导的,在30 mmol·L−1 KCl刺激3min(n = 10)后,导致Ca2+内流升高。d、e.评估CaV1.1、CaV1.2、CaV1.3的表达。alpl+/−BMSCs的细胞总表达量减少(d)和CaV1.2、CaV1.3的膜表达量(e) ,细胞质CaV1.2和CaV1.3表达水平没有明显变化(e),在alpl+/−BMSCs中,总CaV1.1蛋白表达没有改变(d),膜和细胞质CaV1.1的表达没有改变(e)。f.细胞表面生物素化实验。左两个通道:western blot检测WT和alpl+/−BMSCs中中性蛋白下调后的CaV1.2和CaV1.3;右两个通道:输入,而不是生物素化细胞。h.共聚焦激光扫描显微镜代表性图像,显示WT和Lenti-alp/alpl+/−BMSCs中CaV1.2和CaV1.3的膜位置(绿色)。用标记物CellMask™Deep Red plasma membrane Stain(红色)(h)对质膜进行染色。比尺,10 μm。[3]
发表文章
Ionomycin ameliorates hypophosphatasia via rescuing alkaline phosphatase deficiency-mediated L-type Ca2+ channel internalization in mesenchymal stem cells.
参考文献:
[1] Salhotra A , Shah H N , Levi B ,et al.Mechanisms of bone development and repair[J].Nature Reviews Molecular Cell Biology, 2020, 21(11).DOI:10.1038/s41580-020-00279-w.
[2] Fam20cregulates the calpain proteolysis system through phosphorylating Calpasatatin to maintain cell homeostasis[J].Journal of Translational Medicine, 2023, 21(1).DOI:10.1186/s12967-023-04275-4.
[3] Jin Y , Li B , He X ,et al.Ionomycin Ameliorates Hypophosphatasia via Rescuing Alkaline Phosphatase Deficiency-mediated L-type Ca2+ Channel Internalization in Mesenchymal Stem Cells[J].Bone Research[2023-10-30].DOI:10.1101/545418.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号