近几十年,肿瘤的治疗方法实现了数次跃迁。起初,基于肿瘤细胞快速扩增的特性开发了化疗和放疗方法。接着,随着现代细胞生物学的发展,人们鉴定出若干肿瘤驱动分子,进而开发了肿瘤靶向治疗。与化疗和放疗相比,靶向治疗可以更精准的靶向癌细胞,减小药物毒性。
小分子和抗体药物是靶向治疗的两种主要药物形式。小分子抑制剂通过结合靶蛋白特定口袋来抑制靶蛋白的功能。其靶点多为蛋白激酶,也有关于DNA损伤修复、表观遗传、细胞凋亡、肿瘤代谢等的靶点[1,2]。2001年美国FDA批准了第一款酪氨酸激酶抑制剂伊马替尼。近些年,一些难以靶向的靶点,比如KRAS,也有药物实现获批。小分子药物有若干优势:体积小、可以穿过细胞膜,具有靶向胞外和胞内靶点的能力;对肿瘤、血脑屏障的渗透性好;半衰期短,系统性毒性小;多可口服。然而,也有若干劣势,比如耐药性及疗效不佳。
肿瘤免疫治疗时代自2011年FDA批准首款免疫检查点抑制剂CTLA-4单抗,及2014年批准了首款PD-1抗体开启。通过激活抗肿瘤免疫反应来治疗肿瘤取得成功。然而,ICI治疗获益患者人群有限。化疗放疗可释放肿瘤抗原增强免疫识别;小分子通过靶向特定通路可起到免疫调节的作用。于是,放化疗、小分子、抗体联合治疗应运而生,从T细胞识别、激活、环境多角度共同加强抗肿瘤效果[3,4]。
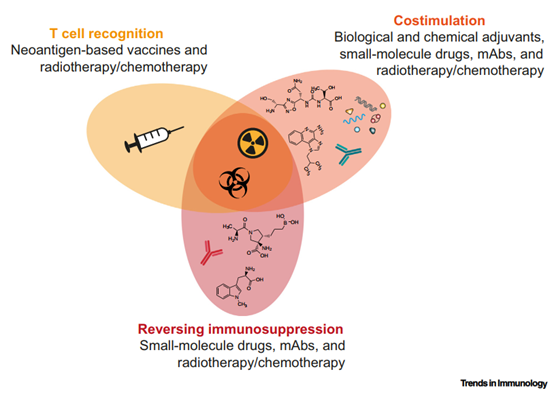
图1. 癌症免疫疗法的组合方式[3]
为了更好的对小分子及组合疗法进行体内药效评估,百奥动物开发了一系列小鼠及细胞模型。
同源模型用于化疗+抗体联合治疗药效评估
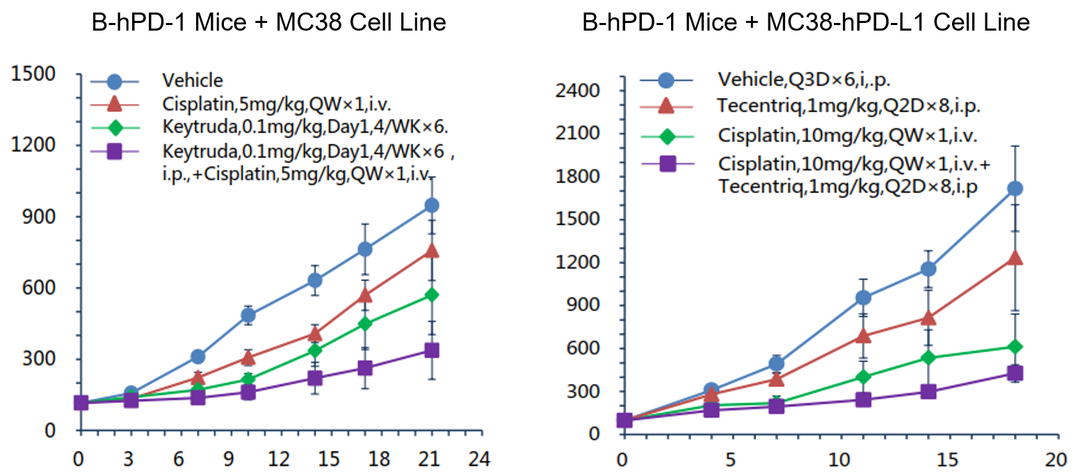
(A)PD-1抗体(Kytruda)与顺铂联合在B-hPD-1小鼠+MC38细胞系同源模型中的药效评估。(B)PD-L1抗体(Tecentriq)与顺铂联合在B-hPD-1小鼠+MC38-hPD-L1细胞系同源模型中的药效评估。
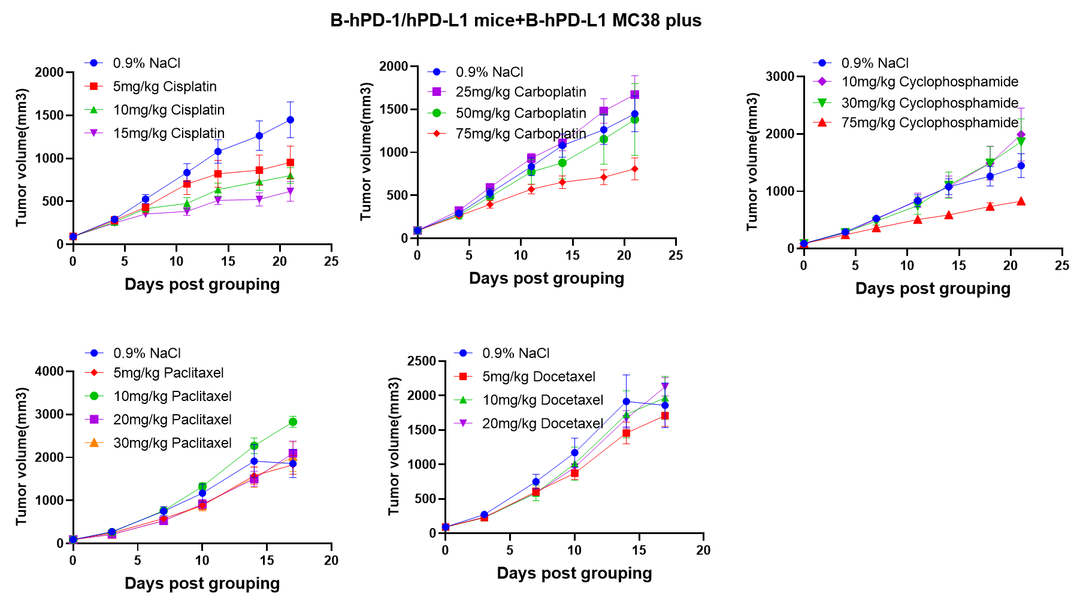
化疗药物在B-hPD-1/hPD-L1小鼠+B-hPD-L1 MC38 plus细胞系同源模型中的药效评估。为后续化疗药物与免疫检查点抗体联合治疗提供参考。
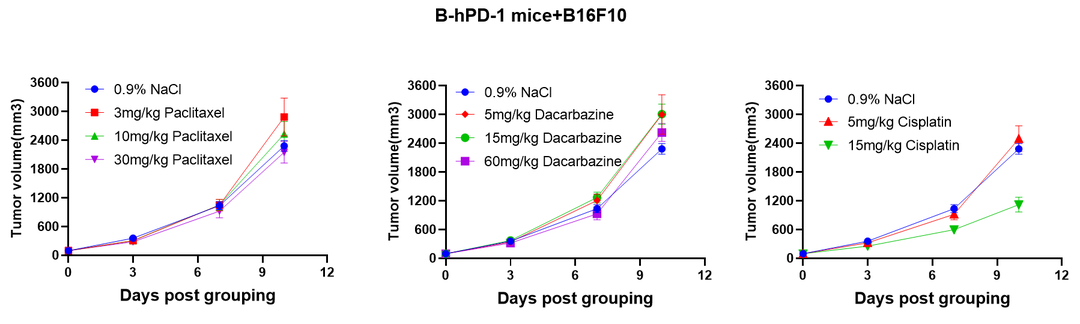
化疗药物在B-hPD-1小鼠+B16F10细胞系同源模型中的药效评估。为后续化疗药物与免疫检查点抗体联合治疗提供参考。
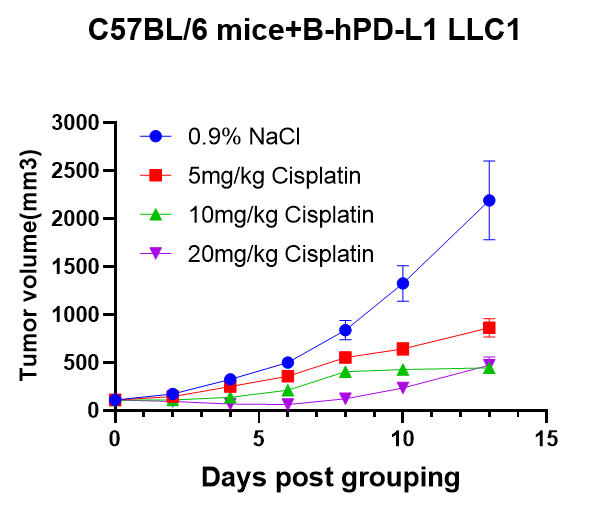
化疗药物在C57BL/6小鼠+B-hPD-L1 LLC1细胞系同源模型中的药效评估。
同源模型与CDX模型评价小分子(联合)疗法项目经验
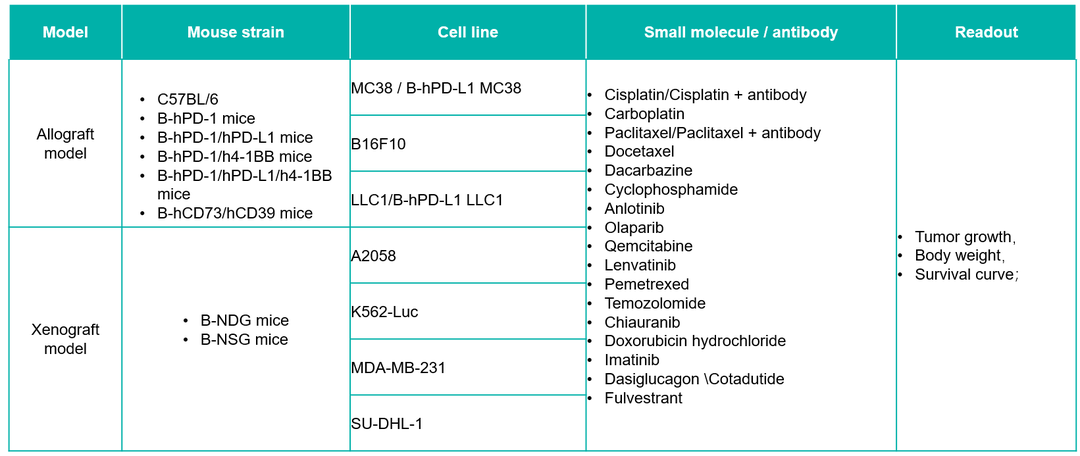
20+化疗及化疗+抗体联合治疗项目经验
20+小分子抑制剂项目经验,包括PARP, VEGFR, TKI, FGFR, Folic acid, BAR-ABL等。
PDX模型用于化疗药效评估
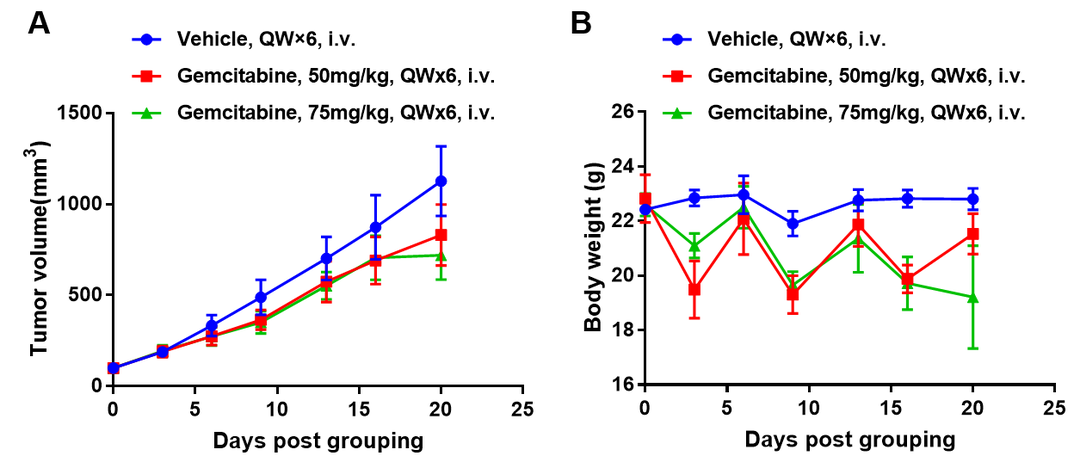
吉西他滨在PDX模型中的抗肿瘤药效。将BP0062皮下植入免疫缺陷B-NDG小鼠构建PDX模型(雌性,6周龄,n=6)。当肿瘤生长至100mm3时分组给药。(A)治疗后肿瘤体积变化;(B)治疗后小鼠体重变化。数值为平均值±SEM。如图所示,小分子化疗药可有效抑制含有EGFR阳性细胞的胰腺癌BP0062 PDX生长。
PDX模型用于小分子靶向药药效评估
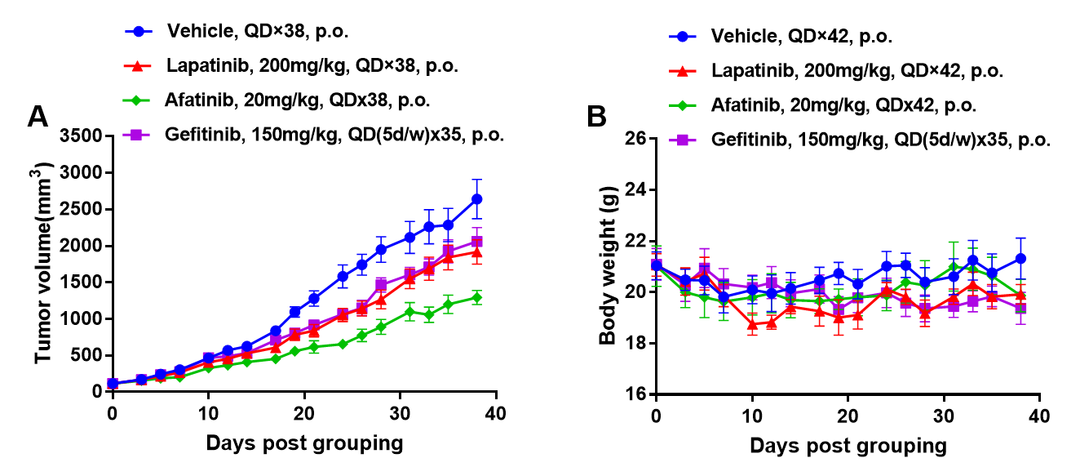
EGFR靶向药在PDX模型中的抗肿瘤药效。将BP0062皮下植入免疫缺陷B-NDG小鼠构建PDX模型(雌性,6周龄,n=6)。当肿瘤生长至100mm3时分组给药。(A)治疗后肿瘤体积变化;(B)治疗后小鼠体重变化。数值为平均值±SEM。如图所示,EGFR小分子靶向药可有效抑制含有EGFR阳性细胞的胰腺癌BP0062 PDX生长。
PDX实体瘤模型评价小分子(联合)疗法项目经验
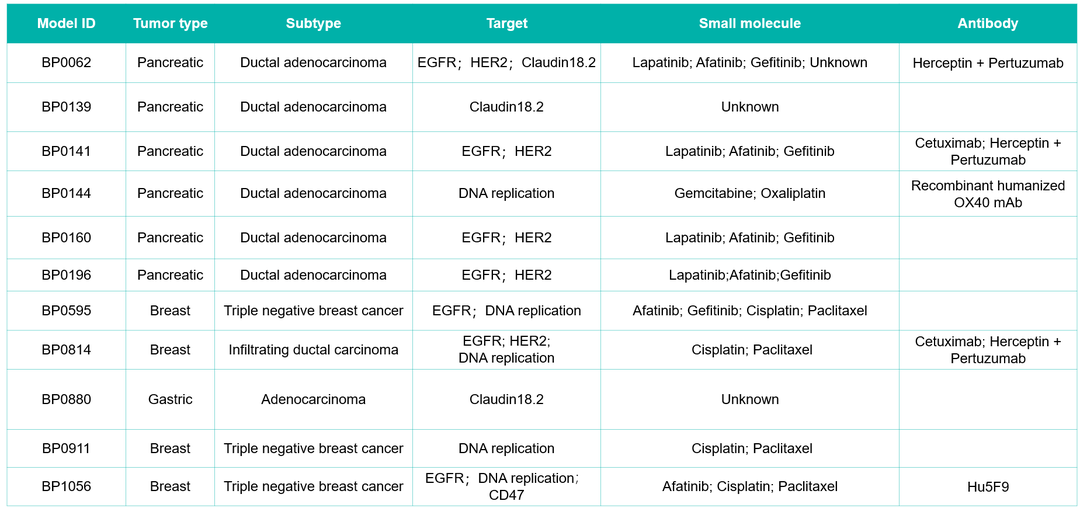
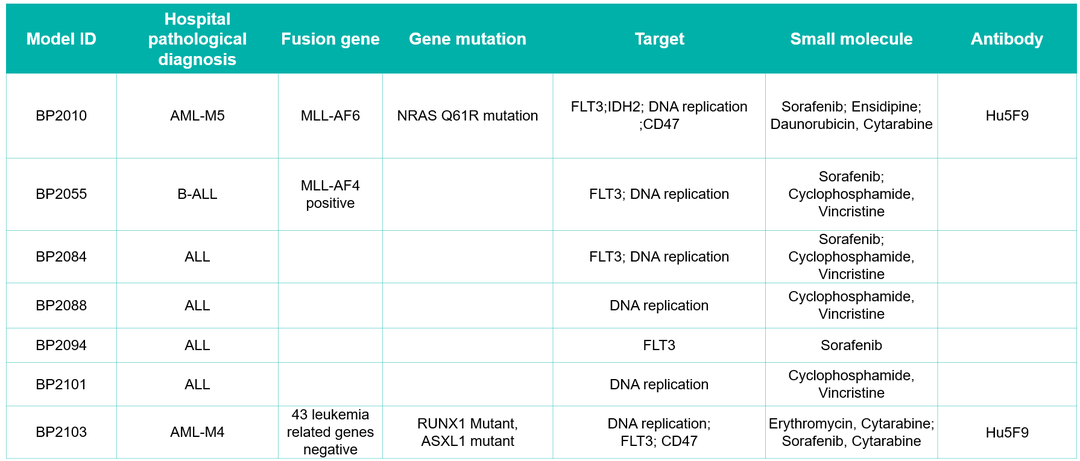
PDX血液瘤模型评价小分子(联合)疗法项目经验
参考文献
1. Liu, Gui-Hong et al. “Small molecule inhibitors targeting the cancers.” MedComm vol. 3,4 e181. 13 Oct. 2022, doi:10.1002/mco2.181
2. Zhong, L., Li, Y., Xiong, L. et al. Small molecules in targeted cancer therapy: advances, challenges, and future perspectives. Sig Transduct Target Ther 6, 201 (2021). https://doi.org/10.1038/s41392-021-00572-w
3. van der Zanden, Sabina Y et al. “Opportunities for Small Molecules in Cancer Immunotherapy.” Trends in immunology vol. 41,6 (2020): 493-511. doi:10.1016/j.it.2020.04.004
4. Yi, M., Zheng, X., Niu, M. et al. Combination strategies with PD-1/PD-L1 blockade: current advances and future directions. Mol Cancer 21, 28 (2022). https://doi.org/10.1186/s12943-021-01489-2






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号