今年6月16日合肥天港免疫药物有限公司(天港医诺)宣布,由其独立自主研发的双特异性抗体(项目代号TGI-6)获得美国FDA临床试验申请(IND)许可。紧接着,7月13日该项目又获得国家药品监督管理局药品审评中心(NMPA)受理。据介绍TGI-6是一款同时靶向肿瘤细胞表面的肿瘤相关抗原和T细胞表面的CD3分子的双特异性抗体,采用了高亲和力结合肿瘤靶点和低亲和力结合CD3的设计,在确保高杀伤活性的同时,降低了产生细胞因子风暴的风险,主要用于治疗结直肠癌和其它肿瘤相关抗原阳性的实体瘤。
CD3双特异性抗体( CD3-Bispecific Antibodies, CD3-BsAbs)是一种新兴的、有前景的免疫疗法,其已经在血液系统相关恶性肿瘤表现出强大的治疗效果,T细胞重定向疗法引起了业界广泛关注,然而,CD3-BsAbs在实体瘤中的治疗能力仍需临床验证。
CD3-BsAbs通过同时结合肿瘤细胞上表达的肿瘤相关抗原(TAA)和T细胞上的CD3发挥作用(CD3XTAA)。CD3-BsAbs将这两种细胞类型交联可以形成免疫突触,类似于天然T细胞受体(TCR)/肽-主要组织相容性复合体(MHC)复合体。这种突触可导致T细胞活化,从而分泌能够杀死肿瘤细胞的炎症细胞因子和细胞溶解分子。CD3-BsAbs的优势在于可以利用所有可用的T细胞,而不局限于肿瘤特异性T细胞,因为对于这类双抗,TCR信号传导不需要与TCR的抗原结合域结合,而是通过CD3启动。
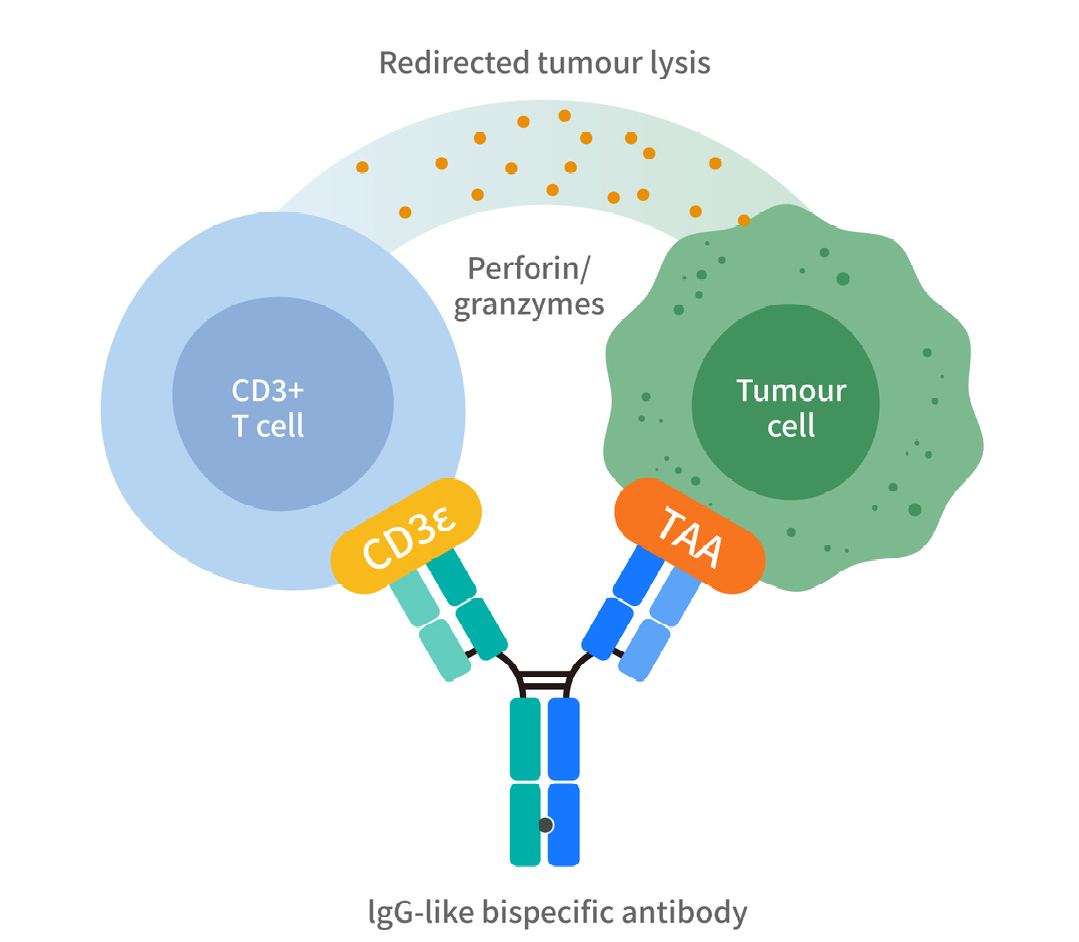
关于CD3-BsAb的结构形式科学家们已经设计出了许多种,从含有两个可变结构域的小片段(不含Fc)到常规抗体和更大的结构(含Fc)。较小的形式通常具有较短的药代动力学半衰期,大多数BsAbs使用带有突变的Fc以最大限度地降低抗体依赖性细胞介导的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)活性,确保仅在靶点存在的情况下发生交联。在CD3-BsAbs的各种结构形式中最常见的是基于Blinatumomab的串联单链可变片段(scFv),一方面因为它避免了多链结构中同源链配对的问题,另一方面则是因为它的临床成功。其他新的形式如串联双抗体(TandAb)、DART和DART-Fc、hIgG、Fab-scFv-Fc、TriFab-Fc、scFv-Fc-scFv、BEAT和TCR-αCD3也在研究中。首个获得批准的T细胞桥接型双抗(T-BsAb)使用了m/rIgG三功能形式。

不同的分子设计根据与肿瘤抗原的结合价(第一个数字)和与CD3的结合价(第二个数字)进行分组。例如,2+1表示双价肿瘤抗原结合和单价CD3结合。
CD3-BsAbs靶向实体瘤的挑战及解决方案
CD3-BsAbs成功靶向实体瘤仍然面临诸多挑战,需要克服多种并发症,包括靶基因在健康组织的表达(靶外结合毒性)、靶基因的异质性表达、免疫抑制的肿瘤环境、浸润T细胞数量少、功能障碍/耗竭T细胞的发展以及治疗药物需要渗透到肿瘤中。
寻找可被CD3-BsAbs靶向的合适TAAs非常不易,最好这些靶点只在肿瘤细胞特异性表达而在健康细胞中不表达,然而,实体瘤TAA也常表达于健康的组织中,这可能引起免疫病理和器官衰竭,严重可导致死亡。减少靶外结合毒性情况发生的解决办法:(1)人类白细胞抗原(HLA)分子可呈递由突变蛋白或肿瘤病毒蛋白衍生的小分子新抗原肽,这些肽/HLA复合物可作为高度肿瘤特异性的TAA。但缺点是大多数发现的新抗原是患者特异性的,而病毒抗原仅在一部分癌症中观察到。(2) 通过包含多个肿瘤相关抗原(TAA)结合臂的形式以增加对TAAs的亲和力,增加对健康组织以外的肿瘤靶向选择性。(3) CD3-BsAbs的结合臂用蛋白酶可切割连接子进行遮蔽,使BsAb仅在肿瘤内部活跃。在健康组织中,较少蛋白酶的存在限制了CD3臂的暴露,而在肿瘤微环境(TME)中丰富的基质金属蛋白酶(MMPs) 可让CD3-BsAb将T细胞重定向至肿瘤。(4) 通过局部注射或使用能够局部产生BsAbs的递送系统如溶瘤病毒(OVs)和STAb-T 细胞来减少全身暴露,实现CD3-BsAbs 的局部输送。
针对稀少的浸润T细胞可以采取以下解决办法:(1) 用溶瘤病毒(OV)预处理会在肿瘤中产生强烈的干扰素反应,导致局部先天和适应性免疫反应以及强烈的T细胞浸润。(2) 破坏物理性细胞外基质(ECM)屏障可以防止T细胞陷入细胞外基质(ECM),并允许其渗入肿瘤巢。(3) 靶向癌相关成纤维细胞(CAFs),去除ECM组分和免疫排斥细胞因子的主要生产者,从而改善T细胞浸润。(4) 阻断免疫排斥细胞因子可以减少限制T细胞浸润的因素,从而使肿瘤得到更好地浸润。
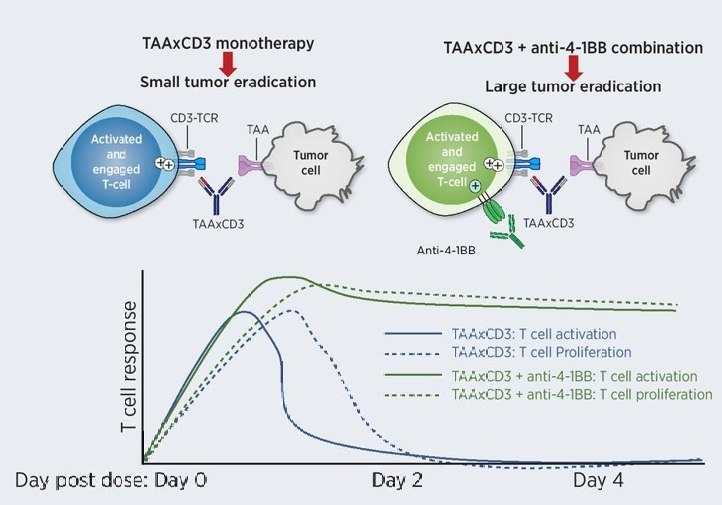
肿瘤浸润淋巴细胞(TIL)质量受损的解决方案: (1) 靶向免疫抑制细胞,如癌相关成纤维细胞(CAFs),调节性T细胞(Tregs)和肿瘤相关巨噬细胞(TAMs),减少免疫抑制性细胞因子的产生,从而减少T细胞的抑制信号,改善其效应功能。(2) 直接阻断免疫抑制细胞因子,而不是靶向其产生细胞,也能达到同样的效果。(3) 共刺激的加入为T细胞的效应功能和存活提供了正向信号。(4) 提供持续的细胞因子也可以改善T细胞功能。(5) 阻断免疫检查点可以防止T细胞功能障碍,并增强抗肿瘤反应。
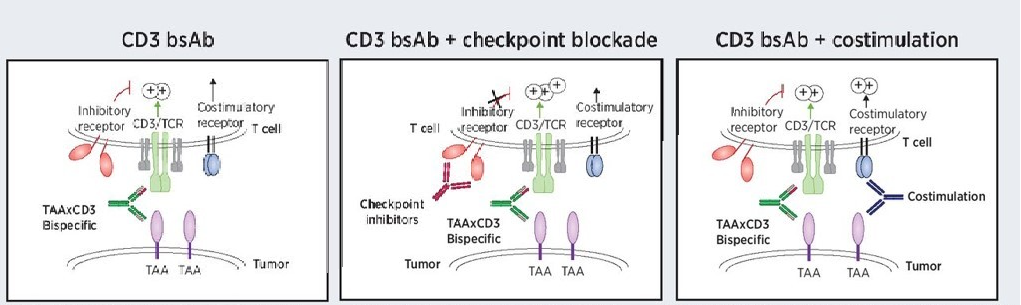
图4. CD3双特异性抗体的激活可被共抑制和共刺激受体增强[2]
CD3-BsAbs相关研究靶点
目前已有200+种CD3双特异性抗体已上市或处于在研阶段。Catumaxomab是最早上市的双抗,2009年由欧洲药品管理局(EMA)批准, 靶向CD3和EpCAM, 通过腹膜内给药途径, 治疗EpCAM阳性的结直肠癌患者的恶性腹水, 但后来由于商业原因在2017年退市停产。Blinatumomab于2014由美国食品药品监督管理局(FDA)批准上市,靶向CD3和CD19, 用于治疗费城染色体-阴性、复发性或难治性B-ALL,该药获批后,业界对CD3-BsAbs的研究重新燃起了希望。CD3-BsAbs的研究靶点除了造血细胞表达的抗原,即B细胞(CD19、CD20、BCMA)和髓细胞(CD33、CD123和CLEC12A)外,还有靶向实体瘤表达的抗原(GPRC5D、CEA、EpCAM、HER2、PSMA、pCadherin、pMHC、GPC3、GPA33)进行双抗的研究开发。CD19、CD20、GPRC5D、EpCAM、CD33和HER2是临床已证实的靶点,也是已有批准的IgG药物的靶点;p-Cadherin、pMHC和GPC3是新型靶点,尚未有被FDA或EMA批准的抗体治疗药物,这些试验研究结果将为优化T-BsAbs的治疗策略提供莫大帮助。
CD3相关靶点人源化小鼠
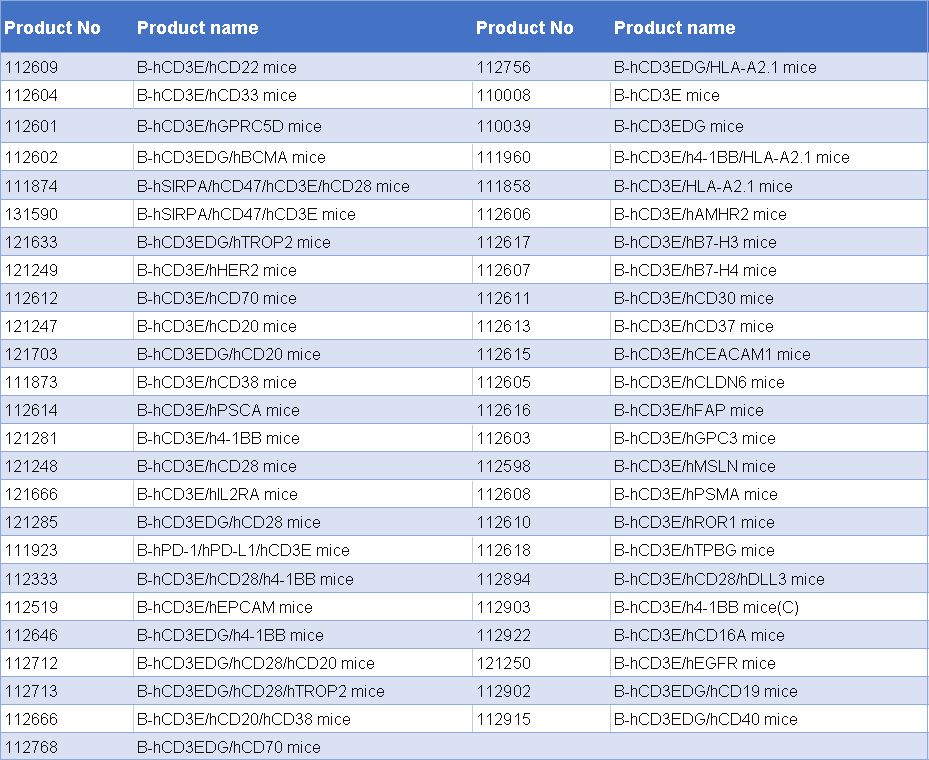
百奥动物自主开发了一系列CD3相关单靶点/双靶点/三靶点人源化小鼠,助力药物临床前研发。
更多数据信息,欢迎联系我们。






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号