流式细胞术(Flow Cytometry)是一种高效的单细胞分析/分选技术,它可以对大量的细胞或非细胞的颗粒进行快速、准确、多参数的高通量检测分析。从二十世纪六七十年代发明问世以来,流式细胞术已被广泛应用于细胞生物学、分子生物学、免疫学、血液学、肿瘤学、遗传学、药学、植物学、海洋生物学、临床医学等众多领域,产生了数不胜数的重大科学发现。流式细胞术分析参数多、检测通量高、方法灵活多变等特点,非常契合药物研发各个环节的需求,使其可以在早期靶点机制验证、抗体发现和表征、临床前药理药效评价、临床biomarker研究中发挥重要作用。
流式细胞术的基本原理是使用荧光探针标记待检测的生物样本,通过流式细胞仪检测生物样品上的被标记的荧光信号来获取相应的生物学信息,其两大核心要素是样品的荧光标记技术和流式细胞仪。
荧光标记技术的关键是荧光素分子,目前常用到的荧光素从种类上来分大致有五类,分别为有机小分子,荧光蛋白,复合染料,大分子染料和量子点等,不同的荧光素分子有其相应的优缺点,以适应不同的应用场景。荧光素分子吸收激发光的能量跃迁进入激发态,通过释放光子回到激发态,释放的光子即为发射光。每一种荧光素都有其独特的激发光光谱和发射光光谱,我们利用这些独特的光谱特性,可以通过激发激光和特定波长范围的荧光检测器的组合,来实现不同荧光素的检测(图1)。一类荧光标记技术是利用部分荧光素分子可以直接与特定的化学物质发生相互作用的特性来达到检测目的,例如CFSE(羟基荧光素乙醋酸盐瑰珀酰亚胺脂)与细胞的蛋白质发生稳定的共价结合标记细胞,PI(碘化丙啶)可以与双链DNA结合从而标记细胞遗传物质等。另一类荧光标记技术是通过在抗体上耦联不同的荧光素分子,利用抗体特异性识别抗原的能力,对特定的抗原分子进行荧光标记,达到检测相应抗原的目的。其他荧光标记技术还包括利用基因编辑技术转染荧光蛋白,利用耦联了荧光素的核酸探针进行标记等。
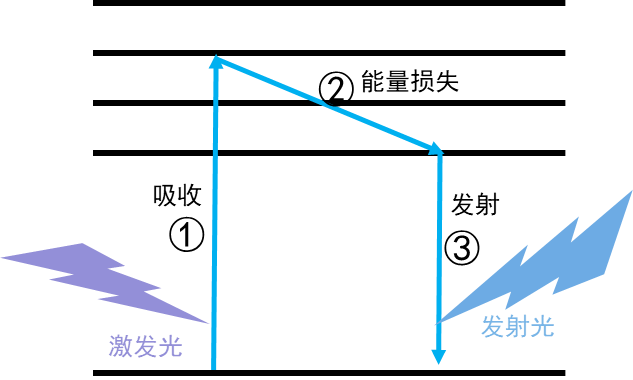
图1. 荧光激发的进程
流式细胞仪最初起源于20世纪60年代,在此期间WallaceH.Coulter发明了一种称为Coulter计数器的设备,该设备使用电阻来计算血液中红血球数量。随后,Leonard Herzenberg等人开发出第一台真正意义上的流式仪,并在1972年首次发布了相关论文。流式细胞仪主要由三个系统组成,分别为液路系统,光路系统和电子系统(如图2)。其中液路系统由仪器运行中需要的鞘液,废液,清洗液以及关机液等构成,施加压力后将样品输送并聚焦到激光检测器处进行样品分析,因此为仪器动力来源,又称液流驱动系统;光路系统是仪器产生信号并收集光信号的部分,在这个系统中包含一些光学元件,如分光光度镜,滤光片等,每种荧光染料在对应的激发波长和发射波长下经过光路系统后会由仪器采集到对应的光学信号;电子系统则利用光电转换器(如光电倍增管(PMT),雪崩光电二级管(APD)等)将光信号放大转换为电信号,方便数据采集和后续分析。

图2. 流式细胞仪的液路系统,光路系统及电子系统组成
随着过去几十年的不断发展,流式细胞仪激光系统和检测系统越来越复杂,上样系统的速度和自动化程度越来越高,以满足日益增加的多参数分析和高通量分析需求,许多厂家也针对特定的检测分析需求,开发了具有独特功能的流式细胞仪。从仪器的动力来源来看,主要分为气压泵、蠕动泵和注射泵几类;从仪器的检测系统来看,主要分为常规流式仪、光谱流式仪、质谱流式仪、成像流式仪等。
在分析型流式细胞仪的基础上,百奥赛图流式平台包含数台Invitrogen的Atune NxT声波聚焦流式仪(3激光11色)(图3a),Cytek Aurora NL-CLC全光谱流式仪(3激光38检测器)(图3b),赛多利斯流式仪(图3c),BD FACSMelody流式细胞分选仪(3激光9色)(图3d)。

图3a. Atune NxT声波聚焦流式仪

图3b. Cytek Aurora NL-CLC全光谱流式仪

图3c. 赛多利斯流式仪

图3d. FACSMelody流式细胞分选仪
Attune NxT声波聚焦流式仪利用注射泵作为动力来源,可以控制上样体积从而不依赖于定量微球实来进行细胞数的定量分析。其独特的声波聚焦系统,可以在高速上样时更好的保证细胞呈单列形式通过激光照射,提高样品的上样速度并减少管路的堵塞(图3a)。
Cytek Aurora NL-CLC全光谱流式仪通过使用散色光学元件分离发射光,再通过48个检测器阵列来检测每一个样本发出的全光谱信号,利用光谱解析算法进行数据分析得到每个荧光素的信号(如图6a)。由于仪器接收了发射光谱的完整信号,区别于传统流式仪仅检测特定带通滤光片内的荧光信号,光谱流式仪可以区分一些常规流式区分不了的荧光素,如BV421和SB436,APC和AF647等,大大降低了多参数流式方案的配色难度,扩宽了荧光素的组合应用。
基于流式细胞术的检测原理,大量的分析方法被开发出来并成熟应用于药物临床前和临床研究的多个环节,包括细胞表面抗原表达分析、抗体结合阻断功能筛选、细胞周期、细胞凋亡、细胞分型、肿瘤免疫微环境分析、受体占位分析、细胞治疗产品的药代动力学分析、多细胞因子分析等。
01、细胞表面抗原表达分析
检测目标细胞的特定抗原表达水平,尤其是肿瘤细胞上肿瘤特异性抗原的表达水平,对于药物开发过程中药效模型的选择、适应症选择和临床转化都有十分重要的意义。使用荧光标记的特定抗原的抗体对细胞进行染色分析,我们可以通过平均荧光信号值比较不同细胞同一抗原的相对表达强弱;进一步的我们还可以利用表面耦联了固定数量抗体结合分子的标准微珠,得到荧光信号值和标记上的荧光抗体数量的对应关系,从而通过样品的荧光信号值反推得到细胞表面结合的荧光抗体数,在抗体饱和孵育和单价结合假设下这个数量就等于抗原表达的绝对数量(图4)。
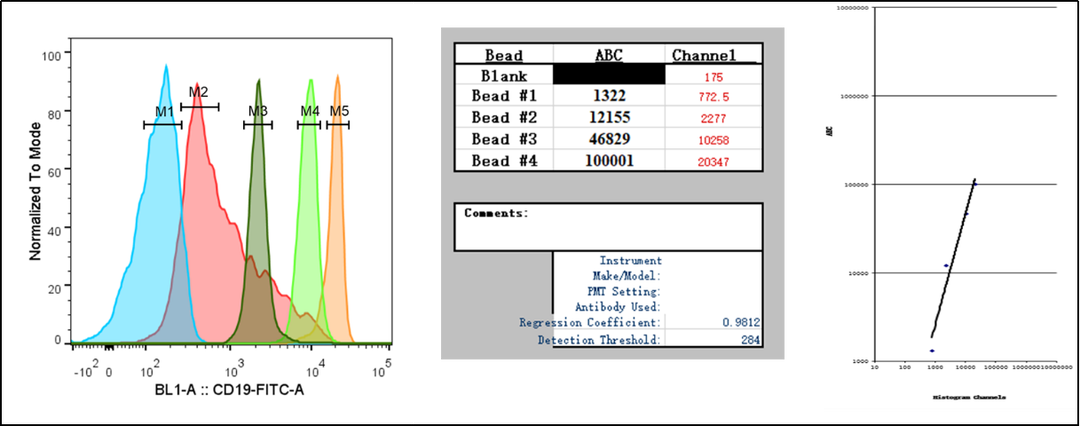
图4. 抗原表达水平检测
02、细胞功能分析
流式细胞术在细胞功能上的检测分析应用非常丰富,包括细胞活性,细胞周期,细胞增殖,细胞凋亡,离子平衡,ROS,杀伤/吞噬功能等。细胞活性的研究通过引入带有荧光标记的死活染料,如核酸染料PI,7-AAD以及胺基反应原理的Fixable Viability Dye等就可以研究细胞死活情况,从而评价药物直接引起的细胞活性改变或者抗体介导免疫效应细胞对巴靶细胞的杀伤作用,例如通过CFSE标记Jurat-hCTLA4细胞系,与PBMC和anti-CTLA4抗体进行共孵育后,利用死活染料区分细胞死活,可以评估anti-CTLA抗体的ADCC(抗体介导的细胞毒)活性。细胞增殖的分析主要利用CFSE染料与细胞内蛋白质稳定结合并可以平均分配到子代细胞的特性,通过分析荧光信号有衰减峰的数量和比例来评估细胞分裂的代数和分裂细胞的占比情况,例如我们利用CFSE标记B-hCD3人源化小鼠的脾脏T细胞,再通过anti-human CD3的抗体(OCT3)刺激,可以观察到CD3人源化小鼠的T细胞的增殖,鉴定CD3人源化小鼠改造后CD3分子的正常信号传导功能(如图5)。
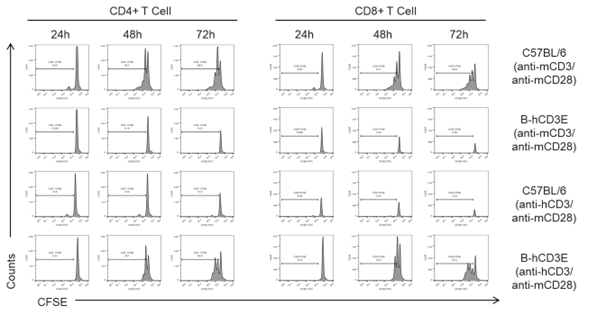
图5. 抗人CD3抗体刺激B-hCD3人源化小鼠T细胞的增殖
03、免疫细胞分型和肿瘤免疫微环境分析
流式细胞术可以同时检测数个甚至数十个荧光信号的特性,使其非常适合进行免疫细胞的多marker分型分析。不同的免疫细胞或其他细胞可能会具有一个或多个特定表达的抗原标记物,我们通过检测这些抗原标记物,来定义和区分一个细胞亚群,这些细胞标记称为谱系标记,用于定义特定细胞群,例如T细胞标记(CD3、CD4、CD8)、B细胞标记(CD19、CD20、B220)、单核细胞标记(CD14、CD11b、Ly6C)和NK细胞标记(CD56、CD335、CD49b、CD161)等;除了定义细胞群的谱系标记外,还使用其他标记来表征每个细胞群的功能情况,比如免疫细胞激活标记(CD69、CD25、CD38、HLD-DR、CD62L)、记忆标记(CD45RO、CD27)、组织归巢标记(α4/β7)和趋化因子受体标记(CCR8、CXCR1、CCR7、CCR5、CCR6)等;还包括转录因子、细胞因子等细胞内标记物,例如FoxP3(Treg细胞)、细胞因子(IFN-γ、TNF-α、IL-2定义Th1 细胞,IL17定义Th17细胞)和增殖标记物(Ki67)等。
百奥赛图在临床前药理药效的评价服务中,在结合美天旎的多通道全自动组织处理器(图6)的基础上,优化稳定了小鼠皮下瘤、血液、脾脏、淋巴结、肝脏、肺脏、肺泡灌洗液等多种组织的样品制备方法,以应对不同的疾病和药理机制分析需求。积累了大量的人,小鼠和犬等多物种的免疫细胞分析的经验(表1),形成了针对淋系免疫细胞、髓系免疫细胞、效应/记忆细胞、免疫检查点等分析目标的成熟服务panel(图7a-染色panel),同时也可以提供定制化的染色panel设计和优化。百奥赛图积累了常见的小鼠同源移植肿瘤模型的免疫微环境数据,为肿瘤模型的选择和药效药理的评价筛选提供支持(图7b-典型分型图和不同肿瘤的比例图7c。)肿瘤免疫微环境分析能为药效作用提供有力的机制分析支持,例如在4-1BB抗体作用后,小鼠肿瘤得到了一定程度的抑制,同时肿瘤浸润免疫细胞流式分析和肿瘤组织多色组织荧光分析发现CD8阳性的杀伤性T细胞显著增加,免疫抑制作用的Treg细胞显著减少(图8-4-1BB案例)。

图6. 全自动组织处理器
表1 mouse,human和canine物种不同免疫细胞分析经验表(部分)
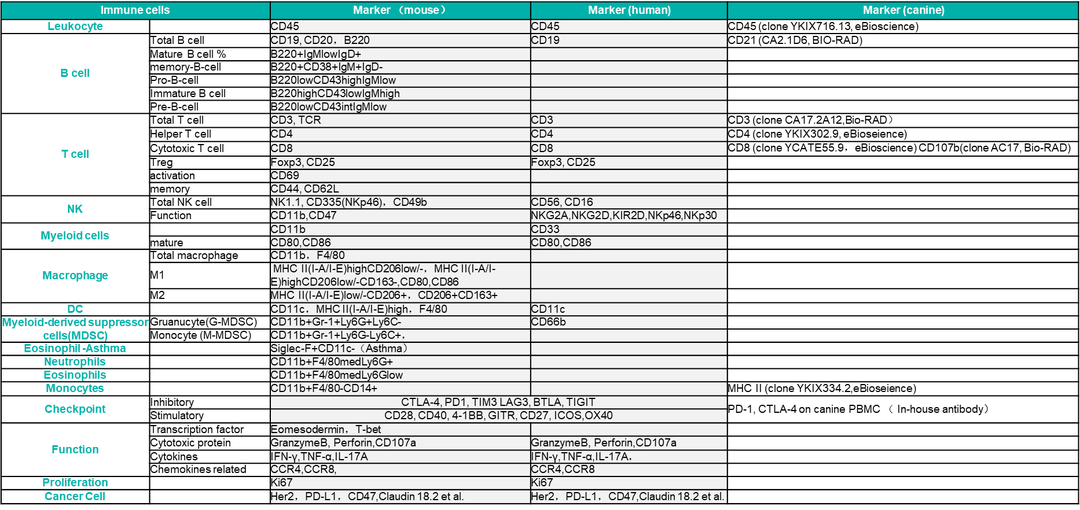
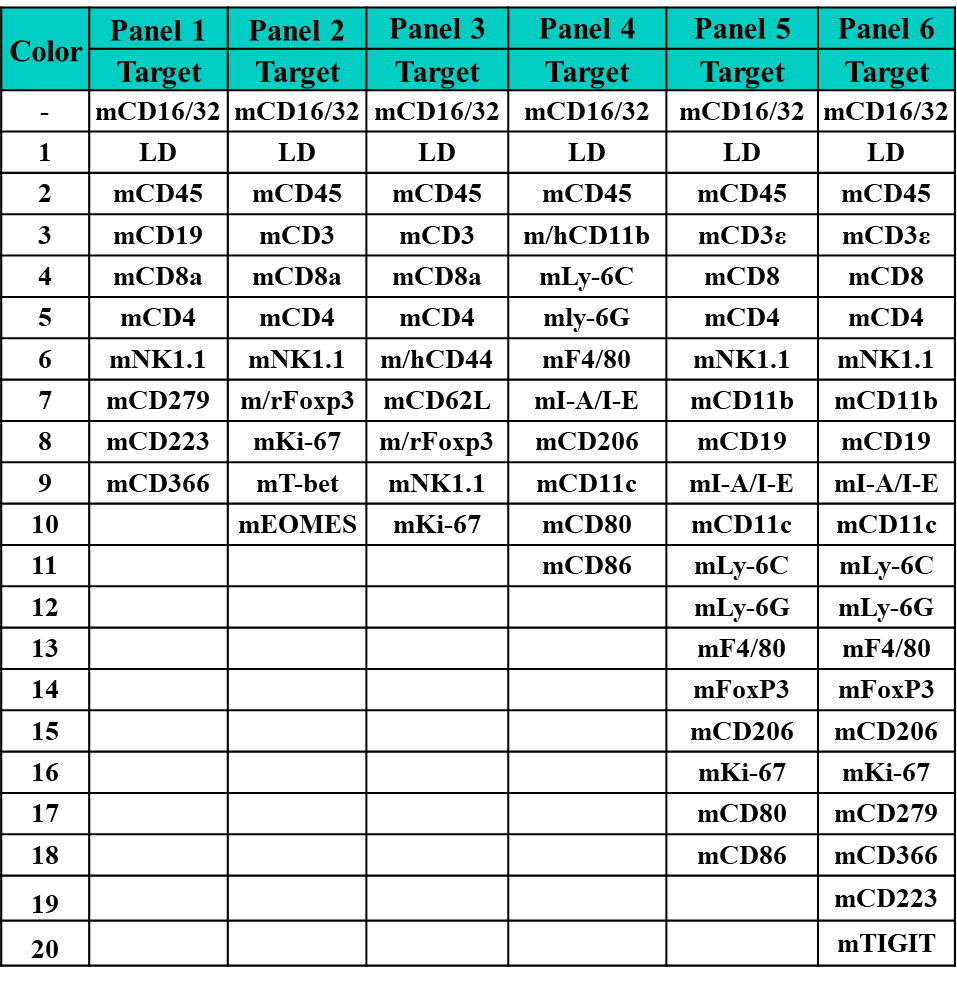
图7a. 服务panel列表(部分)
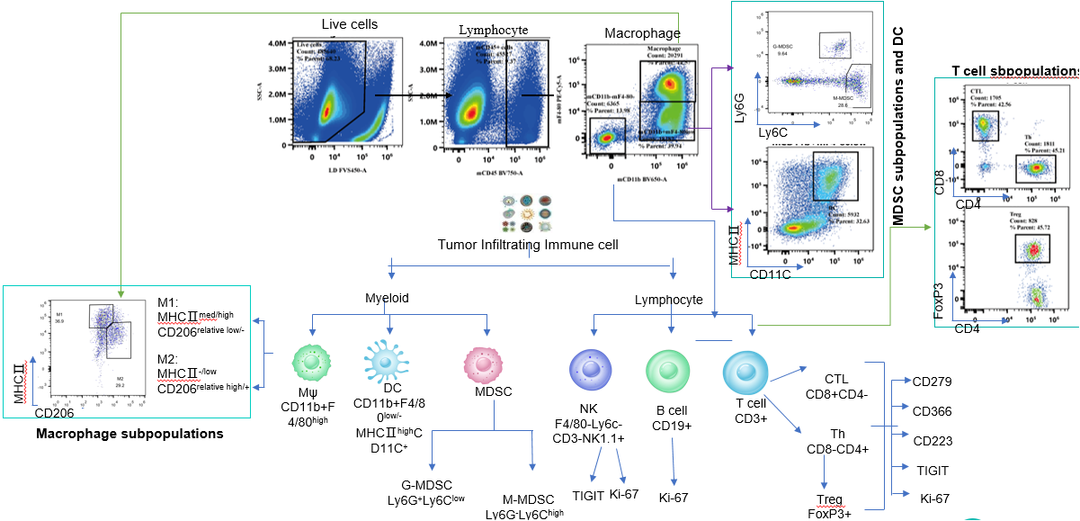
图7b. 典型分型示例图
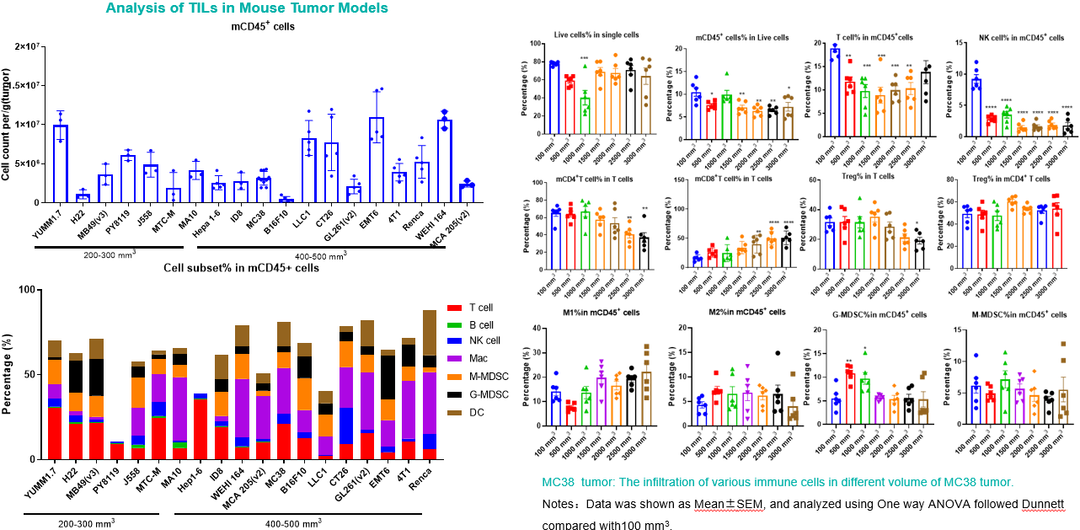
图7c. 不同皮下接种的肿瘤组织TILs分型
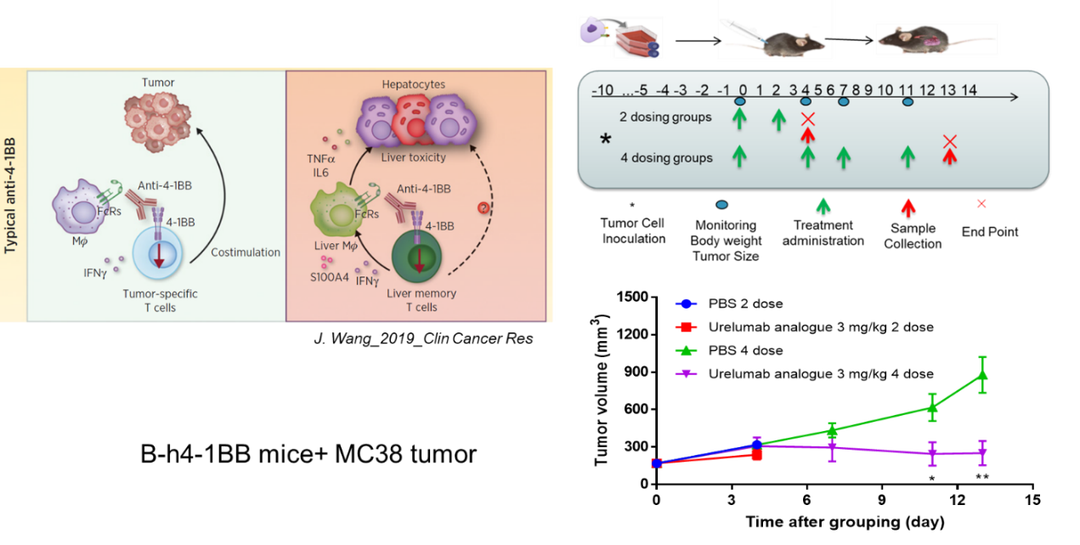
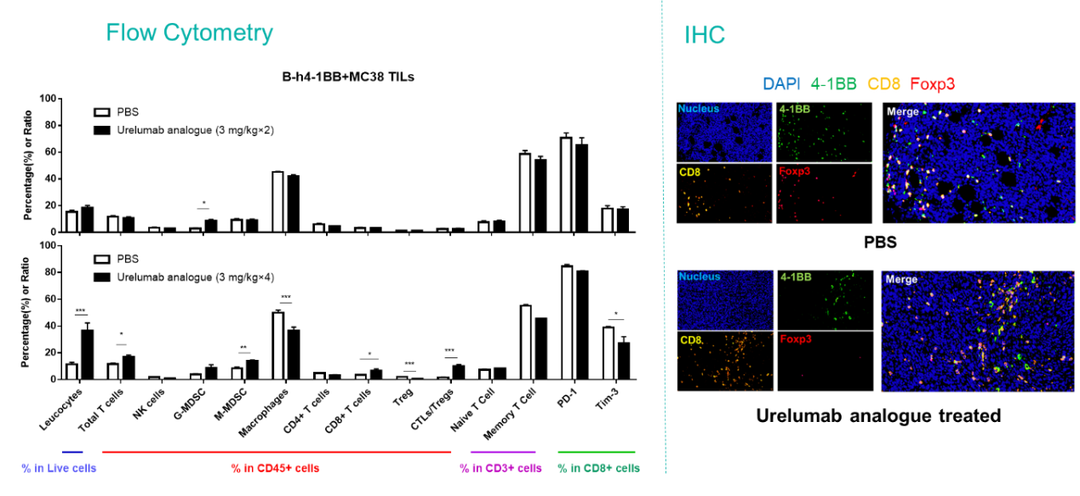
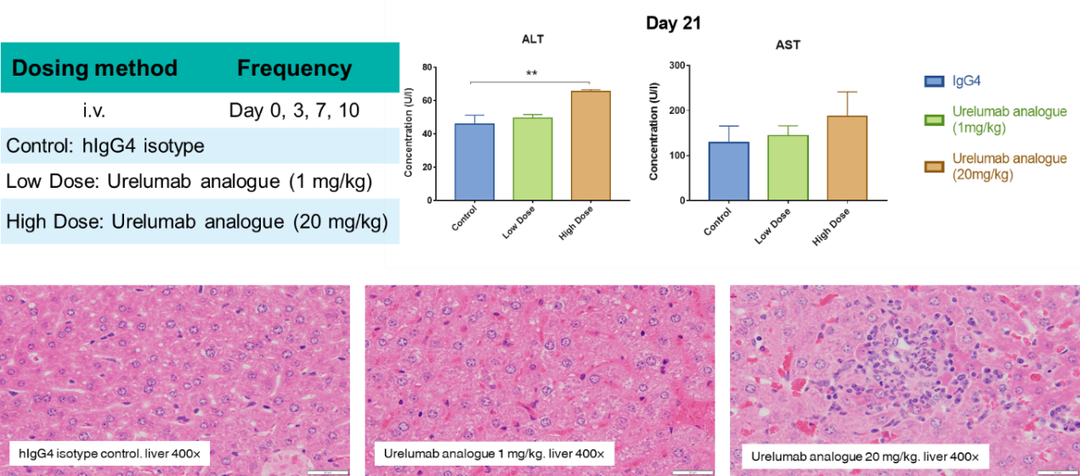
图8. 4-1BB靶点药物的相关研究内容
04、受体占位分析:
受体占位(Receptor occupancy ,RO)分析目标是分析在体内给药后特定时间点,靶细胞上的药物作用靶点被药物结合的情况,是最重要的PD指标之一,对于确定量效关系,建立PK-PD模型,指导临床前和早期临床实验的剂量设计有重要作用。流式细胞术是检测受体占位率(%RO)的最佳手段之一,目前百奥赛图对于临床前样本的RO分析一般采用的方法是通过二抗识别已结合的药物得到Bound receptor,同时在另一份样品中加入过饱和的受试品孵育同样由二抗荧光信号得到Total receptor,最后利用RO% = (MFI bound – MFI blank) / (MFItotal– MFI blank) × 100%(Blank: secondary antibody only,如图9所示)。方法开发的一般流程为:1、对所用到的抗体试剂进行滴定,得到最适的使用浓度;2、将panel设置的全染样品在流式仪上进行条件参数验证;3、体外不同浓度的受试品孵育检测信号验证;4、开展体内RO分析(PK-PD研究)。对于RO的研究百奥赛图对于CD40靶点进行了一系列临床前的PK-PD研究,为药物的药效作用及剂量设置提供了一些轮依据,同时也可以利用流式细胞术检测药物可能带来的细胞因子风暴(Cytokine release syndrome,CRS),来预测药物可能带来的不良反应,为安全评估提供依据。
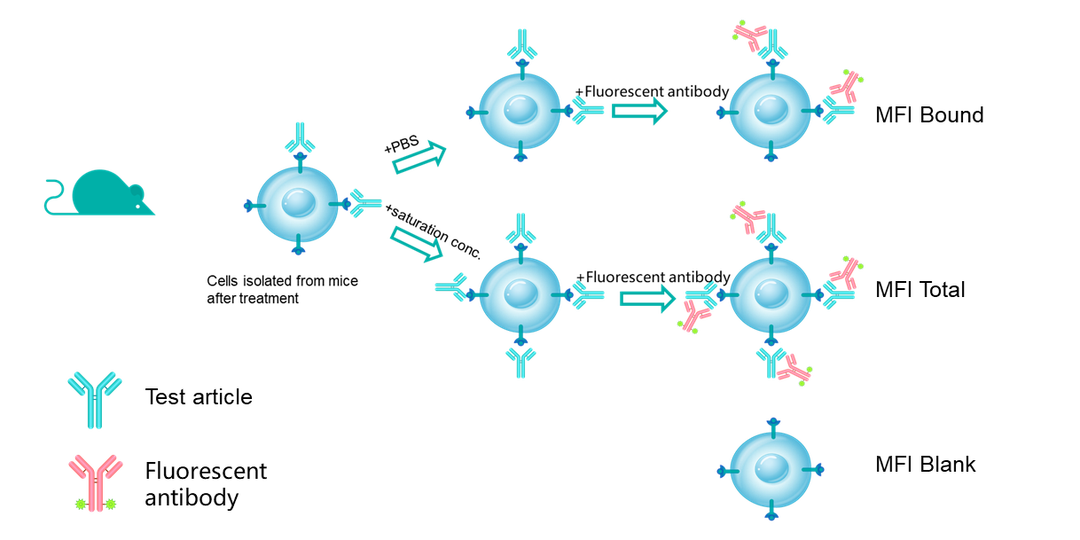
图8a. 受体占位分析模式图
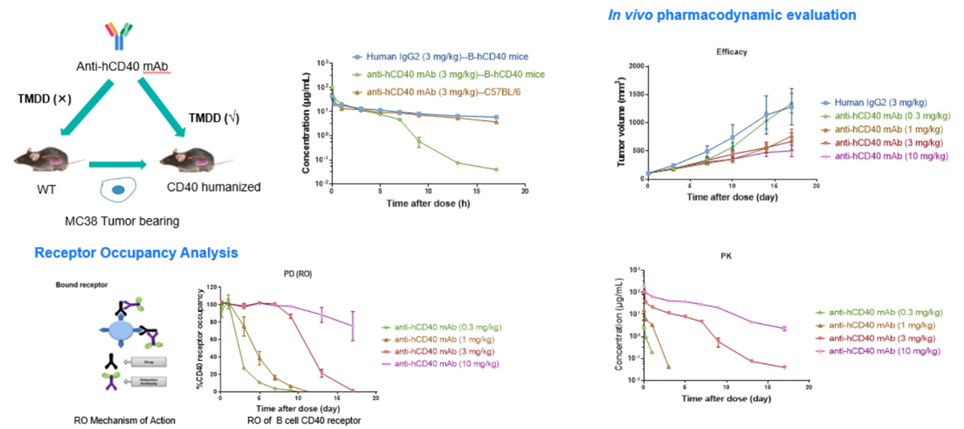
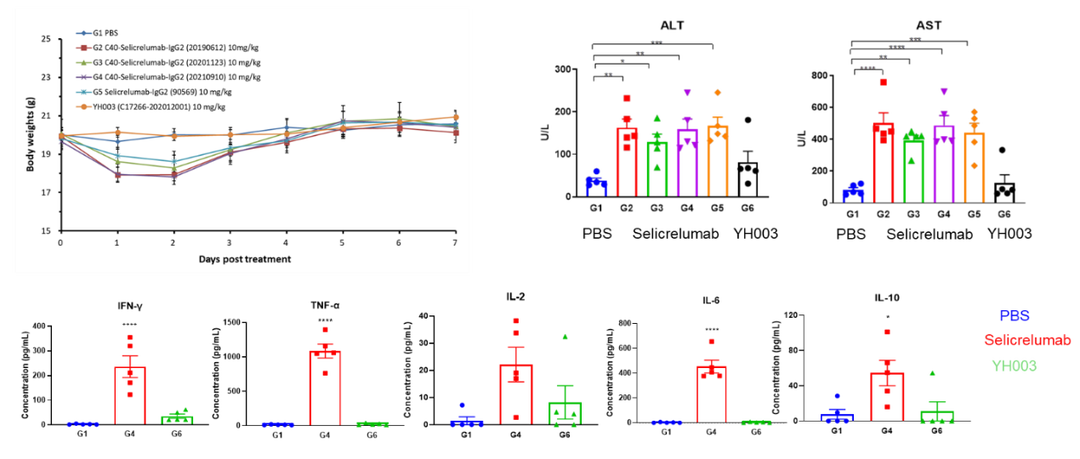
图8b. CD40抗体PK-PD及药物毒理研究分析
综上所述,流式细胞术已应用于免疫学,抗原特异性反应,分子生物学,细胞生物学、血液学、肿瘤学、遗传学、药学、植物学、海洋生物学等众多科研及临床医学领域,在总结本文所述的流式细胞术应用时,我们可以看到这项技术已经成为了现代生命科学研究中不可或缺的工具。通过使用流式细胞仪,我们能够快速、准确地分析和鉴定各种类型的细胞,并且对它们进行深入的研究。无论是在基础医学领域还是在药物开发和治疗方面,流式细胞术都有着广泛而重要的应用价值。
百奥赛图提供一站式临床前药效研究与安全性评价服务,以帮助全球药企和生物技术公司加速其临床前药物发现和开发进程。凭借科学家的丰富经验,我们提供具有广泛实验终点或数据结果的体内药效,PK / PD,毒性和体外检测实验等的高质量研究,为客户及时更新项目进展,并在研究结束时提供详细的项目报告。百奥赛图重视客户反馈,致力于做到客户100%满意。
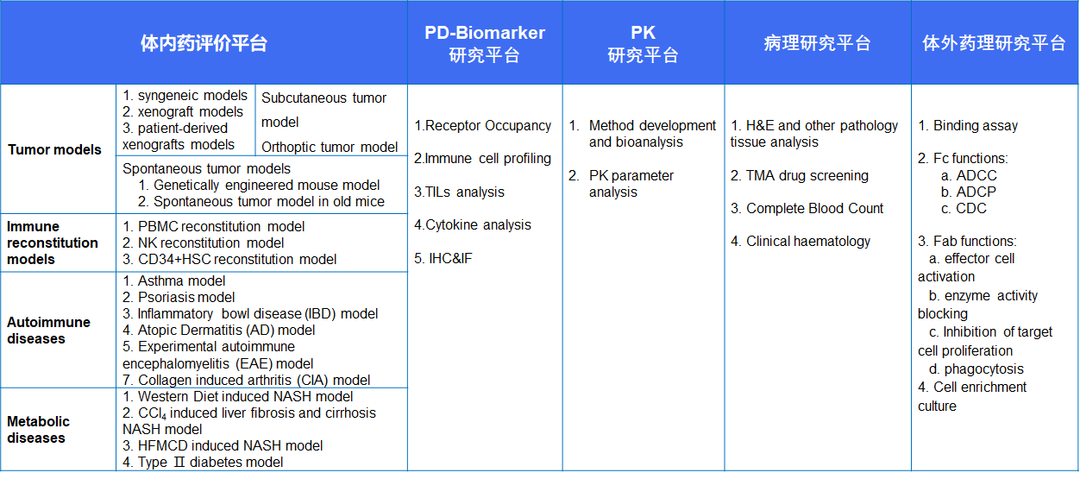
表2. 百奥赛图药理药效研究平台
希望本文能够帮助读者更好地理解流式细胞术及其应用,并且激发大家对于该领域更深入探索和创新的兴趣。同时也期待未来会有更多优秀科学家加入到这个领域中来,共同推动生命科学研究向前迈进!
参考文献
[1] Givan, Alice L. “Flow cytometry: an introduction.” Methods in molecular biology (Clifton, N.J.) vol. 699 (2011): 1-29.
[2] de Figueiredo, Adélia Marques et al. “Diagnostic applications of microsphere-based flow cytometry: A review.” Experimental biology and medicine (Maywood, N.J.) vol. 247,20 (2022): 1852-1861.
[3] Fulwyler, M J. “Electronic separation of biological cells by volume.” Science (New York, N.Y.) vol. 150,3698 (1965): 910-1.
[4] Herzenberg L A , David P , Bita S , et al. The history and future of the fluorescence activated cell sorter and flow cytometry: a view from Stanford.[J]. Clinical Chemistry, 2002(10):1819-27.
[5] An, Xiuli, and Lixiang Chen. “Flow Cytometry (FCM) Analysis and Fluorescence-Activated Cell Sorting (FACS) of Erythroid Cells.” Methods in molecular biology (Clifton, N.J.) vol. 1698 (2018): 153-174.
[6] Bonner W A Jr., Hulett H R Jr., Sweet R G et al. Fluorescence activated cell sorting[J]. Review of scientific instruments,1972 ,43(3):404-409.
[7] Nolan, John P, and Danilo Condello. “Spectral flow cytometry.” Current protocols in cytometry vol. Chapter 1 (2013): 1.27.1-1.27.13.
[8] D'Amato Figueiredo, Marcos V et al. “Advances in Intraoperative Flow Cytometry.” International journal of molecular sciences vol. 23,21 13430. 3
[9] Tsien RY. Green Fluorescent Protein. Annu Rev Biochem. 1998;67:509
[10] Jaimes, Maria C et al. “Full spectrum flow cytometry and mass cytometry: A 32-marker panel comparison.” Cytometry. Part A : the journal of the International Society for Analytical Cytology vol. 101,11 (2022): 942-959.
[11] Rahim, Maha K et al. “Dynamic CD8+ T cell responses to cancer immunotherapy in human regional lymph nodes are disrupted in metastatic lymph nodes.” Cell vol. 186,6 (2023):
[12] Casaro, S et al. “Flow cytometry panels for immunophenotyping dairy cattle peripheral blood leukocytes.” Veterinary immunology and immunopathology vol. 248 (2022): 110417.
[13] Spurgeon, Benjamin E J, and Khalid M Naseem. “Platelet Flow Cytometry: Instrument Setup, Controls, and Panel Performance.” Cytometry. Part B, Clinical cytometry vol. 98,1 (2020): 19-27.
[14] Stewart, Jennifer J et al. “Role of receptor occupancy assays by flow cytometry in drug development.” Cytometry. Part B, Clinical cytometry vol. 90,2 (2016): 110-6.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号