自然杀伤细胞(natural killer cell,简称 NK 细胞)是一种先天淋巴细胞, 是机体固有免疫系统的重要组成部分之一,无需特异性抗原刺激即可杀伤靶细胞,对于清除病毒感染和抗肿瘤至关重要。NK细胞具有细胞毒性和免疫调节双重功能,是继B细胞、T细胞后发现的第三类淋巴细胞,通常被认为是抵抗病毒/细菌感染的第一道防线。通过产生支持辅助性T细胞极化和T细胞活化的细胞因子,刺激树突状细胞(dendritic cell,DC)和B细胞成熟,从而桥接、协调先天性和适应性免疫反应。
NK细胞杀伤肿瘤的途径
NK细胞作为癌症免疫疗法很有吸引力,因为与T细胞不同,它们能逃避免疫排斥反应,不会诱发细胞因子风暴,而且识别癌细胞表面的特异性蛋白分子,在肿瘤早期或癌细胞很少的情况下即可发挥作用,对几乎所有常见的癌细胞类型都有杀伤作用,包括肺癌、乳腺癌、肝癌、淋巴癌、食道癌等;对多重耐药肿瘤细胞同样具有杀伤作用。
NK细胞杀伤肿瘤细胞主要通过以下4个途径完成,分别是:
直接杀伤
NK细胞直接通过胞吐作用释放穿孔素和颗粒酶等细胞毒性颗粒,穿孔素在靶细胞表面穿孔,使颗粒酶b进入靶细胞诱导靶细胞凋亡。
诱导细胞凋亡
活化NK细胞表达Fas(CD95)配体和TRAIL(TNF related apoptosis inducing ligand,肿瘤坏死因子相关诱导凋亡配体)分子,诱导CD95+靶细胞和TRAIL受体阳性的靶细胞通过内源酶的级联反应发生凋亡,使靶细胞进入程序性凋亡状态。
细胞因子介导杀伤
NK细胞能合成和分泌多种细胞因子,如IFN-γ、TNF-α、IL1、IL5、IL8、IL10和G-CSF等,直接作用于靶细胞,或通过进一步激活其他种类免疫细胞攻击靶细胞。
抗体依赖性细胞介导的细胞毒性作用(ADCC)
NK 细胞低亲和力的 CD16 分子与靶细胞 IgG 抗体复合物结合后,活化蛋白酪氨酸激酶(PTK),使 PLC γ 的酪氨酸磷酸化,裂解膜磷酯酰肌醇为三磷酸肌醇(IP3)和二酰甘油,IP3增加细胞内游离钙浓度,进而释放细胞毒性物质(如穿孔素和颗粒酶)。
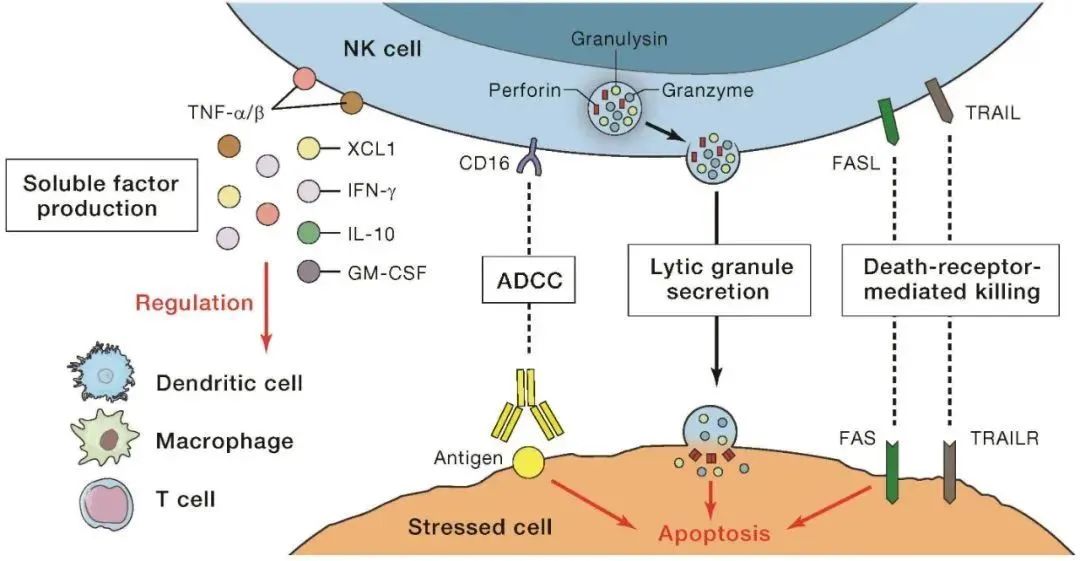
NK细胞作用机制[1]
NK细胞杀伤肿瘤的优势
近年来肿瘤免疫疗法、细胞疗法、基因编辑等新技术不断获得突破。T细胞疗法给血液肿瘤患者带来了痊愈的希望,但是脱靶效应(Off-Target Effect)、细胞因子风暴(Cytokine Storm)、对实体瘤效果有限、治疗费用十分昂贵等缺陷,也制约了T细胞疗法的应用。
与T细胞疗法相比NK细胞疗法具有多种优势:
更广泛的细胞来源
与T细胞疗法目前主要依赖患者自体T细胞不同的是,NK细胞疗法可以采用多种不同来源的NK细胞,例如:外周血、脐带血、NK-92细胞系、iPSC和hESC。
更广泛的适应症
NK细胞疗法具有在没有抗原呈递的情况下能够杀死肿瘤靶标的能力,被广泛用于各种癌症治疗,包括血液肿瘤(Hematological Malignancy)和实体瘤(Solid Tumor),其中CAR-NK疗法有望突破CAR-T疗法难以治疗实体瘤的瓶颈。
更多的杀伤途径
NK细胞疗法具有更多更全面的肿瘤杀伤途径,包括分泌穿孔素、颗粒酶,激活凋亡途径以及介导ADCC。
更好的安全性
NK细胞疗法不会引起移植物抗宿主病(Graft-versus-Host Disease, GvHD),且一般不诱发细胞因子风暴;同时体内存活周期短,不易产生长期毒性。
NK细胞疗法研究现状
2022年AACR会议上,美国MD安德森癌症中心公布:脐带血来源的自然杀伤NK细胞联合NK细胞结合剂AFM13(CD16A/CD30双抗)治疗CD30阳性的淋巴瘤可以达到100%的客观缓解率,这一数据引起了巨大的轰动。NK细胞疗法的高度有效率,使其热度高涨,近年来以NK细胞为基础的药物临床试验在不断增加。
随着大型企业竞相开展NK细胞疗法研究,且在临床阶段取得喜人的结果,人们对NK细胞的兴趣也在不断升级。据Market Research Guru咨询机构的调研,全球NK细胞疗法市场规模2021年达到3.40亿美元,预计2028年将增长至10.09亿美元,年均复合增长率(CAGR)将达16.8%。
而在国内方面,目前已有超20家国内药企在此领域展开布局,尤其近两年越来越多的企业正在不断开始拓展开发NK细胞相关管线布局,并相继有一批NK细胞疗法新锐企业异军突起。
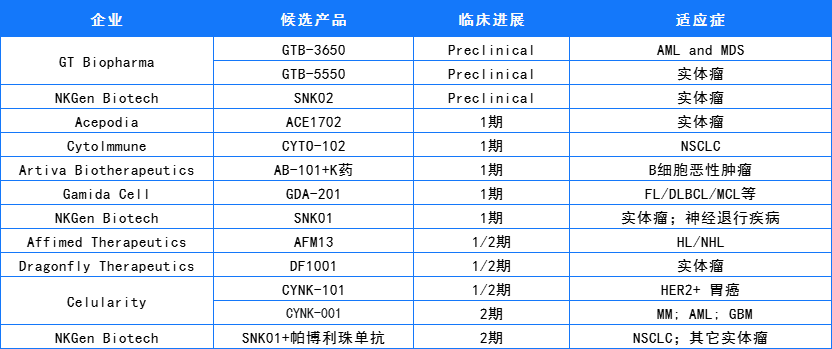
部分NK细胞疗法临床进度
数据来自:科睿唯安
百奥动物自主研发一系列NK细胞靶点人源化小鼠(详见下表),是NK细胞治疗药物进行药效评价的优质模型。
NK细胞靶点人源化小鼠列表
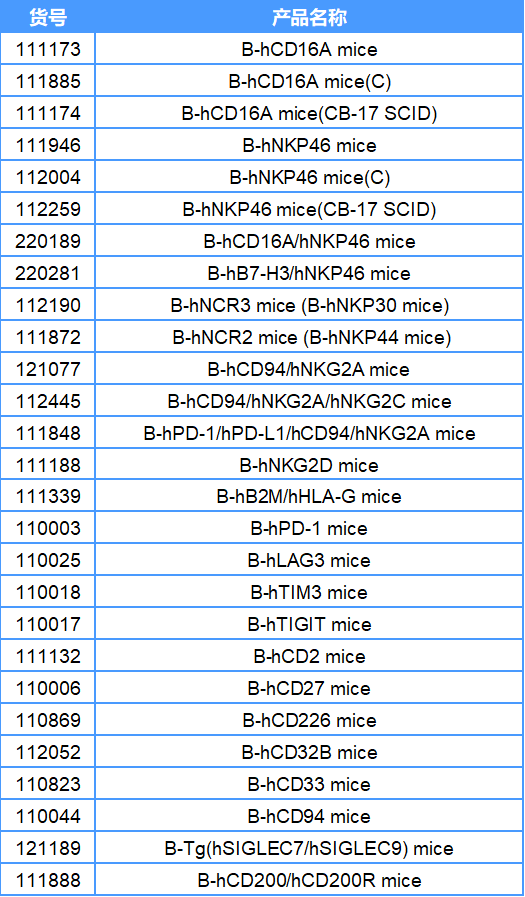
B-hCD16A mice
抗人CD16A抗体的体内药效
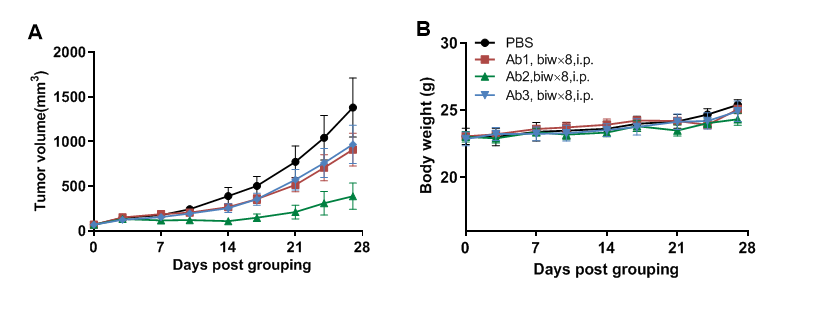
小鼠结肠癌MC38细胞皮下植入纯合B-hCD16A小鼠(雌性,13周龄,n=7)。当肿瘤体积达到约70 mm3时,将小鼠分组,并使用抗人CD16A抗体治疗。如图A所示,抗人CD16A抗体可有效控制B-hCD16A小鼠的肿瘤生长,这表明B-hCD16A小鼠为体内评估抗人CD16A抗体提供了一个强大的临床前模型。数值表示为均值±SEM。
B-hNKP46 mice
抗人NKP46抗体的体内药效
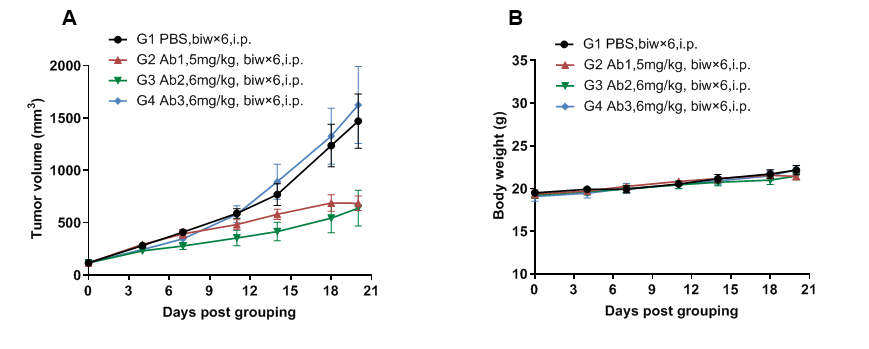
小鼠结肠癌MC38细胞(5E5)皮下植入B-hNKP46小鼠(雌性,7-8周龄,n=7)。当肿瘤体积达到约100 mm3时,将小鼠分组,并使用抗人NKP46抗体治疗如A图所示,抗人NKP46抗体在B-hNKP46小鼠中有效控制肿瘤生长,这表明B-hNKP46小鼠为体内评估抗人NKP46抗体提供了一个强大的临床前模型。数值以平均值±SEM表示。(所有抗体均由客户提供)
B-hCD94/hNKG2A mice
抗人NKG2A抗体的体内药效
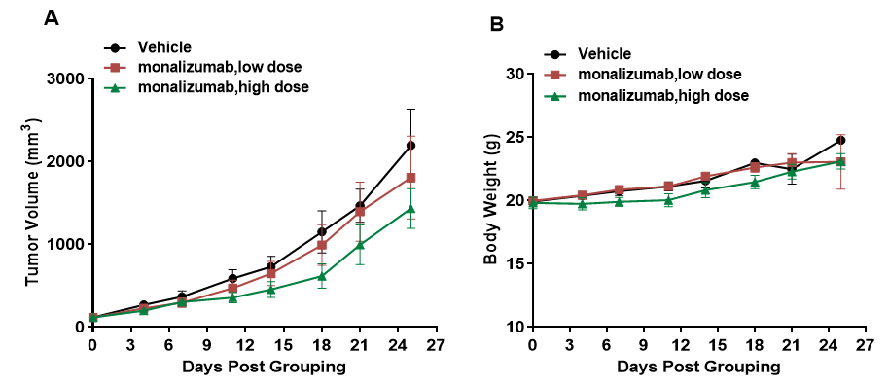
将小鼠结肠癌B-hHLA-E MC38细胞皮下植入纯合B-hCD94/hNKG2A小鼠(雌性,6-7周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,并使用抗人NKG2A抗体进行治疗。如图A所示,抗人NKG2A抗体(monalizumab,内部合成)能有效控制B-hCD94/hNKG2A小鼠的肿瘤生长,这表明B-hCD94/hNKG2A小鼠为抗人NKG2A抗体的体内评估提供了一个强大的临床前模型。数值以平均值±SEM表示。
抗人PD-L1抗体与抗人NKG2A抗体联合治疗体内药效
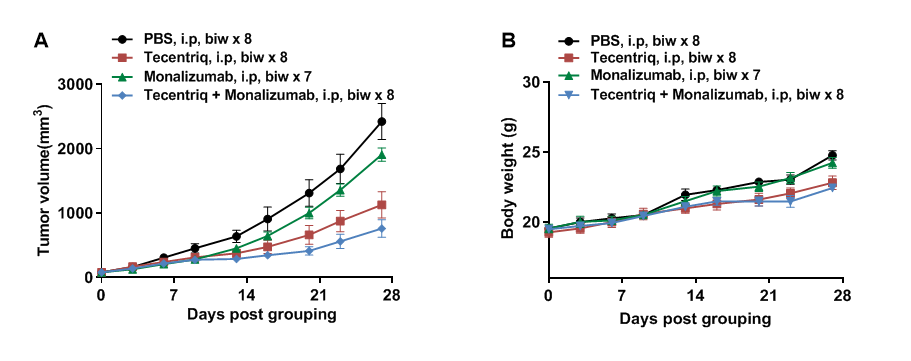
将小鼠结肠癌B-hHLA-E MC38细胞皮下植入纯合B-hCD94/hNKG2A小鼠(雌性,6-7周龄,n=6)。当肿瘤体积达到约100 mm3时,对小鼠进行分组,并对小鼠进行抗体单药及联合治疗。如图A所示,monalizumab和tecentriq联合用药比单独用药显示出更强的抑制作用,这表明B-hCD94/hNKG2A小鼠为PD-L1和NKG2A联合治疗的体内评估提供了一个强大的临床前模型。数值以平均值±SEM表示。(所有抗体均由客户提供)
B-hCD27 mice
抗人CD27抗体的体内药效
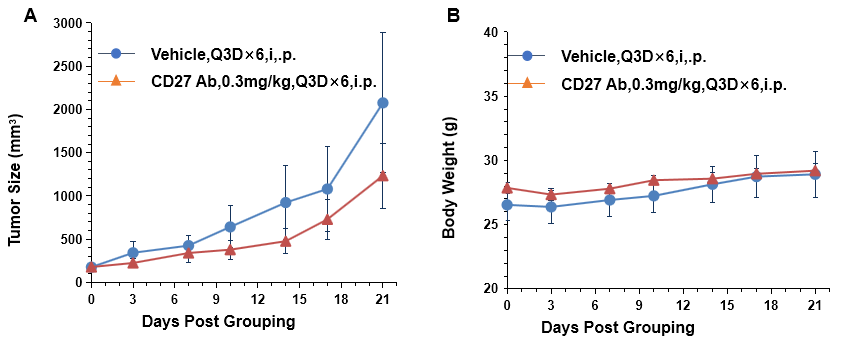
小鼠结肠癌MC38细胞(5×105)皮下植入杂合B-hCD27小鼠(雄性,4-6周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,并使用抗人CD27抗体治疗。如图A所示,抗人CD27抗体可以有效地控制B-hCD27小鼠的肿瘤生长。数值以平均值±SEM表示。
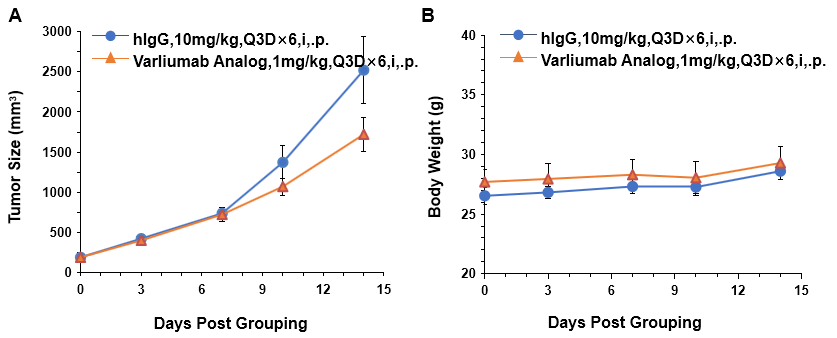
小鼠结肠癌MC38细胞(5×105)皮下植入纯合B-hCD27小鼠(雄性,6周龄,n=5)。当肿瘤体积达到约100 mm3时,将小鼠分组,并使用抗人CD27抗体治疗。如图A所示,抗人CD27抗体可以有效地控制B-hCD27小鼠的肿瘤生长。数值以平均值±SEM表示。
以上数据表明B-hCD27小鼠为抗人CD27抗体的体内评估提供了一个强大的临床前模型。
B-hTIGIT mice
抗人TIGIT抗体的体内药效
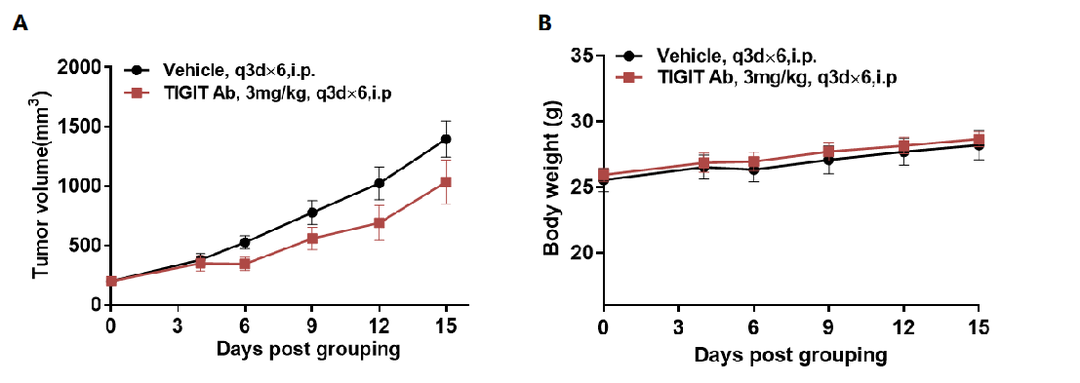
将小鼠结肠癌MC38细胞(5×105)皮下植入纯合B-hTIGIT小鼠(雄性,4-6周龄,n=5)。当肿瘤体积达到约150±50 mm3时,将小鼠分组,并使用抗人TIGIT抗体进行治疗。如图A所示,抗人TIGIT抗体在B-hTIGIT小鼠中有效地控制肿瘤生长,这表明B-hTIGIT小鼠为抗人TIGIT抗体的体内评估提供了一个强大的临床前模型。数值以平均值±SEM表示。
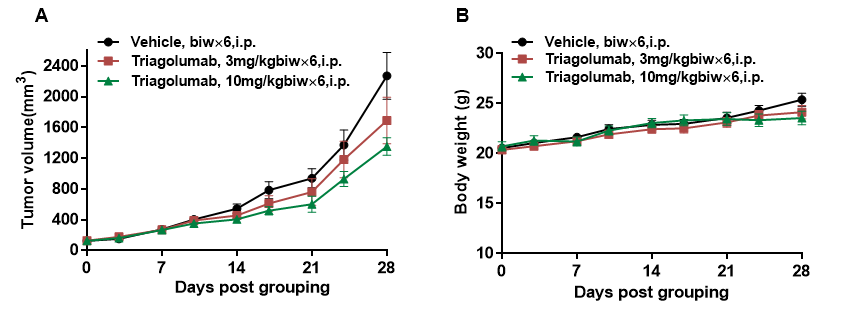
将小鼠结肠癌MC38细胞(5×105)皮下植入纯合子B-hTIGIT小鼠(雌性,8周龄,n=6)。当肿瘤体积达到约150±50 mm3时,将小鼠分组,并使用抗人TIGIT抗体进行治疗。如图A所示,抗人TIGIT抗体可以有效地控制B-hTIGIT小鼠的肿瘤生长,这表明B-hTIGIT小鼠为抗人TIGIT抗体的体内评估提供了一个强大的临床前模型。数值以平均值±SEM表示。
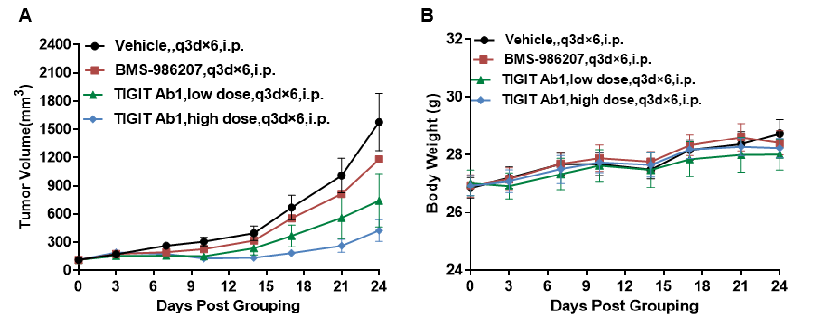
将小鼠结肠癌MC38细胞(1×106)皮下植入纯合B-hTIGIT小鼠(雌性,7周龄,n=7)。当肿瘤体积达到约150±50 mm3时,将小鼠分组,并使用两种抗人TIGIT抗体进行治疗。如图A所示,抗人TIGIT抗体可以有效地控制B-hTIGIT小鼠的肿瘤生长,这表明B-hTIGIT小鼠为抗人TIGIT抗体的体内评估提供了一个强大的临床前模型。数值以平均值±SEM表示。
参考资料:
[1]Crinier A, Narni-Mancinelli E, Ugolini S, Vivier E. SnapShot: Natural Killer Cells. Cell. 2020;180(6):1280-1280.e1. doi:10.1016/j.cell.2020.02.029






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号