尽管调节T细胞(Treg)对维持机体免疫耐受避免自身免疫疾病很重要,但它们也抑制了肿瘤微环境(tumor microenvironment, TME)中的抗肿瘤免疫反应。TME中Treg细胞数量增加、Teff/Treg比例降低与许多癌症的不良预后相关。因此,Treg清除、控制Treg细胞活性与浸润是有潜力的肿瘤免疫疗法。
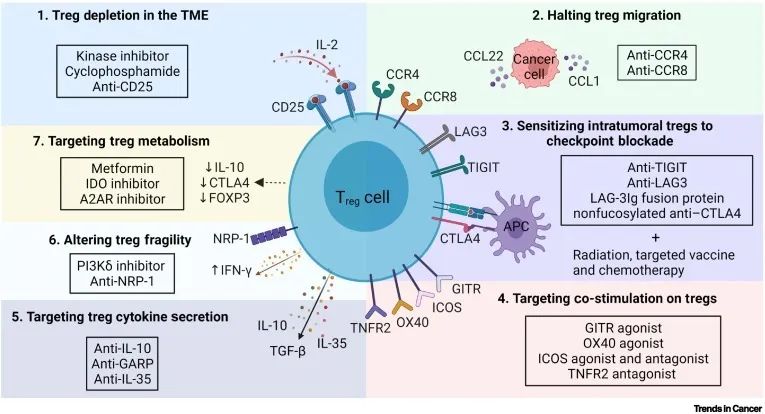
图. Treg靶向的抗肿瘤疗法[1]
1、去除瘤内Treg细胞
a) 通过靶向IL-2受体CD25 (IL-2RA)来实现Treg清除,如Dadizumab治疗脑胶质瘤。但这种疗法的治疗窗口较小。因为CD25既是Treg也是Teff细胞活化后上调的分子。靶向CD25的Treg清除也会伴随Teff的清除。罗氏正在开发新型IL-2非阻断CD25抗体(RG6292),在不影响Teff细胞上的IL-2信号的前提下特异性清除Treg。
b) 通过靶向CTLA-4来实现Treg清除。BMS正在开发第二代CTLA-4抑制剂BMS-986218,对Yervoy进行Fc改造以增强ADCC作用清除Treg。
c) 靶向TME中Treg的其他表面标志物:ICOS、OX40、GITR、LAG-3、CCR4(mogamulizumab,去岩藻糖的CCR4单抗,通过增强ADCC作用清除Treg)、CCR8、TNFR2。
d) 通过鉴定TME Treg marker来实现特异性TME中Treg的清除,而不影响其他正常组织中的Treg。如普米斯生物的双抗CCR8 x CTLA-4。
2、阻止Treg细胞浸润
Treg在趋化因子的作用下迁移至TME,如CCL28-CCR10,CCL1-CCR8,CCL22-CCR4(mogamulizumab)的相互作用。通过中和抗体封闭分泌型CCL1或CCL22;阻断CCR4和CCR8可有效阻止Treg细胞迁移。
3、使瘤内Treg对免疫检查点阻断剂敏感
免疫检查点抑制剂PD-(L)1疗法总体上只能使约20%的病人获得较好的响应,原因之一便是TME内存在异常活化的Treg细胞。由于Treg表达抑制型受体TIGIT、LAG3、CTLA-4、PD-1、TIM-3等,使得Treg具有高度免疫抑制活性。通过抑制型受体的联合阻断[2]可有效降低Treg的免疫抑制能力。
4、靶向T细胞的共刺激信号
a) GITR激活可促进Teff功能、抑制Treg功能;GITR激动剂DTA-1可使瘤内Treg减少50%以上。
b) OX40与配体结合后可增加Teff和记忆T细胞的存活和扩增,同时降低Treg的免疫抑制活性;OX40激活剂OX86在B16F10小鼠黑色素瘤模型中可诱导TME中Treg深度耗竭并增加CD8+ Teff细胞的浸润。
c) ICOS拮抗剂MEDI-570、激动剂JTX-2011(vopratelimab)可在不影响外周Treg频率的情况下降低小鼠瘤内Treg的频率。
5、靶向Treg分泌的抑制型细胞因子
a) 抑制TGF-b:直接结合成熟的TGFb:M7824;作用于GARP:DS1055a去岩藻糖的GARP抗体,可消耗TME中的Treg;作用于整合素αVβ8
b) 抑制IL-10
c) IL-35拮抗剂
6、改变Treg脆性
NRP-1的缺失和IFNg的表达可破坏Treg细胞的免疫抑制功能。NRP1+ Treg在多种人类癌症中富集。NRP-1拮抗剂Fc(AAG)-TPP11可选择性抑制TME中NRP1+ Treg的功能和稳定性,而不影响外周Treg[3]。
7、靶向Treg代谢
a) Teff依赖糖酵解,而瘤内低糖、缺氧、酸性环境抑制Teff的功能。但TME内Treg利用乳酸替代途径来维持其抑制功能。二甲双胍可对Treg代谢重编程至糖酵解,从而减弱Treg的免疫抑制功能。
b) 癌细胞加速的糖酵解消耗TME中的葡萄糖并增加乳酸和脂肪酸含量。脂肪酸代谢也促进Treg细胞发育。抑制脂质合成和代谢信号的SREBP可释放TME中的Treg抑制[4]。
c) TME内的IDO和腺苷可促进Treg增殖和抑制功能。IDO抑制剂、CD39/CD73/A2AR抑制剂可抑制Treg活性。
为了更好的研究、开发Treg疗法,百奥动物开发了一系列Treg靶点人源化小鼠,助力相关药物的临床前药效评估。
B-hCTLA4/hCCR8 mice
品系名称:
C57BL/6-Ctla4tm1(CTLA4) Ccr8tm1(CCR8) /Bcgen
通用名:B-hCTLA4/hCCR8 mice
背景:C57BL/6
货号:112251
hCTLA-4蛋白的瘤内T细胞表达分析
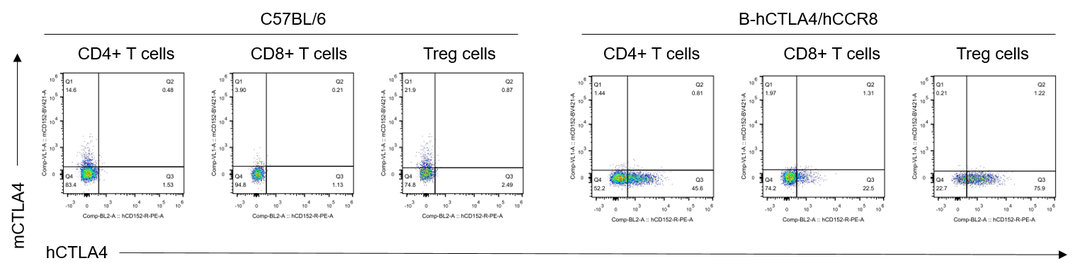
hCTLA-4的流式表达分析。小鼠结肠癌MC38细胞皮下移植至纯合B-hCTLA4/hCCR8小鼠(雌性,7周龄,n=3)。当肿瘤生长至400-700 mm3时对其进行流式检测。人CTLA-4仅在纯合B-hCTLA4/hCCR8小鼠的T细胞中检测出来。
hCCR8蛋白的瘤内T细胞表达分析
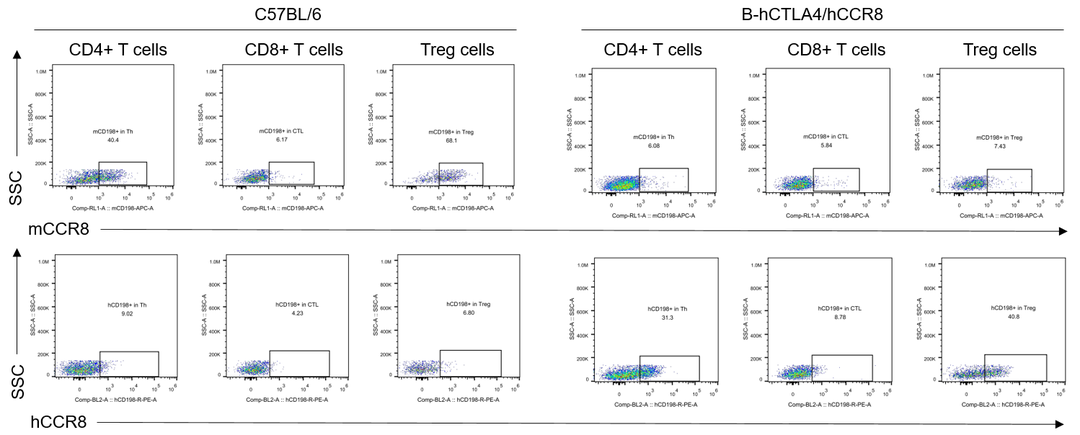
CCR8的流式表达分析。小鼠结肠癌MC38细胞皮下移植至纯合B-hCTLA4/hCCR8小鼠(雌性,7周龄,n=3)。当肿瘤生长至400-700 mm3时对其进行流式检测。人CCR8仅在纯合B-hCTLA4/hCCR8小鼠的T细胞中检测出来。
B-hPD-1/hPD-L1/hTNFR2 mice
品系名称:
C57BL/6-Pdcd1tm1(PDCD1)Cd274tm1(CD274)Tnfrsf1btm1(TNFRSF1B)/Bcgen
通用名:B-hPD-1/hPD-L1/hTNFR2 mice
背景:C57BL/6
货号:130849
抗人PD-1抗体和抗人TNFR2抗体联合治疗
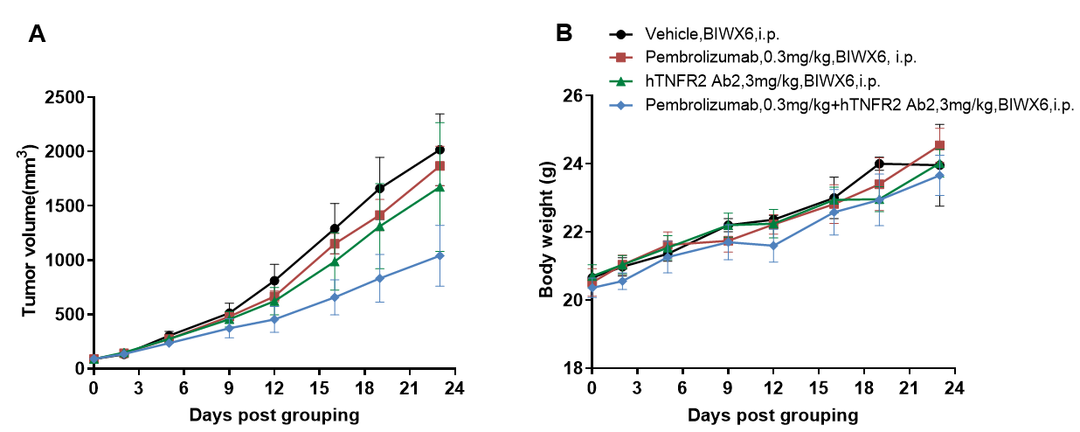
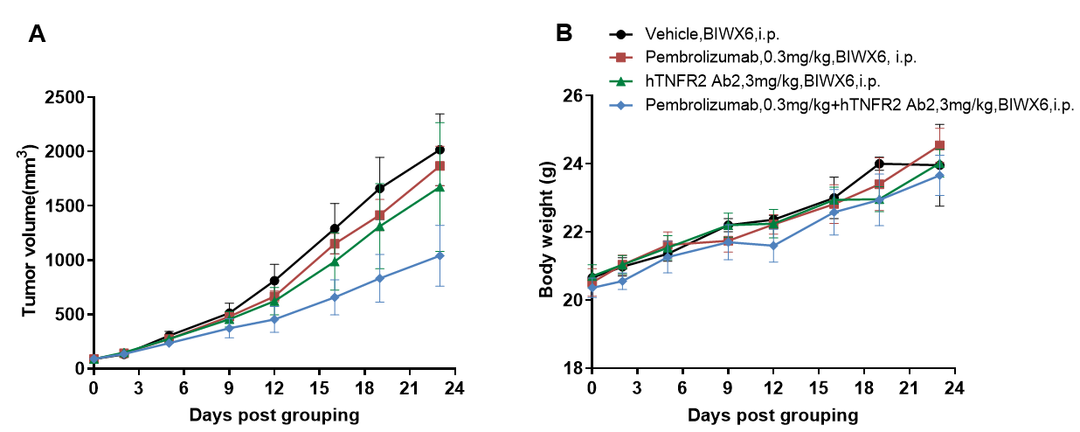
抗人PD-1和抗人TNFR2抗体联用可抑制B-hPD-1/hPD-L1/hTNFR2小鼠中hPD-L1 MC38肿瘤的生长。小鼠结肠癌hPD-L1 MC38细胞皮下移植至纯合B-hPD-1/hPD-L1/hTNFR2小鼠(雌性,6-7周龄,n=5)。当肿瘤体积达到约100 mm3时对小鼠进行分组给药。帕博丽珠单抗(PD-1抗体)和抗人TNFR2抗体的给药剂量和频次如图所示。(A)肿瘤体积变化;(B)体重变化。数值为平均数± SEM。所有抗体均为自制。可以看出,两药联用比单药均有更强的肿瘤抑制作用,证明B-hPD-1/hPD-L1/hTNFR2小鼠是验证hPD-1抗体和hTNFR2抗体体内药效的有力临床前模型。
B-hIL2RA mice
品系名称:C57BL/6-Cd25tm1(CD25)/Bcgen
通用名:B-hIL2RA mice
背景:C57BL/6
货号:110066
抗人IL-2RA抗体体内药效
抗人IL-2RA抗体可抑制B-hIL2RA小鼠中MC38肿瘤的生长。小鼠结肠癌MC38细胞皮下移植至纯合B-hIL2RA小鼠(雌性,6-7周龄,n=8)。抗人IL-2RA抗体(211At-7G7/B6 和 M-A251)的给药剂量和频次如图所示。(A)肿瘤体积变化;(B)体重变化。数值为平均数± SEM。可以看出,B-hIL2RA小鼠是验证hIL-2RA抗体体内药效的有力临床前模型。
B-hGARP mice
品系名称:C57BL/6-Lrrc32tm1(LRRC32)/Bcgen
通用名:B-hGARP mice
背景:C57BL/6
货号:110102
抗鼠PD-1抗体和抗人GARP/latent-TGFb1抗体联合治疗
抗鼠PD-1抗体和抗人GARP/latent-TGFb1抗体联用可抑制B-hGARP小鼠中MC38肿瘤的生长。小鼠结肠癌MC38细胞(5x105)皮下移植至纯合B-hGARP小鼠(雌性,7周龄,n=6)。当肿瘤体积达到50-70 mm3时对小鼠进行分组给药。抗鼠PD-1抗体和抗人GARP/latent-TGFb1抗体(自制)的给药剂量和频次如图所示。(A)肿瘤体积变化;(B)体重变化。数值为平均数± SEM。可以看出,两药联用比单药均有更强的肿瘤抑制作用,证明B-hGARP小鼠是验证hGARP抗体体内药效的有力临床前模型。
B-hPD-1/hCD39 mice
品系名称:C57BL/6-Pdcd1tm1(PDCD1)Entpd1tm3(ENTPD1)/Bcgen
通用名:B-hPD-1/hCD39 mice
背景:C57BL/6
货号:121179
抗人CD39抗体和抗人PD-1抗体联合治疗
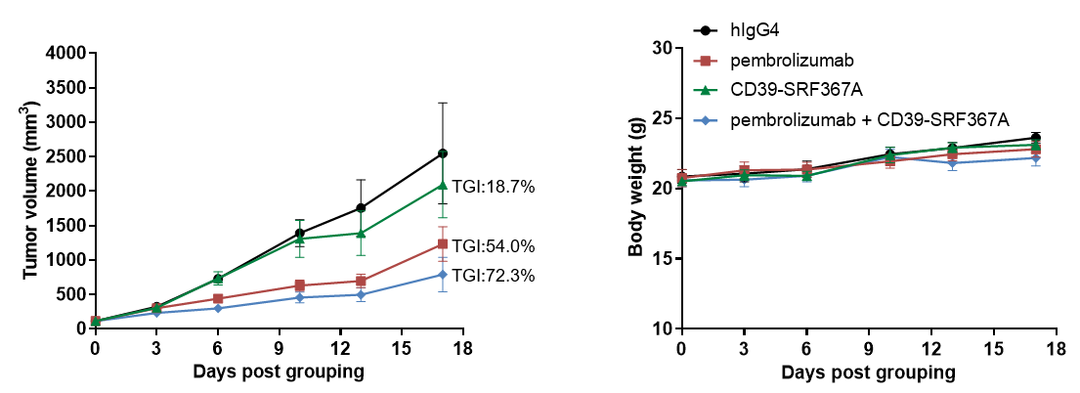
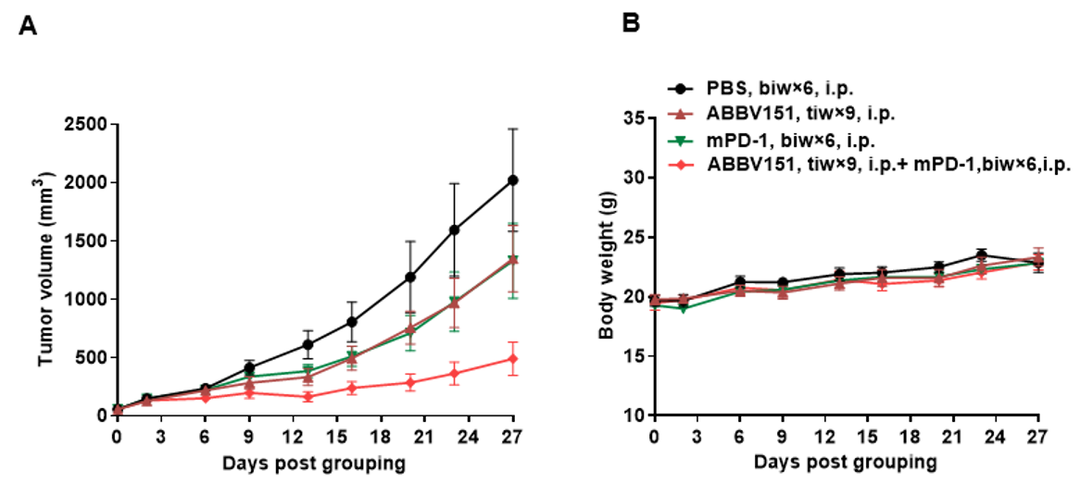
抗人CD39和抗人PD-1抗体联用可抑制B-hPD-1/hCD39小鼠中MC38肿瘤的生长。小鼠结肠癌B-hPD-L1 MC38细胞(5x105)皮下移植至纯合B-hPD-1/hCD39小鼠(雌性,7-8周龄,n=6)。当肿瘤体积达到100-150 mm3时对小鼠进行分组给药-帕博丽珠单抗(PD-1抗体)和抗人CD39抗体(SRF367A)。(A)肿瘤体积变化;(B)体重变化。数值为平均数± SEM。所有抗体均为自制。可以看出,两药联用比单药均有更强的肿瘤抑制作用,证明B-hPD-1/hCD39小鼠是验证hCD39抗体和hPD-1抗体体内药效的有力临床前模型。
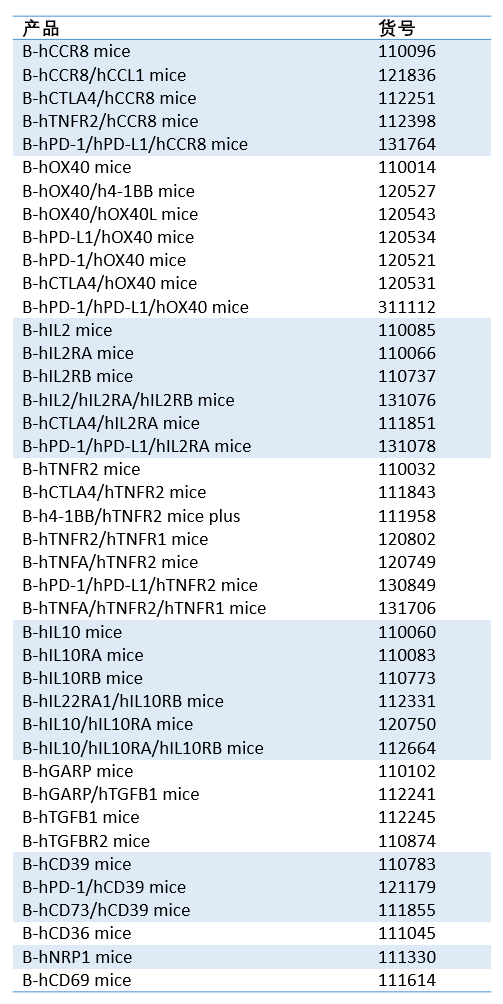
部分Treg靶点相关品系
参考文献
1. Shan, Feng et al. “Therapeutic targeting of regulatory T cells in cancer.” Trends in cancer vol. 8,11 (2022): 944-961. doi:10.1016/j.trecan.2022.06.008
2. Tawbi, Hussein A et al. “Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma.” The New England journal of medicine vol. 386,1 (2022): 24-34. doi:10.1056/NEJMoa2109970
3. Jung, Keunok et al. “A Neuropilin-1 Antagonist Exerts Antitumor Immunity by Inhibiting the Suppressive Function of Intratumoral Regulatory T Cells.” Cancer immunology research vol. 8,1 (2020): 46-56. doi:10.1158/2326-6066.CIR-19-0143
4. Lim, Seon Ah et al. “Lipid signalling enforces functional specialization of Treg cells in tumours.” Nature vol. 591,7849 (2021): 306-311. doi:10.1038/s41586-021-03235-6






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号