随着全球人口不断增长与老龄化的加剧,恶性肿瘤已成为威胁人类健康的主要因素,其疾病死亡率一直高居首位。近年来,免疫治疗在抗肿瘤治疗中的作用备受关注,基于免疫治疗的新药开发和标志物探索,成为了当前肿瘤研究的热点,这也对临床前研究中动物模型的建立和使用提出了更高的要求。
21世纪以后,人类的生物医学研究主要受限于生物体的复杂性,这使得临床前利用模式动物对抗肿瘤药物的研究评价显得尤为重要。但由于人与小鼠的物种差异和免疫排斥特性,简单的基因改造手段无法在小鼠身上创造出一个和人类免疫系统相似的免疫环境。如小鼠同种异体移植瘤模型、基因工程小鼠、人源性细胞系移植瘤模型、人源性肿瘤组织移植瘤模型等动物模型均缺乏人免疫系统及肿瘤免疫微环境,极大地限制了免疫机制及免疫治疗的转化研究。因此,既可以模拟人肿瘤特征又同时存在“人源化”免疫系统的免疫重建小鼠模型就成为了免疫肿瘤研发中的优质模型。
目前应用于临床前的免疫系统人源化小鼠模型主要有三类,一类是将成熟的人外周血单个核细胞(hPBMC)通过腹腔或者尾静脉注入免疫缺陷小鼠体内重建人的免疫系统,即hPBMC型;另一类是将人CD34+造血干细胞(HSC)通过腹腔或者尾静脉注入免疫缺陷小鼠,同样实现了人类免疫系统的重建,即HSC(CD34+)型;还有一类是移植胎儿胸腺和胎肝到经过辐照的重度免疫缺陷小鼠肾包膜下,同时接种人的骨髓造血干细胞进行免疫重建,即BLT模型。本文将重点介绍HSC免疫系统重建的小鼠模型。
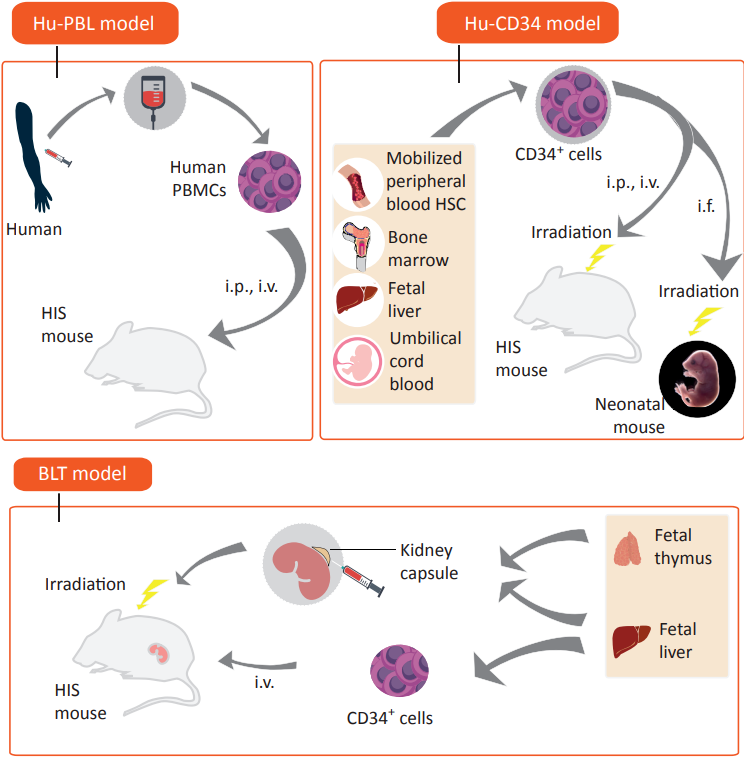
三种方式免疫重建小鼠[1]
HSC具有高度自我更新和多向分化潜能,是各种免疫细胞的共同祖先。HSC的分化依赖于骨髓和胸腺造血微环境,部分分裂增殖以维持数量相对恒定,部分增殖分化成表面标志为CD34+/CD38+的定向干细胞,包括淋巴系祖细胞(CLP)和髓系祖细胞(CMP)。CLP继续分化为T细胞、B细胞和NK细胞。CMP进一步分化为单核-巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、红细胞和血小板。HSC发育为成熟免疫细胞的每一阶段均需多种细胞因子的参与。
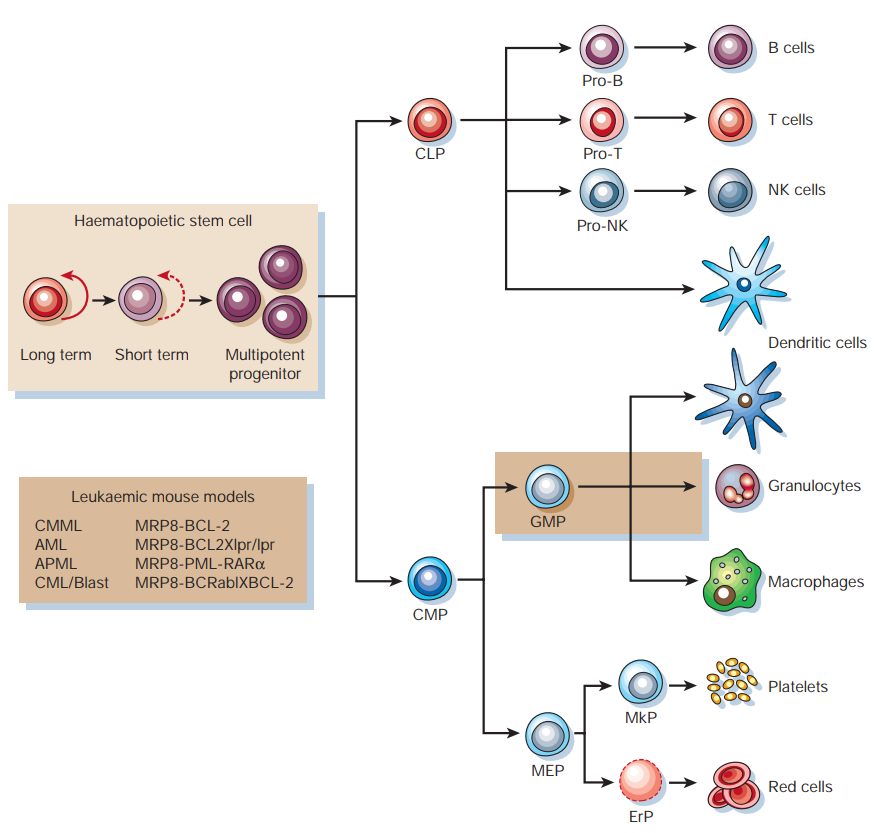
造血干细胞的发育[2]
免疫重建模型构建的第一步是要构建免疫缺陷小鼠模型。我们使用的B-NDG小鼠为百奥赛图自主研发的,缺乏成熟的T、B、NK细胞的重度免疫缺陷小鼠模型,是目前国际公认的免疫缺陷程度高、适合人源细胞或组织移植的工具小鼠。第二步即是在B-NDG及B-NDG衍生小鼠的基础上移植入人的免疫细胞、造血干细胞等,构建免疫系统重建小鼠,以能够更好的模拟人的免疫系统,进行免疫学研究和免疫药物评价。免疫重建小鼠模型可用于研究肿瘤在肿瘤微环境中的生长情况以及肿瘤细胞与免疫细胞之间的相互作用。具体可应用于血液疾病、肿瘤免疫、造血和免疫学、人类疾病感染模型,以及免疫抑制剂、双特异性抗体等药物药效评价、ADCC效应功能等的研究。
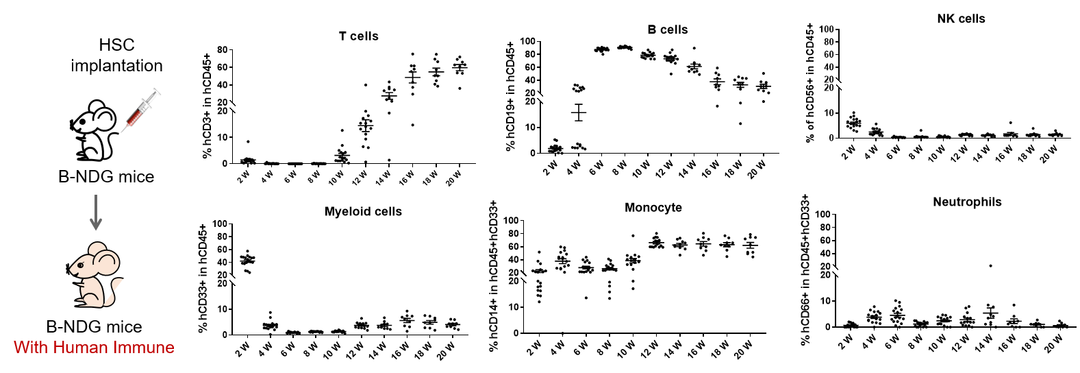
那我们是如何使用B-NDG小鼠建立HSC免疫重建模型,构建后的模型数据又是如何呢?
将1.5×105 CD34+ HSC 细胞接种到辐射后的B-NDG免疫缺陷小鼠体内,会使HSC发育成T、B、NK细胞等,从而建立了人的固有免疫系统和淋巴细胞。HSC免疫重建模型相对来说,发生移植物抗宿主病(GvHD)的时间较晚,小鼠的生存期较长。
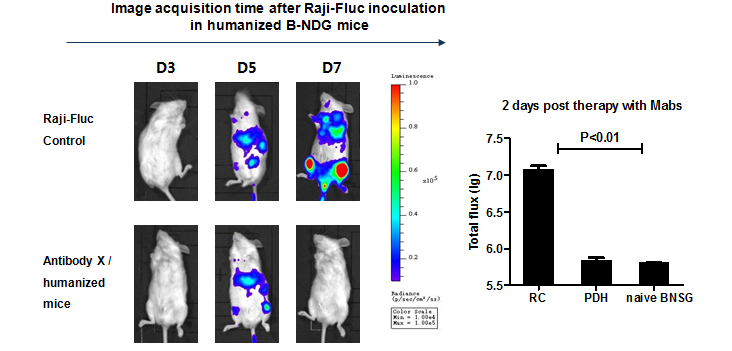
那么拿到HSC(CD34+)型的模式小鼠又能做些什么呢?下面我们来看一组数据,如图所示,在B-NDG小鼠上进行CD34+免疫重建,静脉注射5×105 Raji-Fluc细胞,5天后再给小鼠静脉注射人源PD-1抗体,2天后可见抗体对肿瘤细胞有明显的抑制作用。说明HSC(CD34+)重建的B-NDG小鼠是CDX药效试验的有效模型。
此外,我们也可以利用此模型进行双特异性抗体药效评价或者免疫检查点药物和其他药物联用,比如PD-L1抗体与CD47抗体联合用药,这不仅能达到验证人的抗体药效作用,同时由于使用的是人源细胞系或PDX样本,且免疫系统环境高度人源化,实验结果具有更高的可靠性和参考价值。
但这种重建方法也存在一些局限性,例如小鼠体内缺乏人的细胞因子,人类干细胞在小鼠体内发育受限等。于是研究人员也尝试通过基因工程敲入人的细胞因子基因来代替小鼠的基因,可以使组织、细胞中人类细胞因子适当表达[3]。
huHSC-B-NDG hIL15 mice
IL15(interleukin 15)是一种编码白细胞介素家族蛋白的多效细胞因子,在先天性和适应性细胞稳态以及外周免疫功能中发挥重要作用。IL15支持先天淋巴样细胞的发育,通过对IL15转基因小鼠和IL15敲除小鼠的研究表明,IL15在NK细胞、自然杀伤性T细胞(NKT)和记忆性CD8+T细胞的发育中起着至关重要的作用。移植人造血干细胞(HSCs)的小鼠模型表明,人IL15是移植后人NK细胞发育所必需的细胞因子。

人NK细胞发育示意图[4]
百奥动物开发了B-NDG hIL15小鼠,将人IL15基因的编码序列(CDS)插入小鼠IL15基因的5’UTR后,使小鼠表达人的IL15,但不表达鼠的IL15。该小鼠具有B-NDG小鼠背景,同时表达人IL15,将人HSCs移植到B-NDG hIL15小鼠,不管是成体鼠还是新生鼠,与B-NDG小鼠相比,人NK细胞的重建率都有明显提高。B-NDG hIL15小鼠可以用来研究人NK细胞的发育与功能、评价依赖NK细胞发挥作用特别是具有ADCC功能的抗体药效的有力工具。
在B-NDG hIL15小鼠中移植CD34+ HSCs增强人NK细胞的重建(成体鼠)
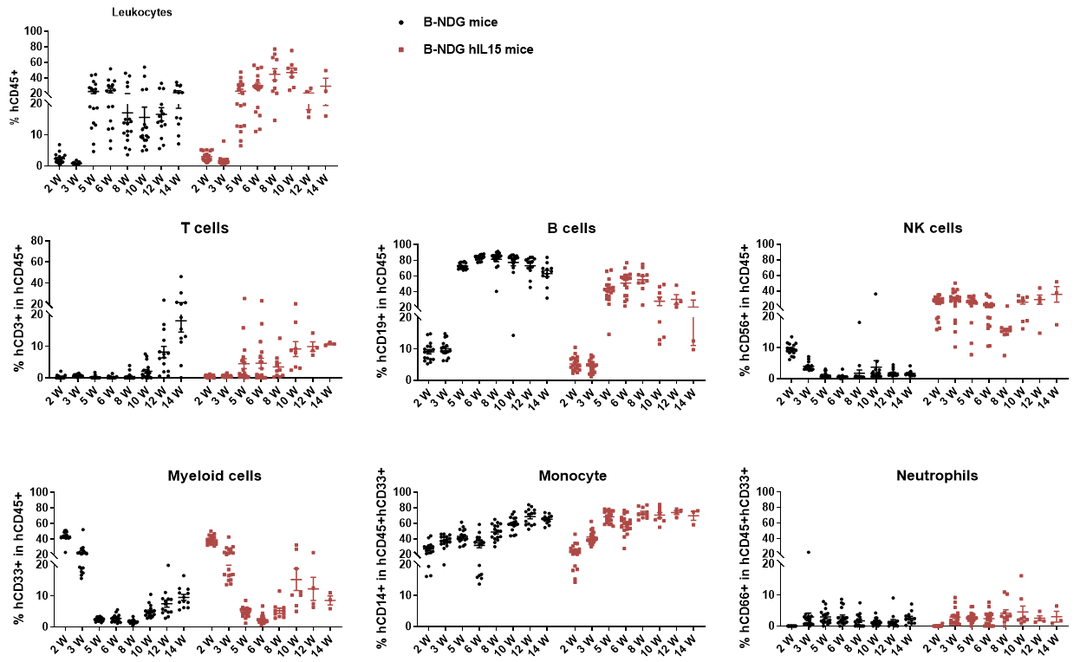
雌性6周龄的B-NDG小鼠(n=17)和B-NDG hIL15小鼠(n=19)分别经1.6Gy照射后,通过尾静脉注射人HSCs (1.5E5),在不同的时间点取外周血检测各类型人免疫细胞的重建水平。结果显示:与B-NDG小鼠相比,B-NDG hIL15小鼠中重建的人NK细胞比例显著性增高,从重建2周到14周都能比较稳定地维持较高比例。
利用人HSCs重建人免疫系统的B-NDG hIL15小鼠肿瘤模型能有效验证抗人CLDN18.2抗体的药效(成体鼠)
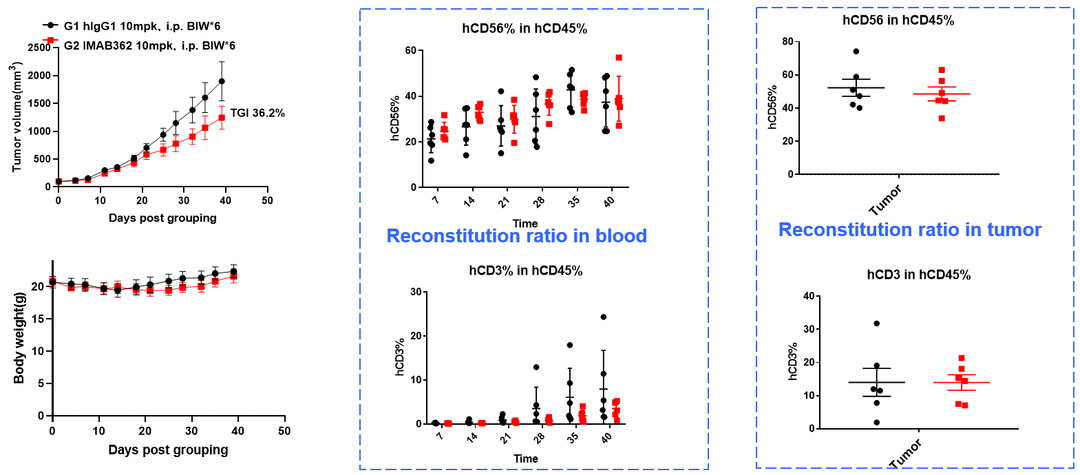
5周龄的B-NDG hIL15小鼠经1.2 Gy照射后,通过尾静脉注射人HSCs (1.5E5), 6周后皮下注射人CLDN18.2过表达的人肺癌B-hCLDN18.2 A549细胞(1E7),7天开始腹腔注射抗人CLDN18.2抗体(zolbetuximab,内部合成),每周取外周血检测人NK细胞和T细胞的重建水平,实验终点时取肿瘤组织检测浸润的人NK细胞和T细胞水平。结果显示:在重建人免疫系统的B-NDG hIL15小鼠肺癌模型中,抗人CLDN18.2抗体能有效抑制肿瘤的生长,肿瘤抑制率是36.2%;外周血及肿瘤组织中都能检测到较高水平的人NK细胞;外周血及肿瘤组织中也能检测到人T细胞,但人T细胞的重建较人NK细胞重建较慢,在外周血中的人T细胞水平维持逐渐升高的趋势。
若想减少CD34+ HSC细胞数量的使用,可以使用新生鼠进行免疫重建实验。
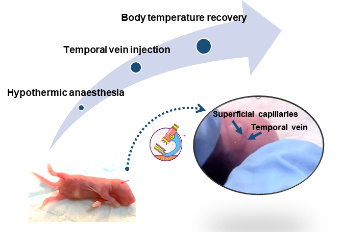
新生鼠免疫重建实验
新生鼠与成体鼠HSC免疫重建对比
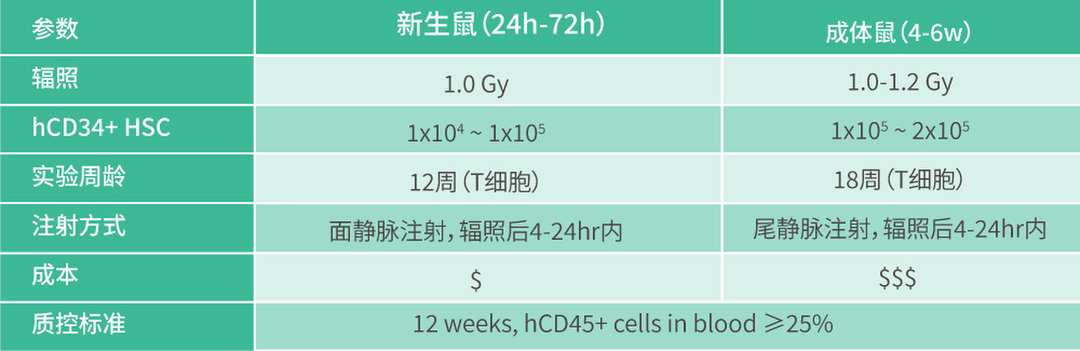
使用新生鼠移植人CD34+ HSCs重建人免疫系统的方法与特点
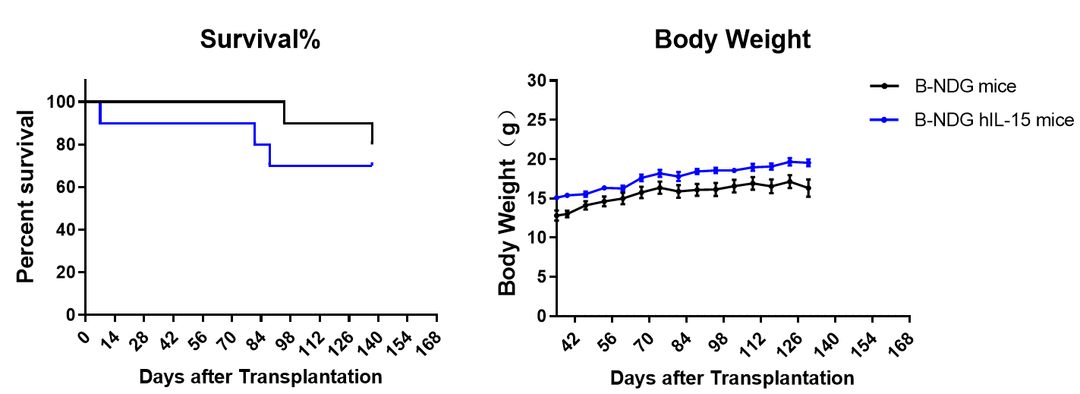
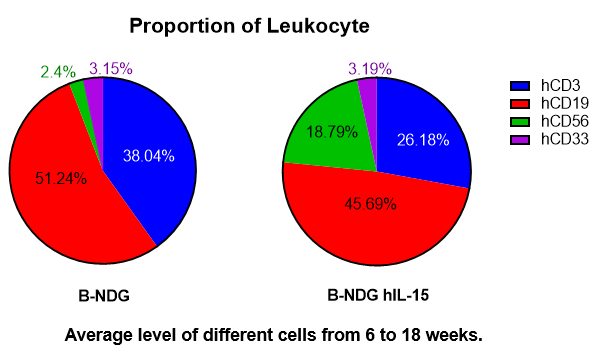
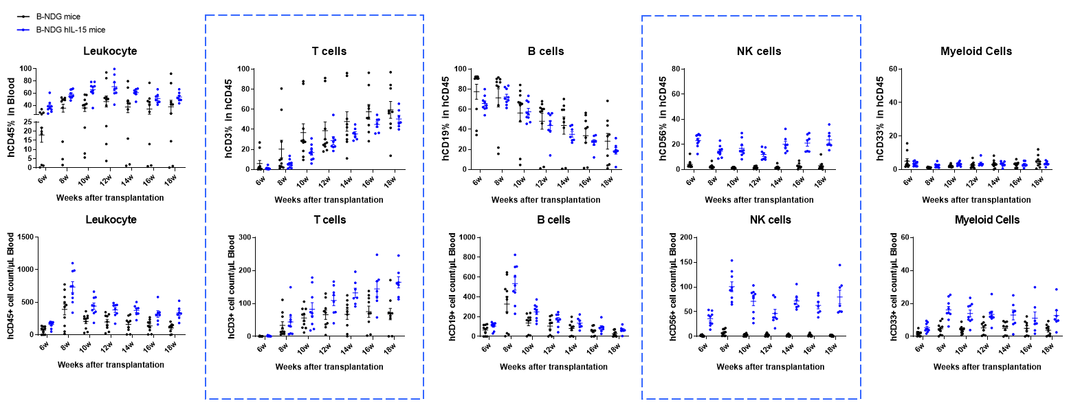
在新生的B-NDG hIL15小鼠中移植人CD34+ HSCs能重建功能性人NK细胞
出生后24-48h的B-NDG小鼠(n=10)和B-NDG hIL15小鼠(n=10)分别经1.0、0.9 Gy辐射后,通过颞静脉注射人CD34+ HSCs (3E4),在不同的时间点取外周血检测各类型人免疫细胞的重建水平。结果显示:与B-NDG小鼠相比,B-NDG hIL15小鼠中重建的人NK细胞比例显著性增高,从重建6周到18周都能比较稳定地维持较高比例。
此外,通过将不同种类的肿瘤细胞系移植入免疫重建的小鼠的体内构建的CDX模型,我们可以最大限度地利用小鼠模型模拟人体内免疫系统的响应情况,为研究肿瘤在人体内的生长状态提供了最优模型。

百奥动物开发了一系列免疫系统重建的小鼠模型,huHSC-B-NDG hIL15 mice目前保持大量稳定现货供应,欲购从速!

百奥赛图自主开发的B-NDG系列小鼠,其成熟的T、B和NK细胞全部缺失,是目前公认的免疫缺陷程度高、非常适合人源细胞或组织移植的工具小鼠,在此基础上百奥动物开发了一系列二代鼠,详情可扫描下方二维码了解,如有需要请随时与我们联系!

参考文献:
[1] De La Rochere P, etc. Humanized Mice for the Study of Immuno-Oncology. Trends Immunol. 2018 Sep;39(9):748-763.
[2] Reya T, etc. Stem cells, cancer, and cancer stem cells. Nature. 2001 Nov 1;414(6859):105-11.
[3] Rongvaux A, etc. Development and function of human innate immune cells in a humanized mouse model. Nat Biotechnol. 2014 Apr;32(4):364-72.
[4] Fehniger, etc. Interleukin 15: biology and relevance to human disease. Blood 97, 14-32.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号