尽管在过去三十多年中传统的单克隆抗体或者双/多特异性抗体作为主流的成药形式在治疗性生物大分子药物研发中举足轻重,单域抗体(sdAb)和纳米抗体(nanobody/VHH)基于其结构域小、稳定性好、给药途径灵活和生产成本低等特点逐渐显示出独特优势。2019年美国FDA批准了赛诺菲公司的卡普赛珠单抗(caplacizumab)用于治疗罕见血栓性血小板减少性紫癜,这打开了纳米抗体在治疗性大分子药物研发中的思路。
Nanobody (Nb)
相比于研究火热的单抗药物,纳米抗体行业目前关注度低,但在技术前瞻性、疗法颠覆力上令人期待。1989年比利时科学家首次在骆驼血液中发现纳米抗体,2007年由Ablynx研发的首个纳米抗体进入临床试验;2018年全球首个纳米抗体Caplacizumab欧盟获批上市。2019年纳米抗体全球销售规模约5600万欧元,2020年销售额1.13亿欧元,增加105.4%。纵观国内,康宁杰瑞在该赛道布局接近国际步伐,于2016年申报KN-035产品(PD-L1靶点,单链抗体FC融合)临床试验,并在2021年在中国获批上市(全球首个皮下注射的纳米抗体药物)。国内其他企业尚未有实质性突破推进。
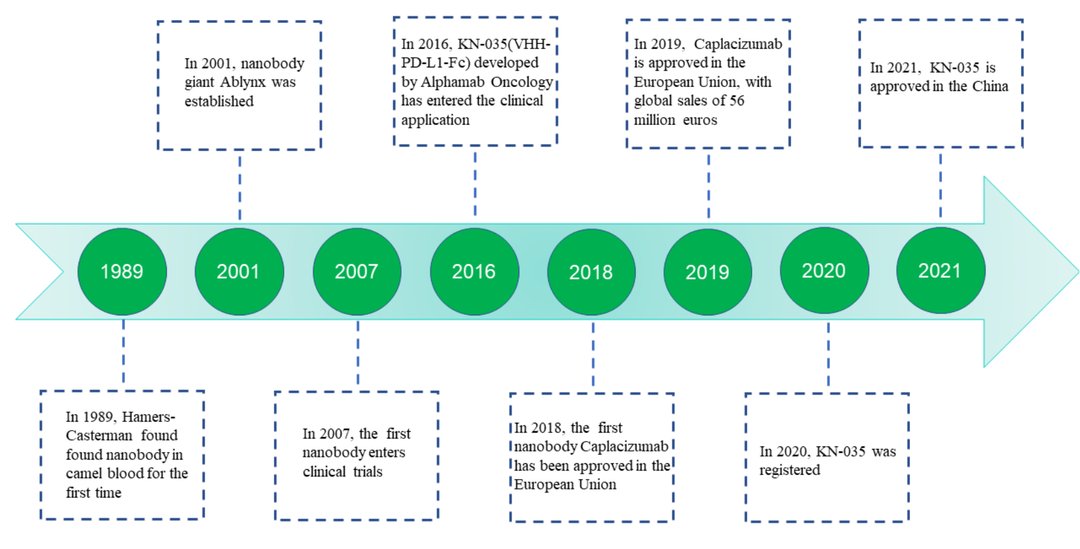
图1 纳米抗体药物开发代表性历程时间表
01、Nb的筛选
Nb是驼科动物外周血中一种天然缺失轻链只含有重链的抗体。Nb的获得首先需要选择驼科动物进行免疫,免疫周期一般为5~10周。一般流程是从免疫骆驼的外周血中提取效应B细胞,然后从效应B细胞中提取总RNA,通过逆转录-PCR技术获得cDNA片段,以此为模板扩增出VHH基因片段。利用噬菌体展示技术从噬菌体载体构建后的纳米体文库中筛选并富集具有特异性结合能力的Nb -噬菌体,并构建Nb表达系统,用于表达蛋白并进行功能验证。虽然制备过程相对复杂,但随着噬菌体展示技术、核糖体展示技术等分子生物学技术的发展,Nb的筛选方法正在逐步优化。
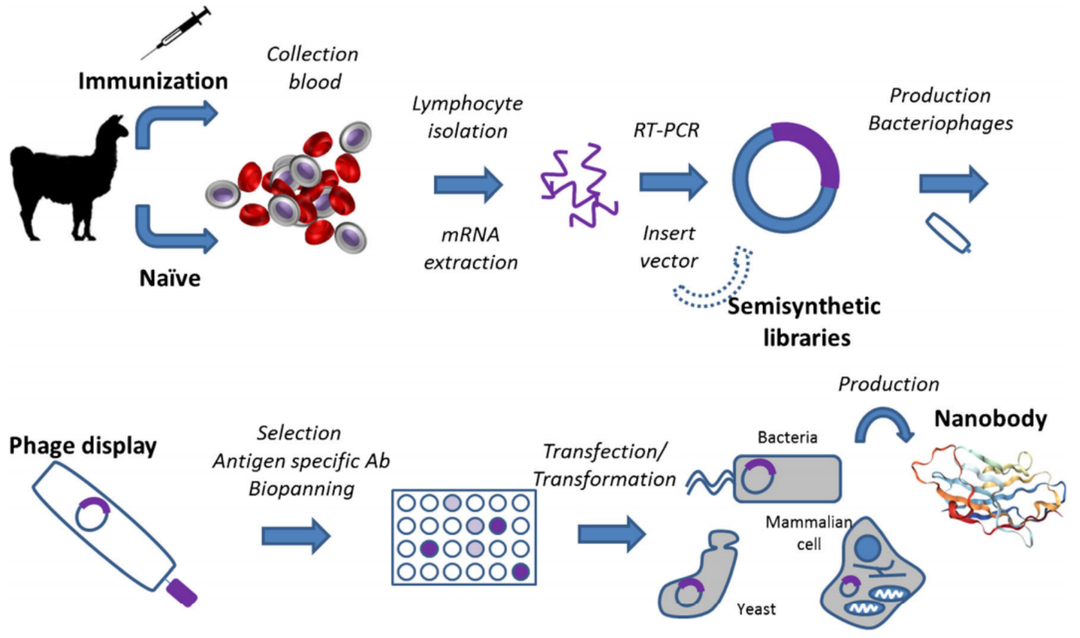
图2 纳米抗体筛选流程
02、Nb的结构
纳米抗体一般结构呈椭圆形,体积很小,分子质量为单克隆抗体的1/10(15kD),与普通抗体相比,化学性质更加活泼,具有亲和力强,能更有效地与抗原缝隙结合的优势。重链抗体的基因组中存在恒定区(constant region of heavy chain 1,CH1),它是轻链锚定的部位,但在mRNA形成中被剪切掉,所以抗体缺失轻链。骆驼的重链抗体含有一个铰链区,两个恒定区(CH2和CH3)和独特的重链可变区(VHH)。与骆驼的重链抗体相比,纳米抗体仅由重链可变区组成。纳米抗体的二级结构是2个β片层形成支架,3个高变区聚集在一侧参与抗原识别。
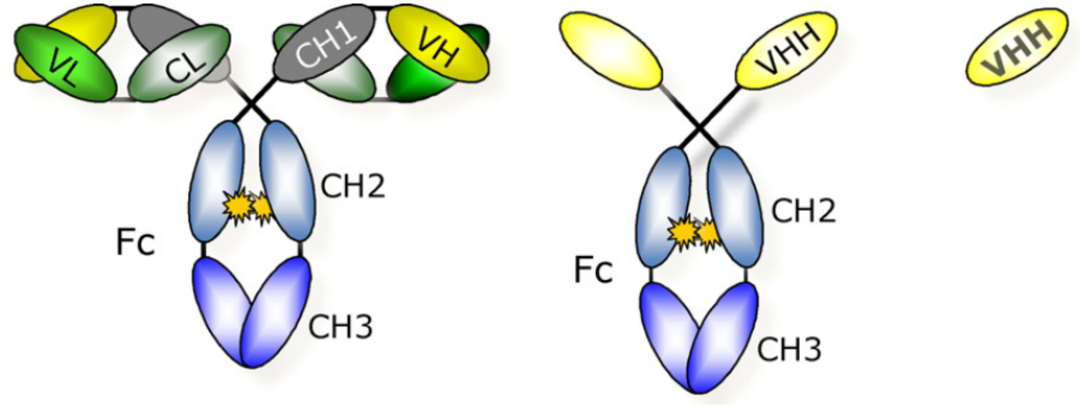
图3 单抗、重链抗体与Nb的结构模式图
骆驼源VHH(即Nb)和人体VH的基因同源性达到80%~90%,结构十分相似,都包含3个高变区(hypervariable region, HVR)和4个骨架区(framework Region, FR)。通过比较发现,骆驼VHH 与人体VH之间存在微小但不容忽视的区别,主要包含两方面:1)它们的互补决定区(complementarity determining region, CDR)不同。VHH的CDR1和CDR3比VH更长。VHH的CDR3长度为16~18个氨基酸,而人和小鼠VH的平均长度分别只有14和12个氨基酸。2)它们的区别在于FR2中的氨基酸。普通抗体的FR2中V37、G44、L45和W47这4个氨基酸残基是疏水性残基,在进化中是相当保守的。而VHH中,它们突变为亲水性的氨基酸残基F37、E44、R45、G47,增加了VHH的溶解性。因此,将人源抗体VH结构域FR2中的一些氨基酸进行VHH特征性改造,可以获得稳定性好、溶解性好,并且保持原有抗体特异性和亲和力的VHH抗体。
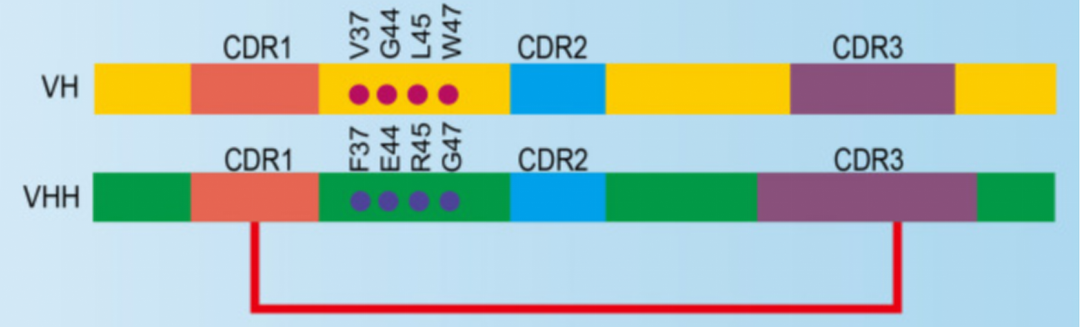
图4 人源VH和骆驼源VHH基因序列
03、Nb的特性
纳米抗体是改善传统单克隆抗体(mAbs)理化性质并保持其抗原性的良好候选材料,其亲和力往往更高。基于驼科动物重链抗体的VHH单域抗体的特殊结构,兼具了传统抗体与小分子药物的优势,几乎完美克服了传统抗体的开发周期长,稳定性较低,保存条件苛刻等缺陷,逐渐成为新一代治疗性生物医药与临床诊断试剂中的新兴力量。
相比于常规抗体,纳米抗体的优势有:
1)分子量小,易于渗透进致密组织甚至是血脑屏障;
2)亲和力高、特异性强、溶解性及稳定性好;
3)人体的免疫原性弱,生物相容性好;
4)原核或真核系统中高表达,易于生产;
5)Nb结构简单,易于工程化改造。
基于Nb的特性,使得其在疾病诊断与治疗中具有独特优势。
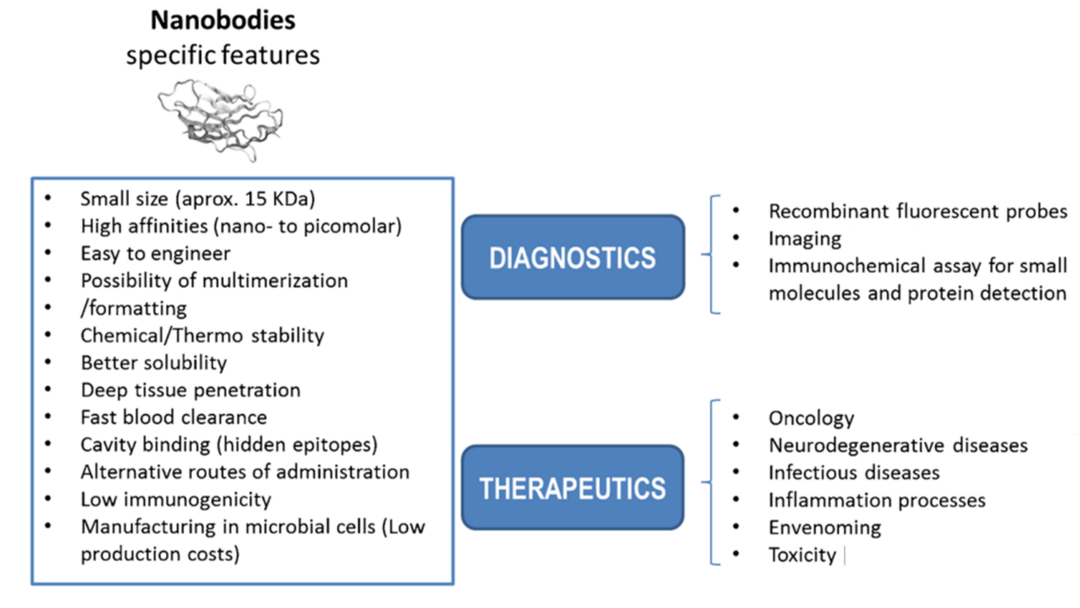
图5 Nb的特性
04、Nb的研发现状
纳米抗体目前有两款上市药物,临床在研数量全球范围内有20余个。Ablynx作为纳米抗体药物研发的巨头,拥有多达40多个候选药物,应用于癌症、自身免疫病、呼吸系统疾病、血液系统疾病等多个不同领域。截止2017年9月,Ablynx已累计与辉瑞、礼来、诺华、勃林格殷格翰、赛诺菲等国际药企达成超过70亿欧元的合作。
两款已上市产品中,Caplacizumab作为一种抗vWF的人源化、仅包含二价可变结构域的免疫球蛋白片段, 能够靶向vWF的A1结构域,用于治疗血小板减少性紫癜,由于市场上并无该疾病的治疗药物,其在2009年获得孤儿药资格。2018年获欧盟委员会批准上市,用于治疗成年获得性血栓性血小板减少性紫癜(aTPP)。此外,是康宁杰瑞自主研发的PD-L1纳米抗体Fc融合蛋白,是全球第一个且目前唯一获批上市的皮下注射PD-L1抗体。这两款基于纳米抗体的药物Caplacizumab和KN-035相继获批上市,将纳米抗体的研发推向新的台阶。
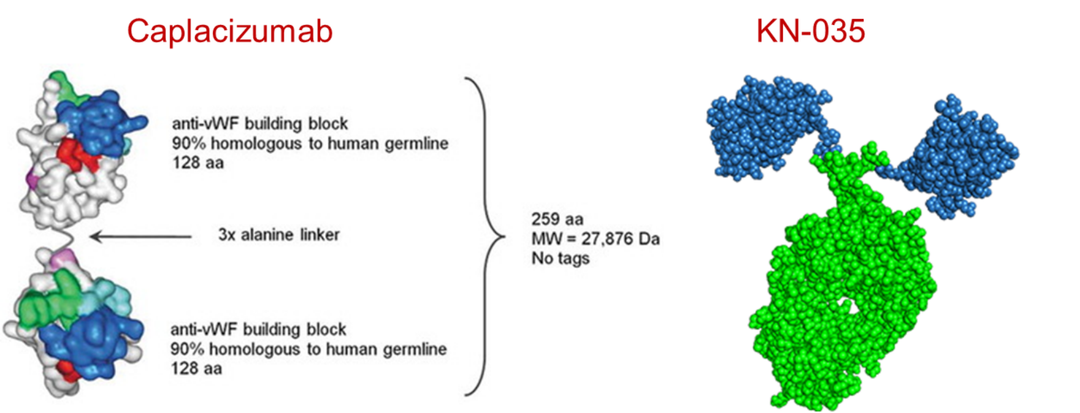
图6 Caplacizumab和KN-035的晶体结构
国内多家公司也开展了纳米抗体的研发项目。普瑞金科技拥有独家自主知识产权的融合纳米抗体平台,其搭载人源化纳米抗体的BCMA CAR-T因在临床上的优异表现备受关注。同时博生吉公司开发的一系列CD7纳米抗体,具有不同的抗体亲和力和抗原识别表位,可以满足临床上针对不同的CD7表达水平的恶性肿瘤的要求。在前期临床前研究中表现出了良好的抗肿瘤效果和安全性。
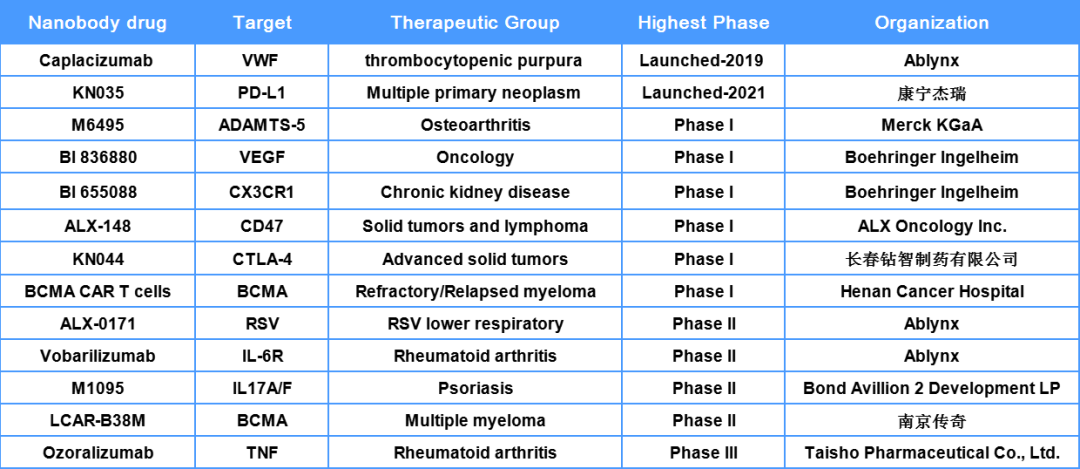
下表整理了目前在研的一些基于纳米抗体的药物项目:
基于骆驼属动物的纳米抗体和基于鲨鱼的VNAR虽然在临床研究中被广泛探索,人源化以及跨种属所带来的免疫原性仍然是一个挑战。RenNano小鼠是百奥赛图为解决此类挑战特别研发的全人源纳米抗体鼠。RenNano具有和RenMab、RenLite完全相同的重链多样性,经体内免疫系统优化所产生的纳米抗体具备成药性好、稳定性高、后期生产成本低周期短等特点。在新药研发中,RenNano小鼠能够对纳米抗体的生产提供极大的便利。
05、Nb的应用
疾病体外诊断
纳米抗体具有较强的表位识别与结合能力,其构建及表达过程甚至不需要纯化的抗原。纳米抗体体积小,使其能够以高密度牢固地结合于固相载体捕捉微量抗原。这些特性是常规单抗甚至单域抗体所不及的。因此,可以充分发挥以纳米抗体为基础的免疫检测方法的作用,检测与鉴别临床上较难检出的靶点以及外来病原物或毒素。如EGFR在许多肿瘤中过度表达,并且是肿瘤药物靶向的极具吸引力的靶点。目前已开发了靶向EGFR的纳米抗体,并成功应用于乳腺癌、卵巢癌、前列腺癌的诊断。此外,纳米抗体被用于分子成像技术,如正电子发射断层扫描 (PET) 、单光子发射计算机断层扫描 (SPECT)、近红外荧光成像 (NIR) 和超声分子成像而用于疾病的诊断。
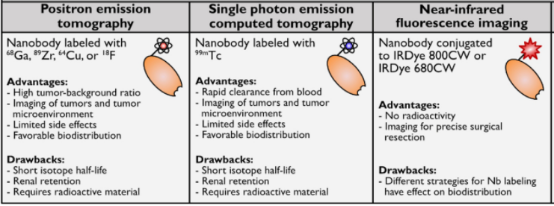
图7 Nb用于分子成像技术
疾病治疗
纳米抗体自身的高亲合力和特异性,使得它更容易在阻塞部位与癌症细胞上的受体靶向结合,渗入到血管少的组织内。同时鉴于纳米抗体的低免疫原性,将纳米抗体对小鼠进行重复给药,经检测没有引起任何体液和细胞免疫反应,对疾病的治疗有重要意义。
1)基于纳米抗体的载体递送系统
将纳米抗体修饰到纳米药物载体上(如脂质体、胶束、白蛋白及铁蛋白类的纳米颗粒和聚合物类多聚体等),可以实现基于纳米抗体的抗癌药物向肿瘤组织的主动靶向。将纳米抗体偶联在纳米载体的表面,赋予了这种治疗性纳米颗粒靶向肿瘤的能力,增加了药物在肿瘤中的积累,减少了对正常细胞的损伤。研究者开发出了可利用肿瘤特异性受体的纳米抗体作为载体,用于将毒素或药物运送至肿瘤部位,实现定点释放药物或毒素,降低毒素对正常细胞的危害,减少副作用。纳米颗粒装载药物需要进一步克服的问题是溶解性差、不稳定及容易被机体清除等问题。
运载药物的载体通常包括脂质体、胶束、基于纳米抗体-白蛋白的纳米颗粒(NANAPs)、基于聚合物的囊泡或人工合成聚合物。通过一定的方法,药物如阿霉素(DOX)可进行氨基化修饰,纳米抗体自然或人为引入半胱氨酸(巯基),纳米抗体经过修饰后不改变其原有的结合活性。由于肿瘤血管的渗漏和淋巴引流,通过高通透性和滞留效应,促进纳米颗粒在肿瘤部位的富集。将纳米抗体包被在胶束表面,此种胶束本身具有抑制肿瘤生长的效果,纳米抗体-胶束上再通过共价偶联阿霉素,可以增强肿瘤的抑制效果,延长动物的生存时间。生物体血浆中含有大量的白蛋白,因此纳米抗体-白蛋白纳米颗粒与机体具有很好的生物相容性及安全性。
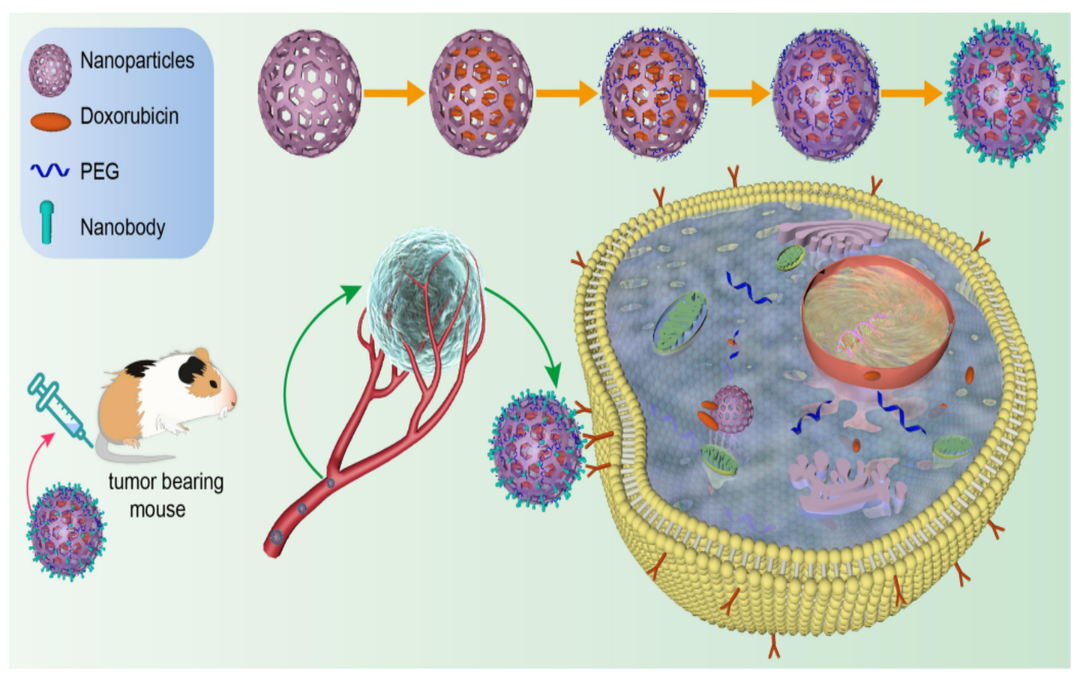
图8 基于纳米抗体的载体递送系统模式图
2)纳米抗体偶联药物(NDC)
作为特异性肿瘤靶向疗法家族的一份子, ADC (Antibody-Drug-Conjugates) 兼具小分子药物强大的杀伤力和纯单抗高度的靶向性,它可以借助抗体极高的特异性,将药物精确地投放到肿瘤细胞内,避免对体内正常细胞的杀伤,从而减少治疗过程中的不良反应。尽管有证据表明 ADC 的有效性,但在癌症治疗中使用单克隆抗体仍存在缺陷,部分肿瘤过大,导致抗体穿透能力有限。因此,较小的抗原结合片段,ScFv和Nb作为 ADC 的平台受到了关注。
NDC由Nb组成,其作为载体通过化学连接剂与化学药物共价结合。临床试验中,最好将Nb人源化,以避免引发任何免疫原性。NDC的靶向治疗效果与Nb的特异性/亲和力、所使用的化疗药物或抗癌药物的类型、位点特异性附着策略、化疗药物的位置以及化疗药物与Nb的偶联比例有关。NDC可利用Nb特异性靶向,将药物输送至肿瘤部位,然后NDC抗原复合体发生内化,通常通过受体介导的内吞作用,复合物在核内体/溶酶体中进一步处理,释放化疗药物进入细胞质,进而入核,干扰核内DNA的复制,从而抑制癌细胞的增殖,导致癌细胞凋亡。
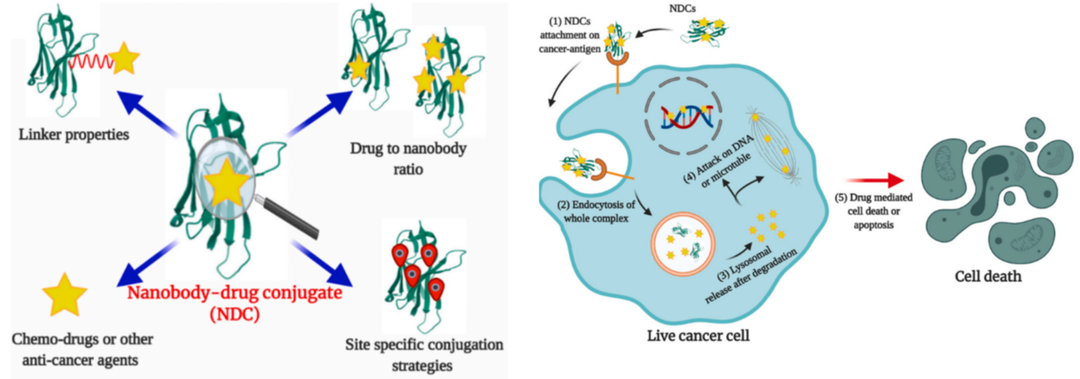
图9 NDC药物的合成及作用机制
3)基于纳米抗体的CAR-T靶点治疗
CAR-T细胞的靶向结构域主要基于ScFv,重链可变区和轻链可变区之间需要肽连接体,在CAR-T细胞输注后,由于连接体的免疫原性,宿主免疫系统可以通过形成中和抗体来介导针对此类连接体的免疫反应。而Nb缺乏这种合成的连接肽,且Nb的序列更类似于人类重链可变区,使得Nb在许多临床应用中更具相容性,免疫原性更低。此外,在人源化的背景下,Nb也往往比ScFv更具优势,因为Nb的人源化过程更容易。以人源化Nb或ScFv为靶向结构域的CAR-T已在众多临床研究中得到广泛评估。
将ScFv用作CAR靶向域的另一个限制是CAR聚集导致CAR-T耗竭。这种情况的发生与靶抗原的结合无关,可能起源于CAR的ScFv可变结构域。ScFv自聚集主要源于其可变结构域上自由暴露的疏水残基或较差的VH或VL结构域折叠稳定性。CAR-T表面的CAR聚集触发效应细胞的激活和细胞毒性信号级联,从而导致T细胞衰竭。相反,基于纳米抗体的CAR-T往往不具有CAR表面聚集和靶抗原非依赖性效应细胞激活的局限性。纳米抗体的这种优势是研究它们作为CAR靶向域ScFv替代品的主要原因之一。
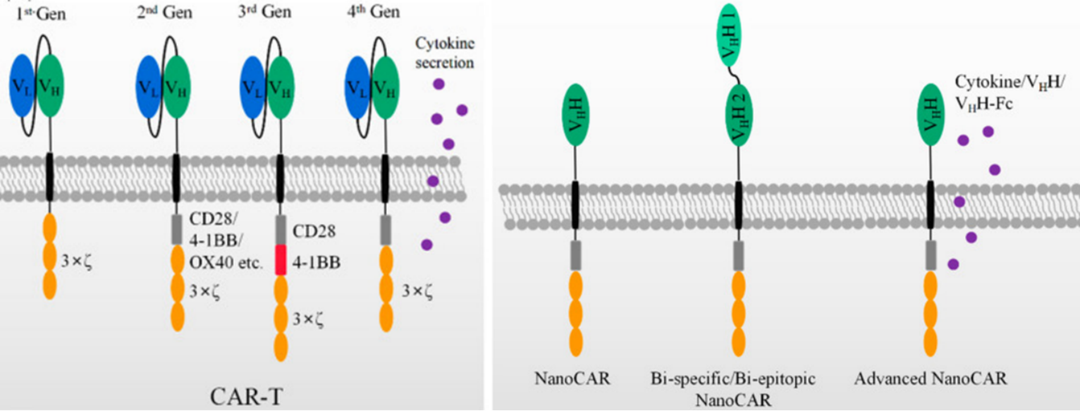
图10 ScFv及Nb与Car-T连接的模式图
4) 抗病毒感染治疗
Nb可中和病毒,是治疗动、植物病毒感染的理想工具。SARS-冠状病毒-2 (SARS-CoV-2)的出现导致了一种全球性的流行病,比以往的冠状病毒传播性更强,不同的纳米抗体已经被开发用于高亲和力结合受体结合域(RBD),竞争性地抑制RBD与人血管紧张素转换酶2 (ACE2)的相互作用并中和病毒,Nb主要依赖于3个可变区,CDR1、CDR2、CDR3形成的抗原结合位点,Nb相关技术的成熟揭示其可作为高效的中和剂,抵御致病性冠状病毒的侵袭。
研究者从人源化合成VHH文库中成功筛选到SARS-CoV-2的中和纳米抗体。通过SARS-CoV-2的S蛋白结合实验,筛选出了69个可以与S蛋白结合的特异性纳米抗体,其中15个纳米抗体可以阻断S蛋白与ACE2受体结合;又通过构建不同的纳米抗体组合,提高了对S蛋白RBD的亲和力,并且可以有效抑制SARS-CoV-2的感染;此外将所获得的纳米抗体与人IgG-Fc融合后,发现可以提升抑制SARS-CoV-2感染细胞的作用。该项研究表明其所获得的纳米抗体可以被用于新冠病毒的诊断与治疗。
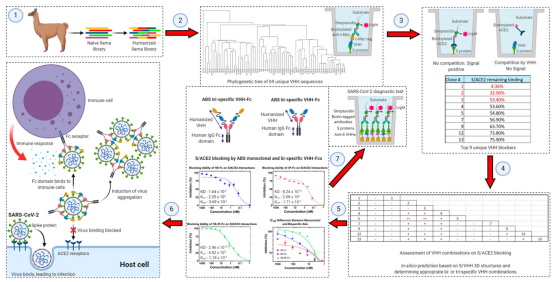
图11 Nb与SARS-冠状病毒-2 (SARS-CoV-2)
总结
总的来说,纳米抗体在疾病诊断和治疗中具有重要作用,其特性从根本上不同于传统的双链结构抗体。纳米抗体分子量小,结合抗原特异性强、亲和力高,稳定性好,使其能够成功地靶向肿瘤、肿瘤微环境和病毒感染的抗原等。纳米抗体越来越多地被用作分子成像技术的诊断工具,成功的早期临床试验也证明了这一点。作为治疗剂,纳米抗体可以帮助递送药物,并可用于CAR-T 细胞治疗和病毒感染治疗。纳米抗体的全部可能应用还有待探索,但作为一种新型的抗体,其将持续在领域内发光发热。
参考资料
[1] Salvador J, Vilaplana L, Marco M. Nanobody: outstanding features for diagnostic and therapeutic applications[J]. Analytical and bioanalytical chemistry, 2019, 411(9): 1703-1713.
[2] Muyldermans S, Baral T N, Retamozzo V C, et al. Camelid immunoglobulins and nanobody technology[J]. Veterinary immunology and immunopathology, 2009, 128(1-3): 178-183.
[3] Sun S, Ding Z, Yang X, et al. Nanobody: a small antibody with big implications for tumor therapeutic strategy[J]. International Journal of Nanomedicine, 2021, 16: 2337.
[4] Liu M, Li L, Jin D, et al. Nanobody—A versatile tool for cancer diagnosis and therapeutics[J]. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 2021, 13(4): e1697.
[5] Vishwakarma P, Vattekatte A M, Shinada N, et al. VHH Structural Modelling Approaches: A Critical Review[J]. International Journal of Molecular Sciences, 2022, 23(7): 3721.
[6] Verhaar E R, Woodham A W, Ploegh H L. Nanobodies in cancer[C]//Seminars in immunology. Academic Press, 2021, 52: 101425.
[7] Massa S, Xavier C, De Vos J, et al. Site-specific labeling of cysteine-tagged camelid single-domain antibody-fragments for use in molecular imaging[J]. Bioconjugate chemistry, 2014, 25(5): 979-988.
[8] Bao C, Gao Q, Li L L, et al. The application of nanobody in CAR-T therapy[J]. Biomolecules, 2021, 11(2): 238.
[9] Dong J, Huang B, Jia Z, et al. Development of multi-specific humanized llama antibodies blocking SARS-CoV-2/ACE2 interaction with high affinity and avidity[J]. Emerging microbes & infections, 2020, 9(1): 1034-1036.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号