B7-H4,又被称为B7S1,B7x,VTCN1(V-set domain-containing T-cell activation inhibitor 1),属于B7家族,是I型跨膜蛋白,在正常健康组织中B7-H4处于相对低的表达水平,在很多实体瘤中高表达,B7-H4也可作为肿瘤的biomarker,其表达水平和预后呈负相关。一些炎症因子的微环境能够促进肿瘤细胞及单核细胞、巨噬细胞上B7-H4分子的表达。目前B7-H4在T细胞表面的受体还没有被鉴定出来,实验证明B7-H4可以和T细胞结合,抑制T细胞的活性。
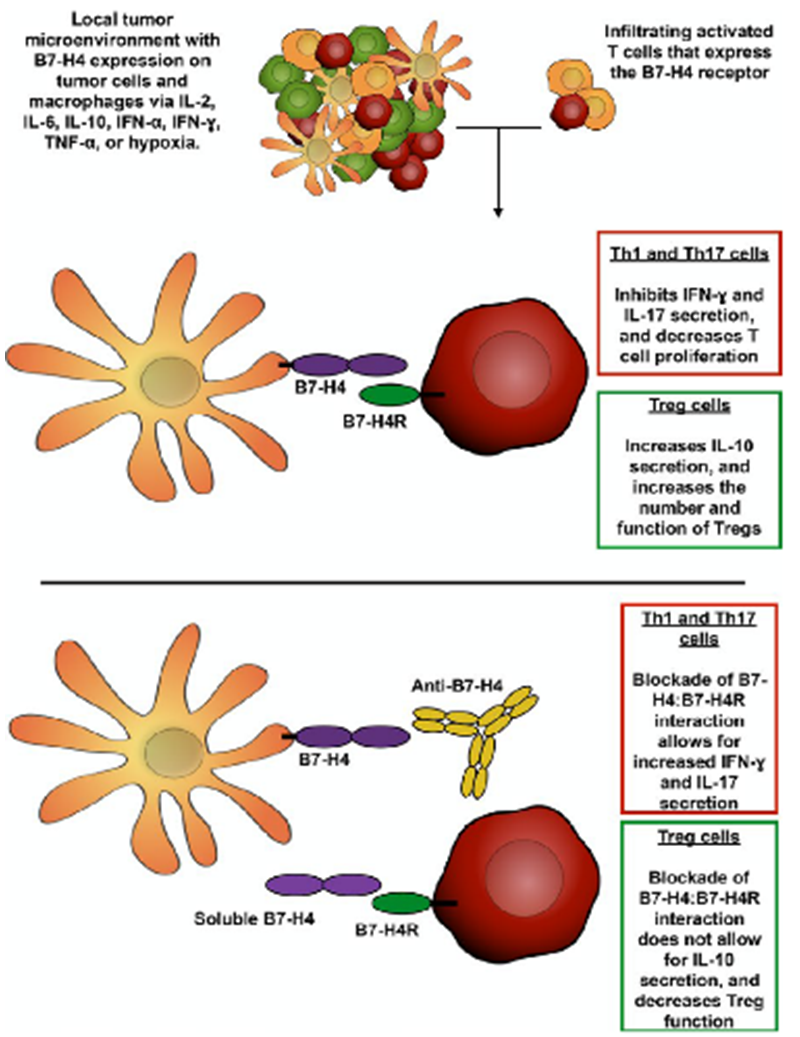
B7-H4作用机制
药物研究进展
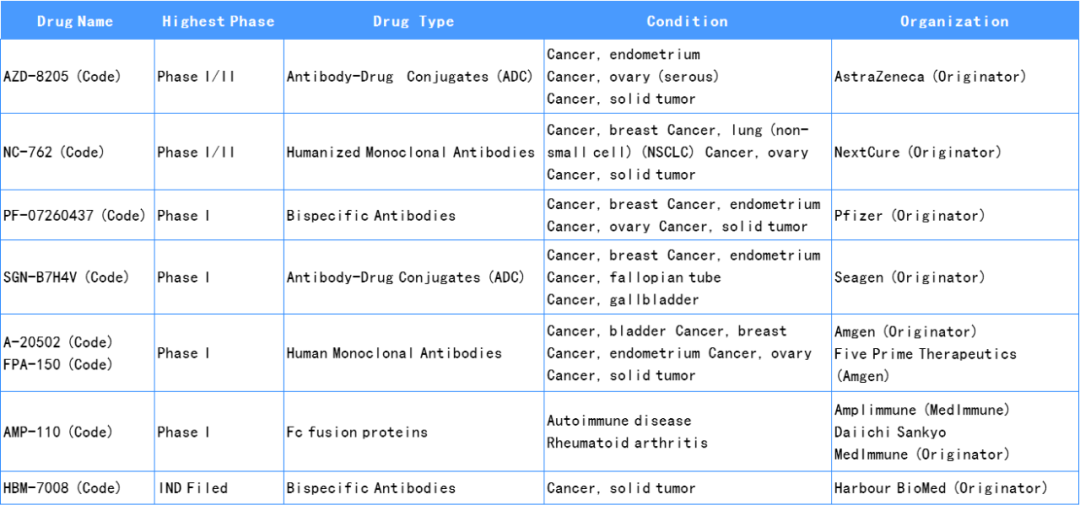
部分药企近年来开始在B7-H4靶点布局,豪森药业、阿斯利康、NextCure等处于领先地位。豪森药业、阿斯利康主要开发B7-H4 ADC,NextCure开发Fc effector效应增强型抗体。
Five Prime Therapeutics开发的FPA150(First-in-class)是靶向B7-H4的全人源抗体,能够阻断T细胞检查点途径并且具有增强的抗体依赖性细胞介导的细胞毒性。它是第一个靶向B7-H4进入临床阶段的治疗性单抗。目前处在 I 期临床阶段,进行单药或与PD-1联用测试,临床的安全性较好。
2022年3月25日,阿斯利康AZD8205在国内申报临床,该产品是一款靶向B7-H4的抗体-药物偶联物(ADC),也是继豪森药业后,国内第2家申报该靶点的ADC药物。
2021年第一季度NextCure向FDA提交了DLE突变的ADCC增强型B7-H4抗体NC762的IND申请,并于2021年7月开启了NC762在肺癌、HER2+乳腺癌、卵巢癌或其他潜在肿瘤类型患者中的1/2期临床试验。预计将在2022年年中公布 I 期临床试验阶段的初始数据。
表1. 关于B7-H4部分药物研究进展
科睿唯安
虽然目前并无B7-H4药物上市,但B7-H4在卵巢癌、乳腺癌、膀胱癌、胰腺癌等人不同的肿瘤组织中的高表达,表明B7-H4靶点在肿瘤药物研发中的巨大潜力,可开发单抗,联用或双抗。随着各大药企对B7-H4靶点的深入研究,相信市场前景会更加广阔。
百奥动物自主研发B-hB7-H4人源化小鼠,助力B7-H4靶向药物开发,为临床前药效评估提供了优质模型。
B-hB7-H4人源化小鼠
NO.01 基本信息

NO.02 mRNA表达分析

小鼠B7-h4 mRNA仅在野生型小鼠卵巢中检测到(+/+)。人B7-H4 mRNA仅在纯合子B-hB7-H4小鼠(H/H)中检测到,在野生型小鼠中未检测到。
NO.03 蛋白表达分析
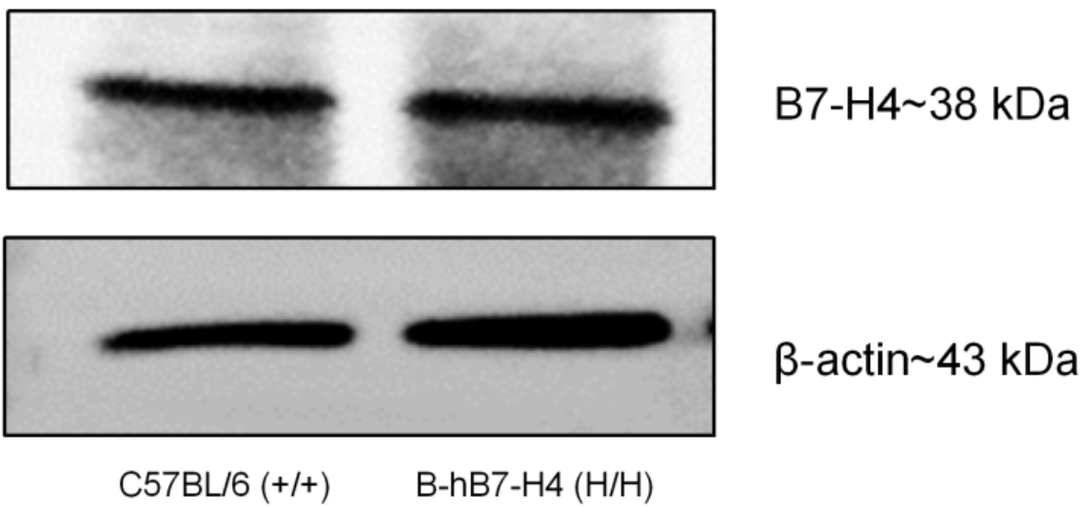
利用western blot检测纯合B-hB7-H4小鼠中种属特异性B7-H4的表达。取野生型小鼠(+/+)和纯合B-hB7-H4小鼠(H/H)的睾丸组织,用抗B7-H4抗体进行western blot分析。在野生型小鼠(+/+)中检测到小鼠B7-H4;人B7-H4只能在纯合B-hB7-H4小鼠(H/H)中检测到,而不能在野生型小鼠中检测到。抗B7-H4抗体在人和小鼠中与B7-H4发生交叉反应。
NO.04 脾脏中白细胞亚群分析
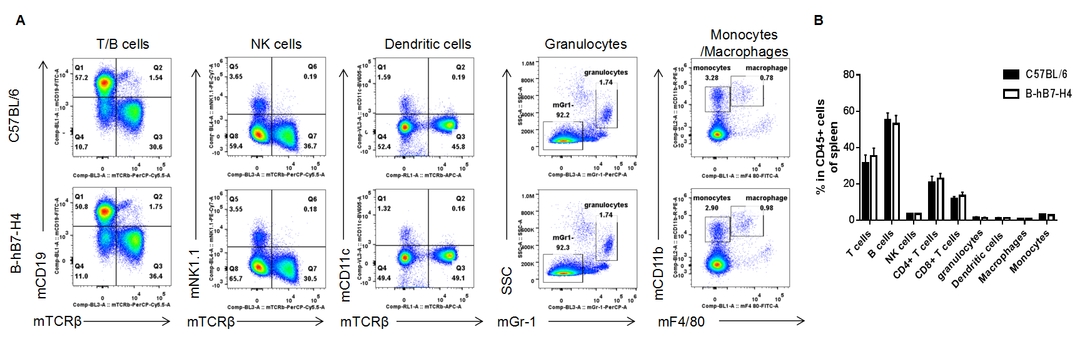
利用流式细胞术分析纯合B-hB7-H4小鼠和野生型小鼠脾脏中白细胞亚群(如图),结果显示纯合B-hB7-H4小鼠的白细胞亚群百分比与野生型小鼠相似,表明人源化B7-H4不会改变白细胞亚群在脾脏中的整体发育、分化或分布。
NO.05 脾脏中T细胞亚群分析
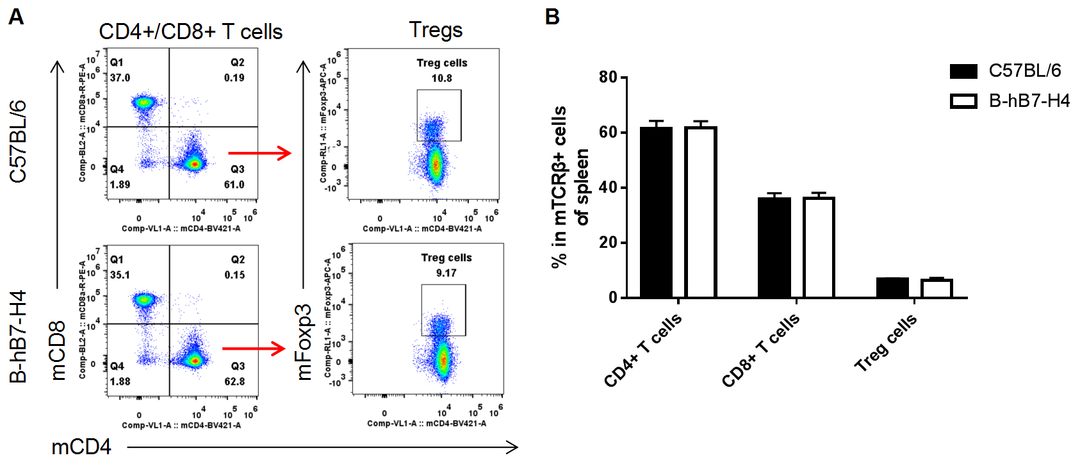
利用流式细胞术分析纯合B-hB7-H4小鼠和野生型小鼠脾脏中T细胞亚群(如图),结果显示纯合B-hB7-H4小鼠与野生型小鼠中各T细胞亚群的百分比相似,表明人源化B7-H4不会改变T细胞亚群在脾脏中的整体发育、分化或分布。
另外,实验表明人源化B7-H4亦不会改变白细胞亚群及T细胞亚群在淋巴结、外周血中的整体发育、分化或分布。
NO.06 体内药效
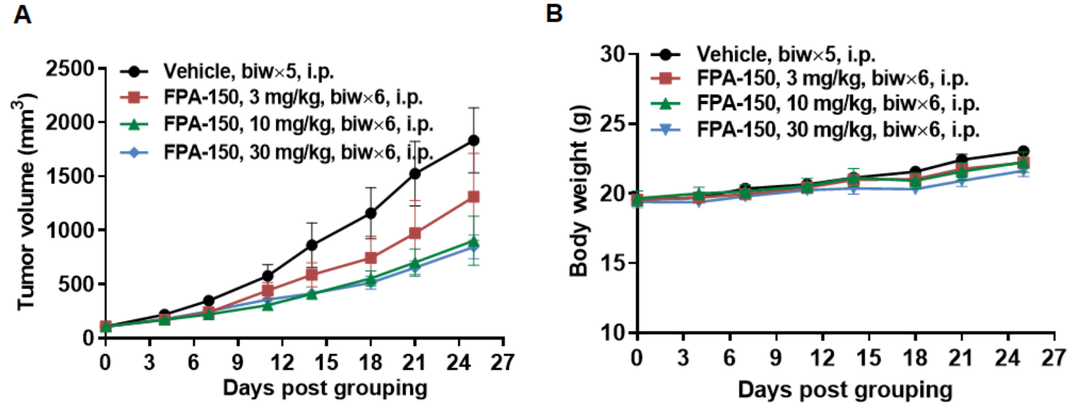
抗人B7-H4抗体在B-hB7-H4小鼠中的抗肿瘤活性。(A)在B-hB7-H4小鼠中,FPA-150(内部合成)抑制B-hB7-H4 MC38肿瘤生长。将B-hB7-H4 MC38细胞(3 × 106)皮下植入纯合B-hB7-H4小鼠(雌性,8周龄,n=6)。当肿瘤体积达到约100 mm3时,将小鼠分组,对小鼠进行FPA-150(内部合成)治疗。(B)治疗期间体重变化。如A图所示,抗人B7-H4抗体在B-hB7-H4小鼠体内能够有效控制肿瘤生长,表明B-hB7-H4小鼠为抗人B7-H4抗体的体内评价提供了一个强大的临床前模型。
BioMice百奥动物一直在追求创新、不断的探索,以期为广大科研工作者提供优质的小鼠模型,助力科学研究!如您有关注的靶点,欢迎联系我们,获取更多百奥动物产品信息~






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号