随着肿瘤领域ADC药物研发越来越活跃,许多新型的药物偶联方式及联用策略相继出现。比如小分子偶联药物(SMDC)、多肽偶联药物(PDC)、抗体免疫刺激偶联药物(ISAC)、抗体片段偶联药物(FDC)、抗体细胞偶联药物(ACC)、病毒样药物偶联物(VDC)等等。
ISAC (Immune-stimulating antibody conjugate) 是其中比较成功的药物偶联形式,主要通过三个步骤起作用,抗原识别、Fc介导的APC细胞内吞、APC细胞中TLR受体的激活[1];ISAC与ADC的区别在于:传统ADC由抗体+连接子+毒素三部分构成,而ISAC载荷为先天免疫激动剂或调节剂,与大分子抗体药物偶联后,ISAC既能激活固有免疫,又能介导获得性免疫,实现将“冷肿瘤”变为“热肿瘤”发挥更强的免疫作用。但是风险也相对较高,可能激活全身非特异性免疫反应,严重时发生细胞因子风暴危及生命。
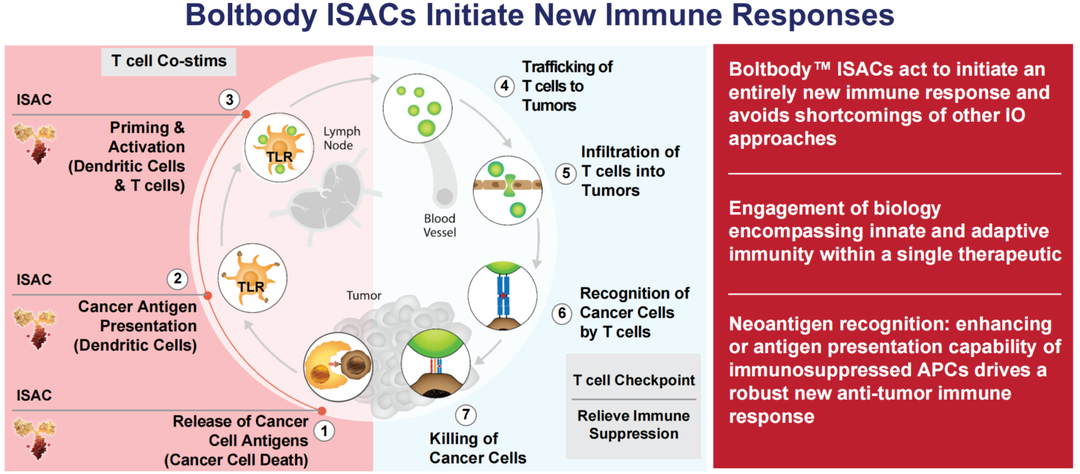
来源Bolt Therapeutics[2]
TLRs激动剂在当前IO疗法中具有潜在的治疗前景,是免疫治疗领域的研究热点之一,Toll样受体(Toll-like receptors,TLRs)是进化保守的先天免疫分子,同时也是连接先天免疫和适应性免疫的桥梁。人和小鼠共13种TLRs,其中TLR10为人独有,TLR11/12/13为小鼠独有。TLR1/2/4/5/6/11位于细胞膜表面,TLR3/7/8/9/13位于核内体(endosome)中[3]。
TLRs胞内下游信号传导激活主要依靠两类转录因子通路:NF-κB和IRFs (interferon-regulatory factors),其信号传导结果主要诱导产生促炎细胞因子;另外还能诱导产生I型干扰素(IFN)。
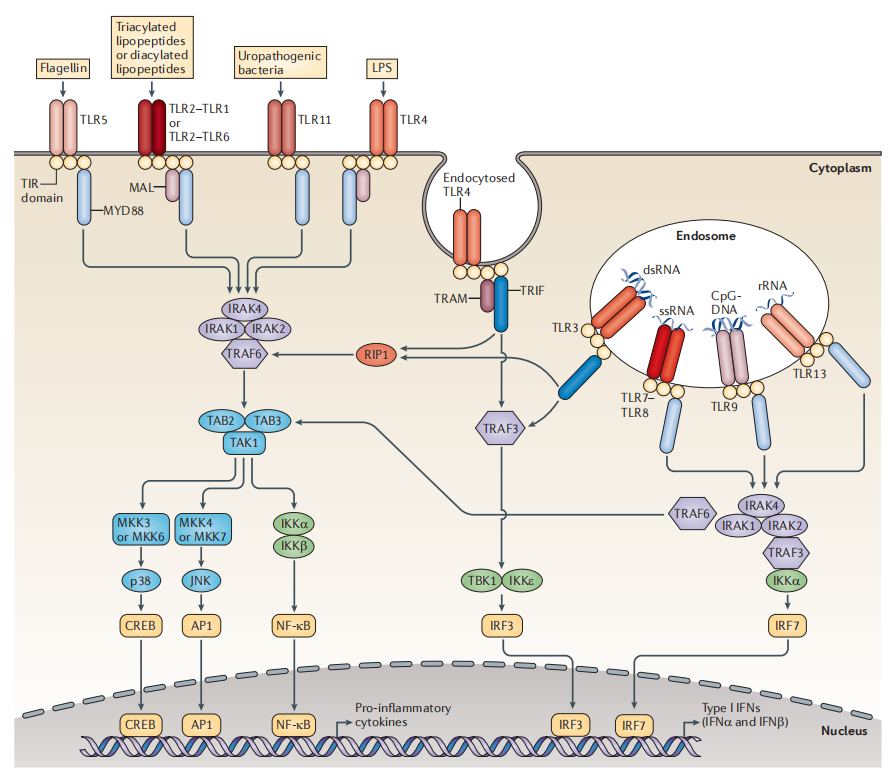
TLR信号通路[4]
关于靶向TLRs的药物发现已有几款药物上市,处在临床阶段的TLR7、TLR8和TLR9的研究进展相对较快。靶向TLRs药物与肿瘤疫苗、免疫检查点抑制剂等的联合疗法也将成为重要的研究方向。
表1. 部分药物研究进展
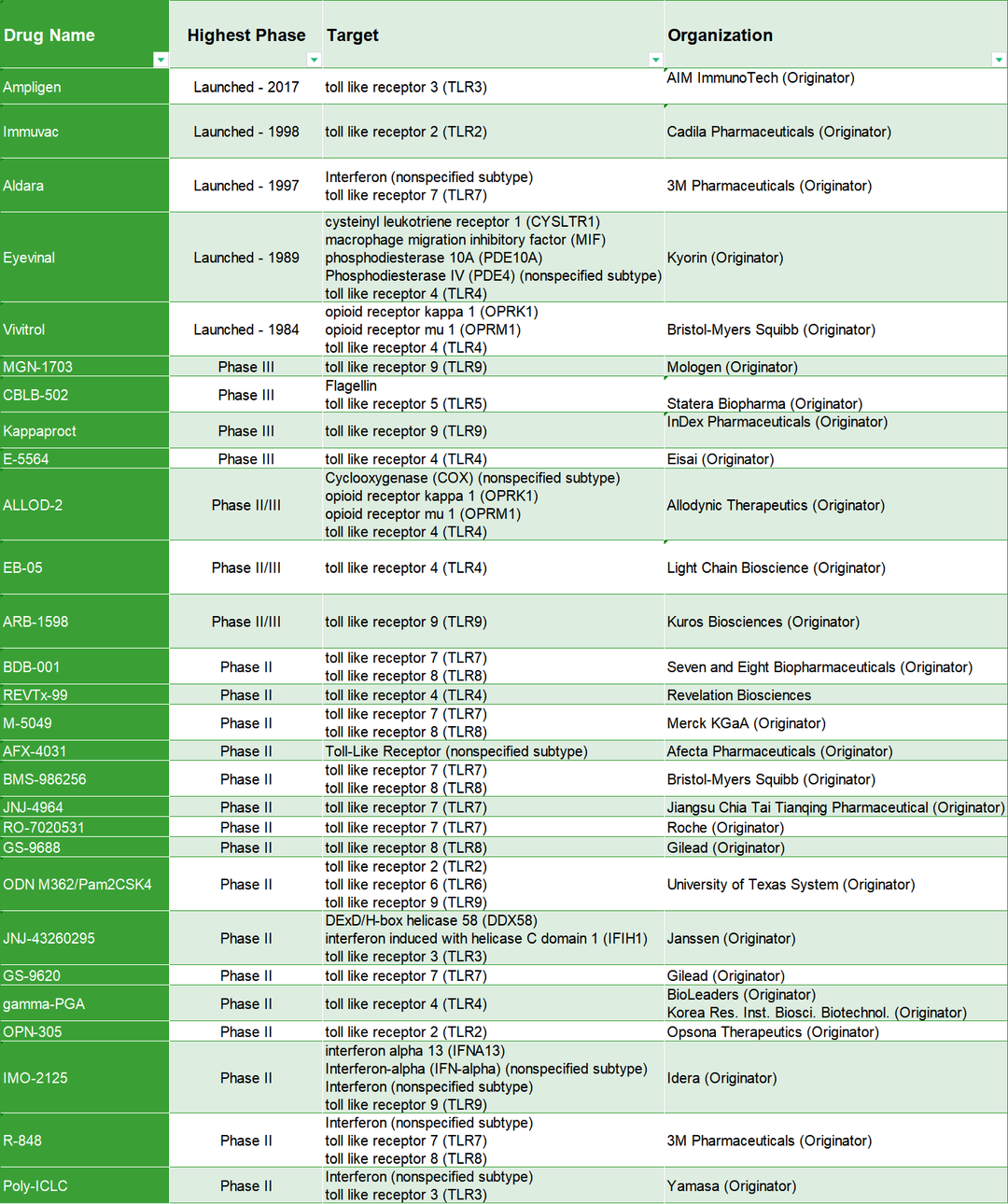
来源科睿唯安
去年12月InDex Pharmaceuticals公司宣布cobitolimod(Kappaproct,TLR9激动剂)进入三期临床,用于治疗中度至重度左侧溃疡性结肠炎(UC)患者,是一款首创的first in class新型抗炎药。该药可在大肠局部提供抗炎作用,诱导黏膜愈合,减轻UC的临床症状,临床上表现出了突出的疗效和安全性。
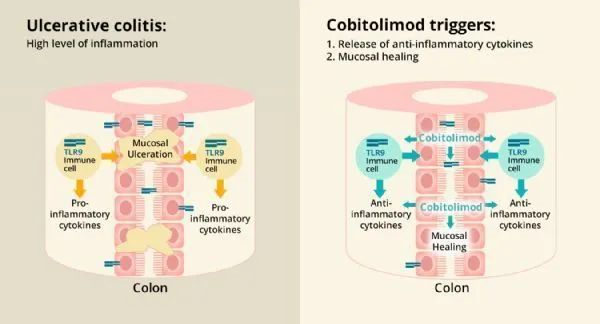
cobitolimod作用机制[5]
今年3月中国CDE公示了Merck Healthcare KGaA申报的enpatoran(M-5049)获批临床,适应症为系统性红斑狼疮(SLE)。enpatoran是一款潜在“first-in-class”口服TLR 7/8抑制剂,用于治疗皮肤型红斑狼疮和系统性红斑狼疮等适应症,目前海外处于II期临床。
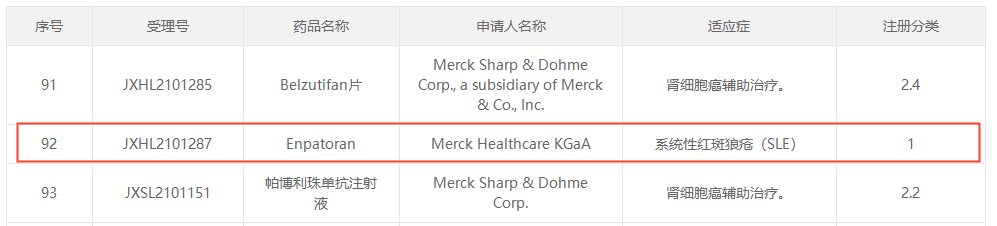
来自CDE官网[6]
临床进展不太顺利的是去年12月Bolt Therapeutics公司公布的免疫刺激新药BDC-1001的1/2期临床数据,在40例可评估患者中,总缓解率ORR仅为2.5%,疾病控制率DCR为32.5%,受此影响股价暴跌超一半。BDC-1001是由靶向HER2的曲妥珠单抗生物类似物通过连接子与TLR7/8双激动剂偶联,以治疗Her2阳性实体瘤。
同病相怜的还有Silverback Therapeutics的SBT6050的l/lb临床中期数据结果也表现欠佳,在14例可评估患者中,ORR仅为7%;SBT6050涉及的抗体也为HER2单抗,偶联TLR8激动剂。
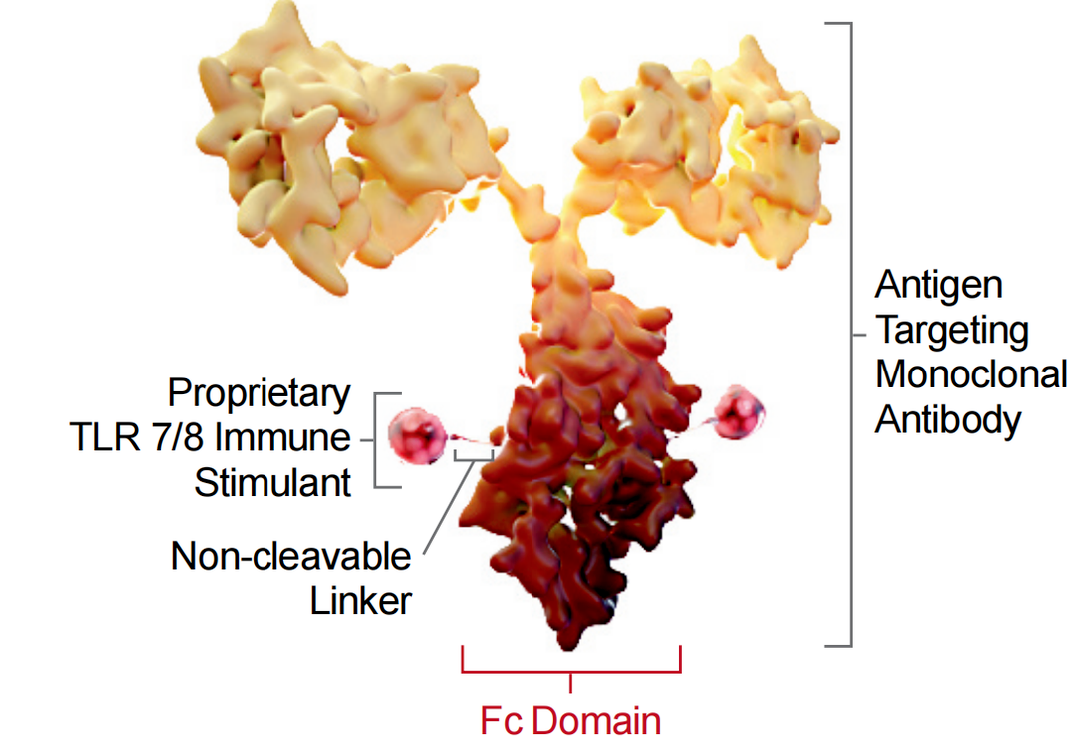
来源Bolt Therapeutics[2]
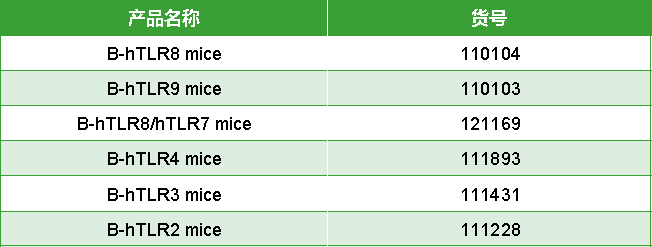
BioMice百奥动物自主开发人源化B-hTLR8 mice、B-hTLR9 mice助力临床前药物研究,更多TLRs人源化小鼠陆续发布。
B-hTLR8 mice
DC细胞中TLR8蛋白表达分析
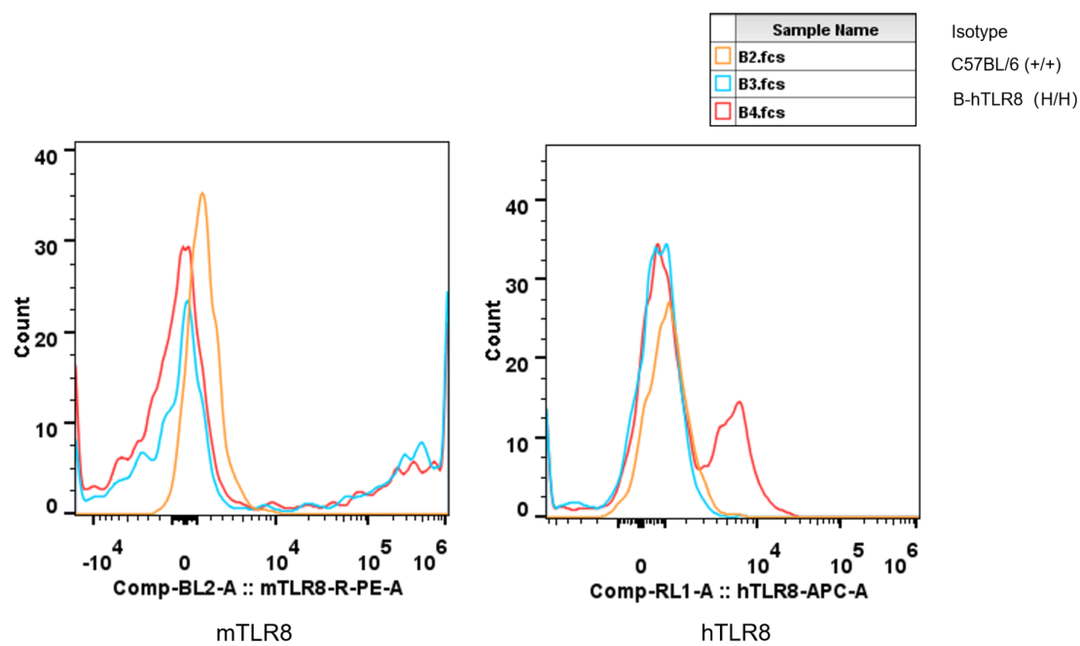
采集野生和纯合B-hTLR8 (H/H)小鼠的脾细胞,用种特异性抗TLR8抗体进行流式细胞术分析。由于抗小鼠TLR8抗体与人TLR8的交叉反应,在野生小鼠和纯合B-hTLR8中检测到小鼠TLR8。人TLR8仅能在纯合B-hTLR8中检测到,而不能在野生小鼠中检测到。
功能检测
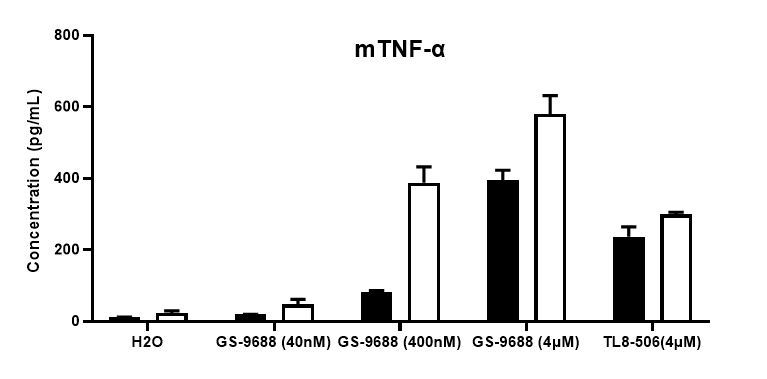
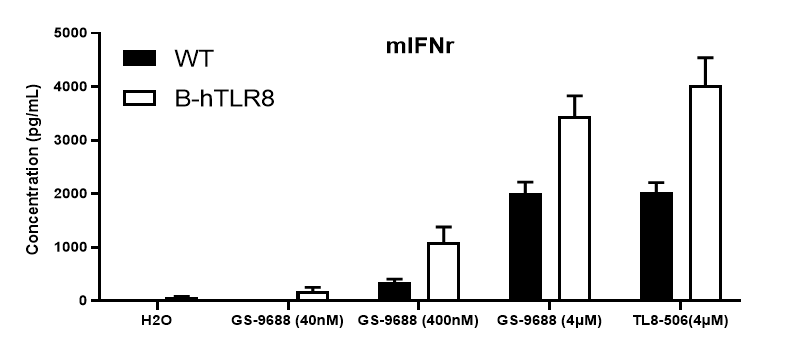
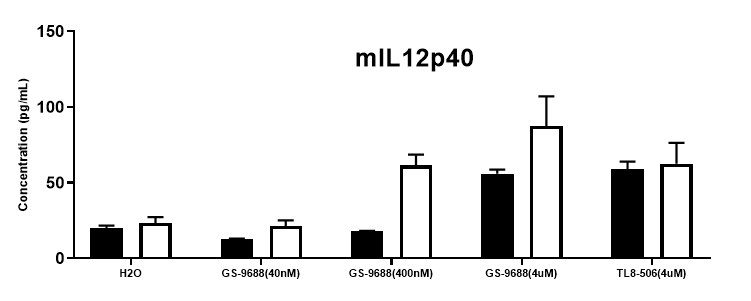
采集野生小鼠和TLR8激动剂TLR8-506和GS-9688 (Selgantolimod)刺激的纯合B-hTLR8 (H/H)小鼠脾细胞,用小鼠TNFα、IFNγ和IL12p40进行ELISA检测。与野生型相比,纯合B-hTLR8小鼠的TNFα、IFNγ和IL12p40分泌增加,这是由于B-hTLR8与人TLR8有选择性的高亲和力结合,并且刺激与GS-9688浓度呈剂量依赖性。
脾脏中白细胞亚群分析
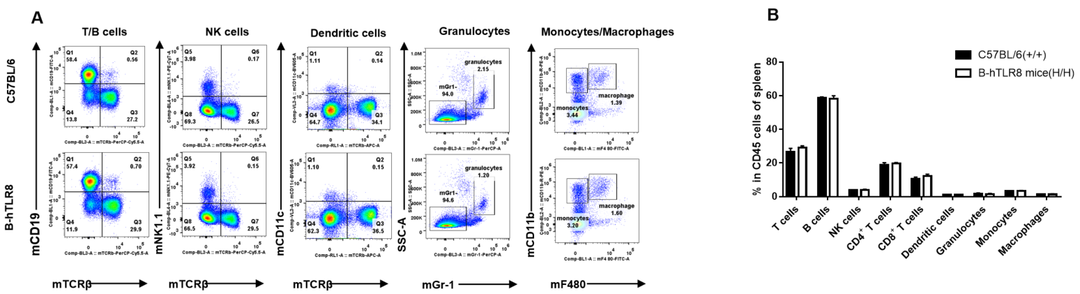
用流式细胞术分析从雌性C57BL/6和B-hTLR8小鼠(n= 3,6周龄)中分离的脾细胞以评估白细胞亚群。A.具有代表性的FACS图。B. FACS分析结果。纯合B- hTLR8小鼠的T细胞、B细胞、NK细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分比与C57BL/6小鼠相似,表明TLR8人源化不会改变这些细胞类型在脾脏的整体发育、分化或分布。
药效实验
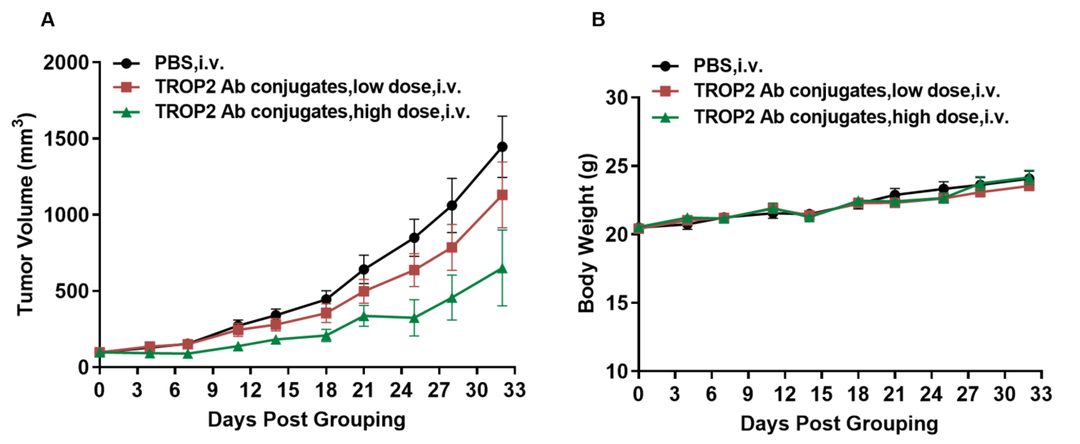
靶向TROP2的抗体偶联TLR8小分子激动剂药物抗肿瘤药效。(A)抗人TROP2抗体偶联TLR8小分子激动剂抑制B-hTLR8小鼠MC38肿瘤生长。小鼠结肠癌B-hTROP2 MC38细胞皮下接种到纯合B-hTLR8小鼠(雌性,9周龄,n=8)。小鼠按体重差异分组,分别用不同剂量的抗体偶联药物治疗。(B)治疗期间体重变化。如图A所示,抗人TROP2抗体偶联TLR8激动剂对B-hTLR8小鼠肿瘤生长的控制有效,表明B-hTLR8小鼠模型是临床前体内研究中评估抗体偶联TLR8激动剂的理想模型。
B-hTLR9 mice
B细胞中TLR9蛋白表达分析
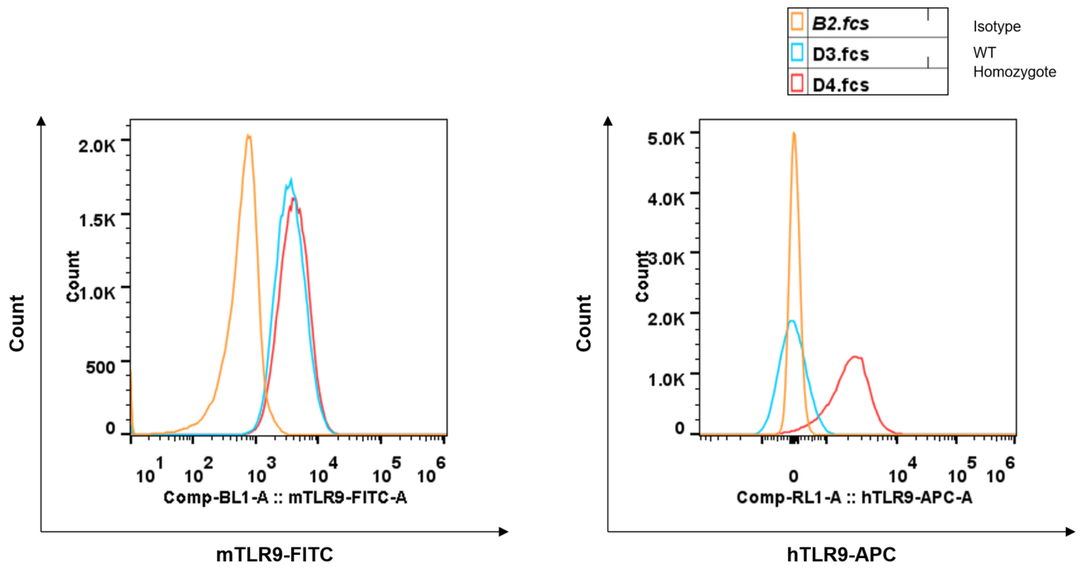
采集野生和纯合B-hTLR9(H/H)小鼠的脾细胞,用种特异性抗TLR9抗体进行流式细胞术分析。由于抗小鼠TLR9抗体与人TLR9的交叉反应,在野生小鼠和纯合B-hTLR9中检测到小鼠TLR9。人TLR9仅能在纯合B-hTLR9中检测到,而不能在野生小鼠中检测到。
功能检测
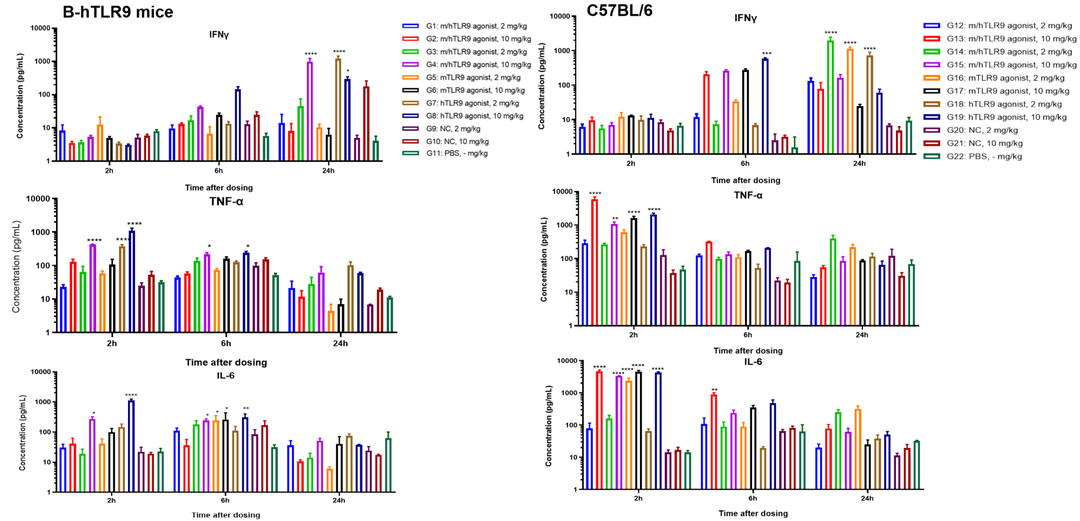
鼠TLR9选择性寡核苷酸仅在野生型C57BL/6小鼠中激活信号通路并增加IL-6、TNF-α、IFN-γ的表达,而在B-hTLR9小鼠中不激活。人/小鼠交叉反应寡聚物使纯合B-hTLR9小鼠和C57BL/6小鼠IL-6、TNF-α、IFN-γ的表达均能增加。B-hTLR9小鼠为抗体偶联TLR9寡核苷酸的体内评价提供了一个强有力的临床前模型。
表2. TLRs靶点人源化小鼠列表
参考资料
[1]. Immune-stimulating antibody conjugates elicit robust myeloid activation and durable antitumor immunity
[2]. https://www.boltbio.com/publications/
[3]. Janeway’s Immunology
[4]. The history of Toll-like receptors-redefining innate immunity
[5]. https://news.bioon.com/article/6793416.html
[6]. https://www.cde.org.cn/main/xxgk/listpage/369ac7cfeb67c6000c33f85e6f374044






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号