1895年埃尔里希博士在研究染料时意外发现,将染料通过静脉注入动物体内后,除了大脑外几乎所有器官都成功被染色。其他科学家于1900年也观察到了同一现象,并首次提出了 “血脑屏障”(Brain-blood barrier,简称“BBB”)的概念。
BBB通常只允许气体分子及相对分子质量较小的脂溶性分子通过,可以很好地维护脑内环境稳态,但也导致大部分治疗中枢神经系统药物(CNS drugs)无法穿过BBB 在脑内达到有效治疗浓度。因此深入研究血脑屏障上物质转运体,对寻找治疗中枢神经系统(central nervous system,CNS)疾病的新药物作用靶点具有重要的意义。目前学术界与制药界对于其结构、功能以及如何克服脑血屏障等方面都有着广泛而深入的研究。
基因简介
TFR1(TFRC,Transferrin receptor)编码的细胞表面受体,属于单次跨膜蛋白,人鼠同源性为74%,其在各种细胞中都有表达。主要通过结合转铁蛋白TF(Transferrin),将Fe离子转运进入细胞内,是细胞摄取铁的主要途径。
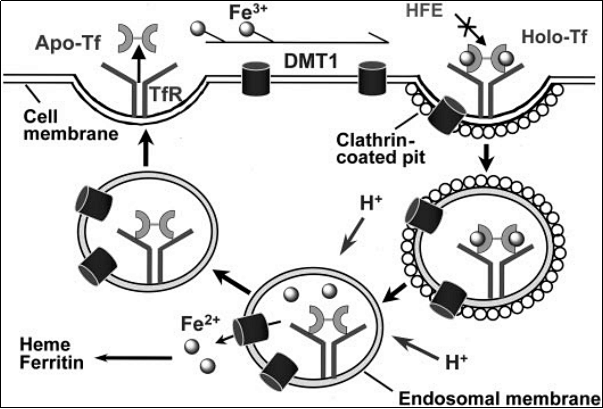
转铁蛋白和转铁蛋白受体 1 介导的细胞铁摄取循环
不同的转铁蛋白(holo-transferrin)与细胞表面的转铁蛋白受体 1 结合。通过质子泵的作用,产生的复合物被内化和酸化。随后铁从转铁蛋白中释放出来并通过二价金属转运蛋白 DMT1 转运出内体。HFE 似乎抑制转铁蛋白受体 1 内吞作用,可能是通过与转铁蛋白受体 1 结合。载脂蛋白转铁蛋白和转铁蛋白受体 1 都返回细胞表面,在中性 pH 下解离,并参与另一轮铁摄取循环。细胞内的铁要么结合到血红素中,要么储存在铁蛋白中。
这种有效的细胞摄取途径不仅可以转运抗癌药物和蛋白质,而且还可以将治疗基因转运到过度表达转铁蛋白受体的恶性肿瘤细胞中。可以通过将转铁蛋白与治疗药物、蛋白质以化学方式结合实现,或者通过将治疗性肽或蛋白质注入转铁蛋白结构中实现。所得偶联物显著提高了药物的细胞毒性和选择性。通过聚阳离子或脂质体将 DNA 与转铁蛋白偶联作为基因治疗病毒载体的潜在替代品。
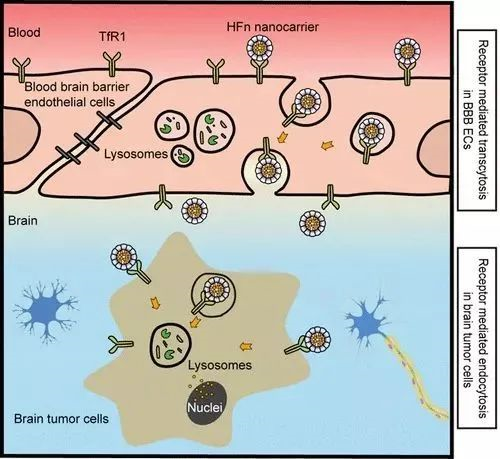
TFR1穿越血脑屏障[1]
目前针对TFR1的靶点药物主要有两个方向:作为TAA开发药物(某些恶性肿瘤如74%乳腺癌、76%肺腺癌和93%肺鳞状细胞癌高表达TFR1)、CAR-T;作为穿过血脑屏障向大脑定向运输大分子药物的“特洛伊木马”,对于阿尔兹海默症、溶酶体贮积症、脑癌等多种脑部疾病都具有重要意义。
基本信息

验证数据
百奥动物自主研发B-hTFR1 小鼠,是评估蛋白治疗药物对中枢神经系统(CNS)的有效递送的优质临床前实验动物模型。
01 mRNA表达分析
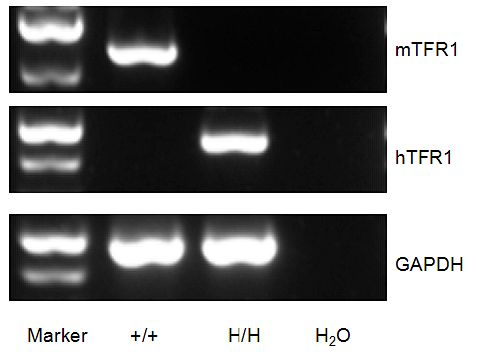
RT-PCR对野生型小鼠和B-hTFR1小鼠的TFR1基因表达进行种属特异性分析
小鼠Tfrc mRNA可以在野生型小鼠脾细胞中检测到。人TFRC mRNA仅在纯合子B-hTFR1小鼠中检测到,而在野生型小鼠中未检测到。
02 红细胞蛋白表达分析
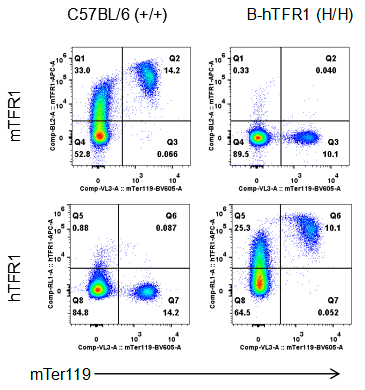
流式细胞术分析纯合B-hTFR1小鼠中TFR1表达
采集野生型(WT)小鼠和纯合子B-hTFR1小鼠的骨髓,采用种特异性抗TFR1抗体进行流式分析。小鼠TFR1在WT小鼠中检测到。人TFR1仅在纯合子B-hTFR1小鼠中检测到,而在WT小鼠中检测不到。
03 TFR1抗体的体内PK评价
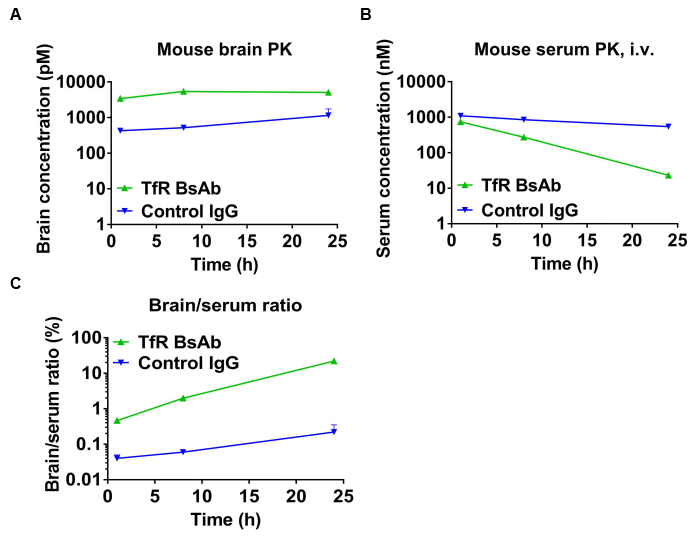
抗人TFR1双特异性抗体(BsAbs)的体内药代动力学(PK)评价
B-hTFR1小鼠经尾静脉注射对照IgG (10 mpk)和抗人TFR1 BsAbs (10.9 mpk)(均由客户提供),取脑、血清进行体内PK评价。量化抗人TFR1 BsAbs的脑浓度(A)、血清浓度(B)和脑-血清比(C)。如图所示,抗人TFR1 BsAbs在剂量后表现出更高的血清清除率和增强的脑暴露。研究结果证实,B-hTFR1小鼠的大脑能够摄取静脉注射的抗人TFR1 BsAbs,而B-hTFR1小鼠为在体内评估蛋白治疗药物对中枢神经系统(CNS)的有效传递提供了一个强有力的临床前模型。平均值±SEM。
参考文献
[1]Fan, Kelong,et al."Ferritin Nanocarrier Traverses the Blood Brain Barrier and Kills Glioma". ACS NANO 12.5 (2018) : 4105 - 4115.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号