为了能在小鼠体内验证人源化C5AR1抗体药的体内药效及毒性,百奥赛图开发了C5和C5AR1人源化小鼠( B-hC5AR1 mice,B-hC5/hC5AR1 mice),通过同源重组的方式分别将鼠的C5和C5ar1基因敲除并替换为人的C5和C5AR1基因。因为已有研究证实小鼠的C5a与人的C5AR1的亲和力类似[1],所以可以使用B-hC5AR1小鼠来评价抗人C5AR1抗体的体内药效;使用B-hC5/hC5AR1小鼠评价抗人C5或抗人C5AR1抗体的体内药效及毒性。
基因功能介绍
补体系统是天然免疫系统的一个重要组成部分,在许多保护性免疫进程中起到重要作用。但通过补体系统获益的同时,补体系统异常的激活(尤其是针对自体组织,而不是外来病原体)被认为是许多人类炎症疾病和自身免疫疾病的发病机制之一。补体系统具有三条激活途径,包括经典途径、凝集素途径和旁路途径。这三种途径最终都会产生C5,即C5是参与三条补体活化途径的固有成分,也是必经途径。C5可被C5转化酶裂解为小片段C5a和大片段C5b:C5a游离于液相,能够与其受体C5aR或C5L2结合发挥过敏毒素、趋化因子等活性;C5b可与C6结合为稳定的C5b6复合物,继而自发与C7、C8、C9结合为C5b-9复合物,也被称为攻膜复合物(MAC),如图1。正常状态下的血清中能检测到C5,C5主要累积部位为肝脏,主要由巨噬细胞、粒细胞和树突状细胞等细胞分泌产生。
C5AR1(补体C5a受体1)是一种经典的G蛋白偶联受体,主要在粒细胞、单核细胞、树突状细胞和多种肿瘤组织中的MDSCs(骨髓源性抑制细胞)上表达。MDSCs是一系列固有免疫细胞,这种异质性的未成熟细胞群在抑制T细胞的相关反应中起重要作用。在肿瘤发病过程中,C5a通过直接结合MDSCs表面的受体将MDSCs吸引到肿瘤部位,同时C5a还通过与其他类型的细胞结合,促进其释放细胞因子,从而吸引MDSCs迁移到肿瘤部位。肿瘤部位的MDSCs能促进肿瘤血管生成并提高致瘤细胞因子的浓度,还能抑制T细胞的活化和NK细胞的细胞毒性[2]。
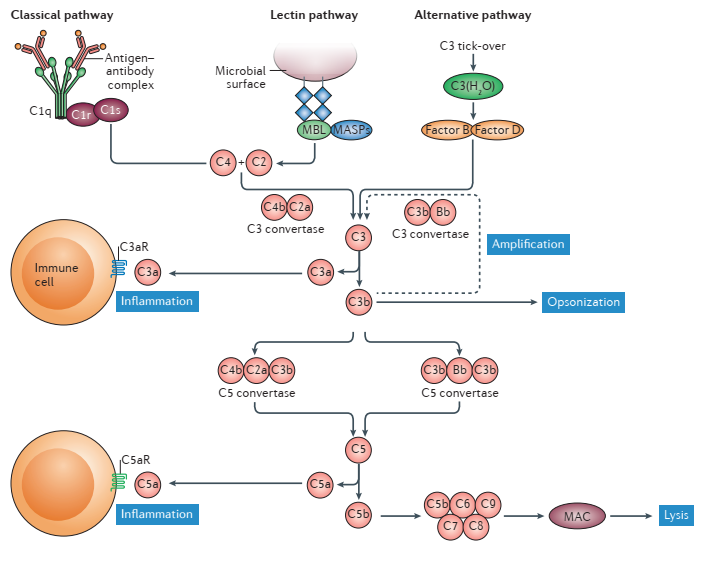
图1. 补体系统[3]
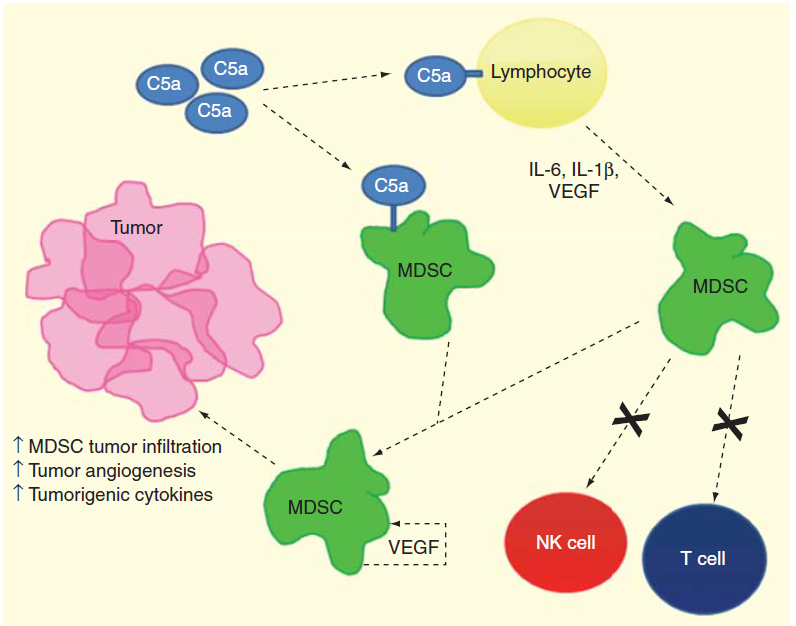
图2. C5a和MDSCs之间的相互作用[2]
B-hC5AR1 mice
基本信息

免疫细胞分型
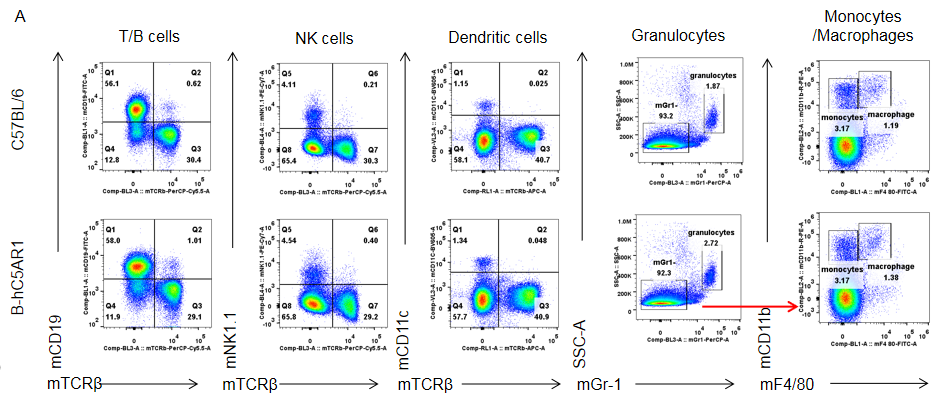
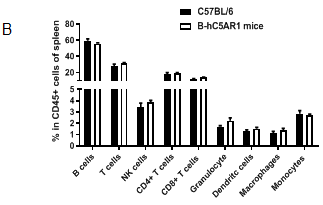
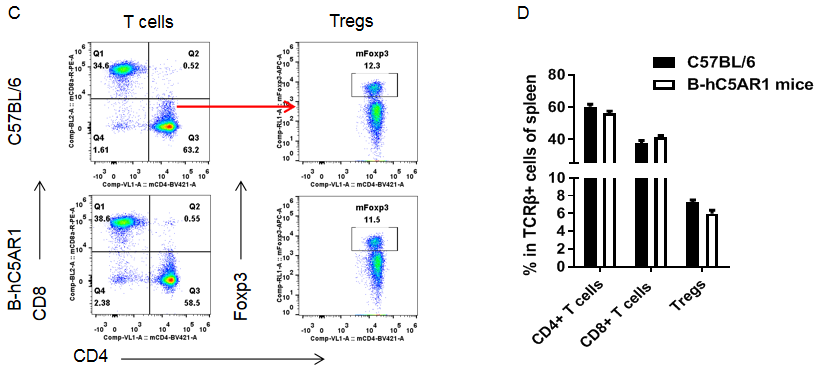
纯合B-hC5AR1小鼠脾中的各类型免疫细胞与野生鼠相比无差异。脾细胞来源于雌性野生型C57BL/6和纯合B-hC5AR1小鼠 (n=3, 7周龄),使用流式细胞术检测各类型免疫细胞的比例。(A,B) 各类型免疫细胞在CD45+细胞中的比例;(C,D) 3种T细胞亚型在CD3+细胞中的比例。结果显示:纯合B-hC5AR1 小鼠中T细胞、B细胞、NK细胞、树突状细胞、颗粒细胞、单核细胞、巨噬细胞、CD4+T细胞、CD8+T细胞和Treg细胞在脾细胞中的比例与野生鼠中细胞的比例类似。以上结果说明使用人源C5AR1基因替换鼠源基因没有改变脾中各类型免疫细胞的发育与分化。
我们还检测了淋巴结和血细胞中各类型免疫细胞的比例,结果也显示人源化小鼠与野生型小鼠无差异,数据未展示。
B-hC5/hC5AR1 mice
基本信息

蛋白表达检测
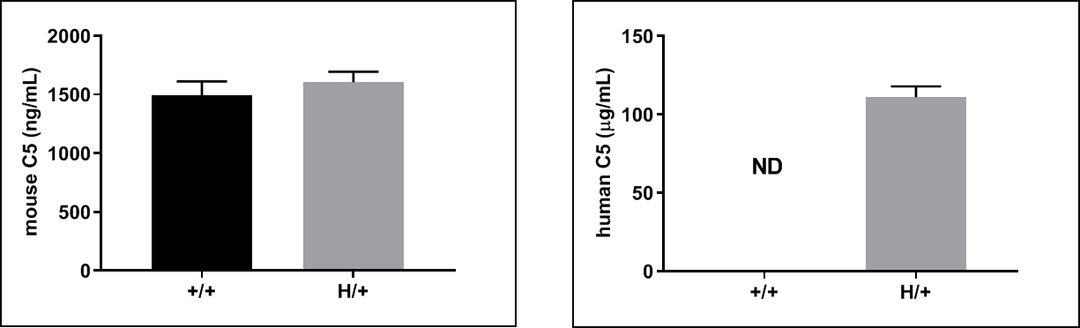
在杂合B-hC5/hC5AR1小鼠的血清中检测到人源C5蛋白的表达。分别收集野生型C57BL/6(+/+)和杂合B-hC5/hC5AR1(H/+)小鼠的血清,使用ELISA检测C5的表达。结果显示:在野生型小鼠的血清中只能检测到鼠源C5蛋白的表达;而在杂合B-hC5/hC5AR1小鼠中能检测到人源和鼠源C5蛋白的表达。
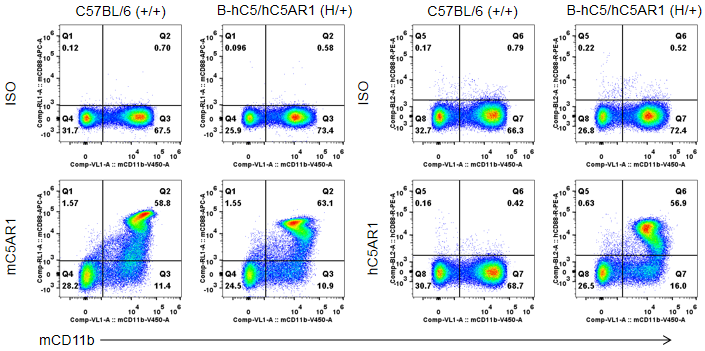
在杂合B-hC5/hC5AR1小鼠的骨髓中检测到人源C5AR1蛋白的表达。分别收集野生型C57BL/6(+/+)和杂合B-hC5/hC5AR1(H/+)小鼠的骨髓,使用流式细胞术检测C5AR1的表达。结果显示:在野生型小鼠的骨髓中只能检测到鼠源C5AR1蛋白的表达;而在杂合B-hC5/hC5AR1小鼠中能检测到人源和鼠源C5AR1蛋白的表达。
参考文献
[1] Guzman CB, Zhang XM, Liu R, et al. Treatment with LY2409021, aglucagon receptor antagonist, increases liver fat in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2017,19(11):1521-1528. DOI:10.1111/ dom.12958.
[2] O′Harte FP, Franklin ZJ, Irwin N. Two novel glucagon receptor antagonists prove effective therapeutic agents in high-fat-fed and obese diabetic mice [ J]. Diabetes Obes Metab, 2014, 16 ( 12): 1214-1222. DOI: 10.1111/ dom.12360.
[3] Trouw, L.A., Pickering, M.C. & Blom, A.M. The complement system as a potential therapeutic target in rheumatic disease. Nat Rev Rheumatol 13, 538-547 (2017).






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号