上一篇我们为各位看官介绍了可能影响小鼠实验结果的病原微生物之一肾细小病毒(保证试验准确性,杜绝小鼠细小病毒--MKPV),今天我们继续放大招,带你深入认识三种非常重要的菌类病原微生物--牛棒状杆菌、皮肤病原真菌、念珠状链杆菌。
无毛鼠“秃然”长“皮屑”?——牛棒状杆菌
PART.01
大家好,我是一只裸鼠,我最大的特点就一个字——“秃”,而且“秃”得很均匀,浑身上下没有毛。上有无毛猫,下有无毛鼠,我在鼠界也是个“贵族”。

裸鼠
万万没想到,一向注意个鼠卫生的我,居然最近疯长“皮屑”。看护我的Dr. Wang说是有一种叫“牛棒状杆菌(Corynebacterium bovis,C. bovis)”的家伙盯上我了,究竟是何方妖孽?为了拯救我的“贵族”形象,Dr. Wang对牛棒状杆菌进行了研究。

牛棒状杆菌是一种革兰氏阳性细菌,菌体短小,一端或两端膨大呈棒状,无荚膜,无鞭毛,不产生芽胞,多为条件致病菌,属于棒状杆菌科。该细菌的污染会导致裸鼠角化过度皮炎(鳞状皮肤病)[1] 且具有极强的传染性、超高的发病率和难以彻底清除的特性,使得动物设施管理者们头痛不已。
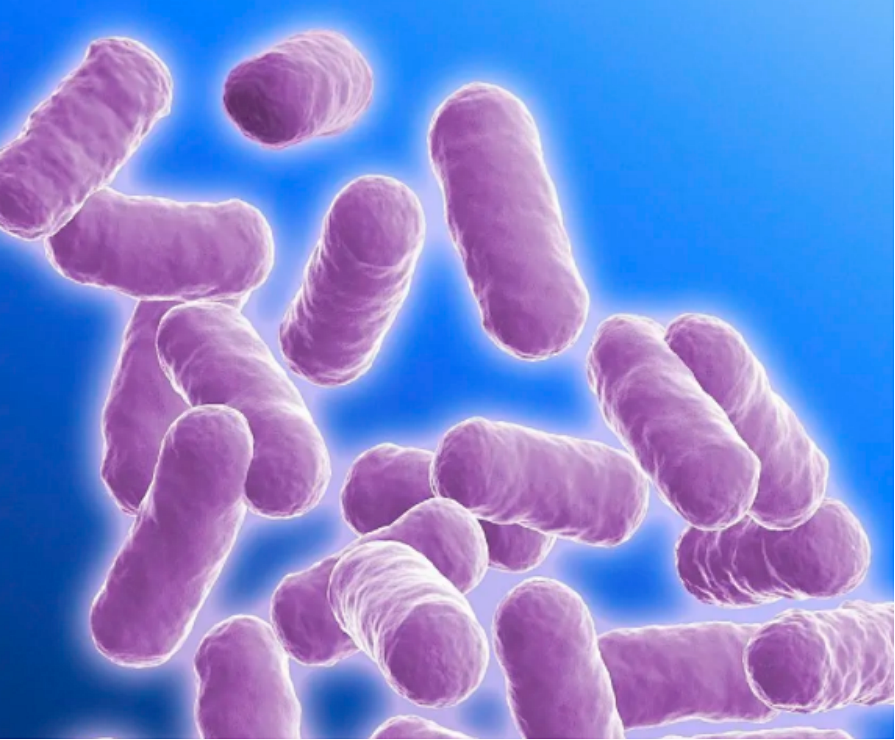
牛棒状杆菌[2]
临床症状
① 皮肤鳞状皮屑、脱水、身体状况持续下降;
② 皮肤的组织学发生改变,棘层增厚、角度过度、真皮内的炎性浸润;
③ 动物对受试药物的毒性更加敏感,耐受性变差,从而影响实验数据的准确性;
④ 严重影响异种移植的肿瘤生长,导致肿瘤生长缓慢、推迟甚至是停止生长;
⑤ 感染还会造成小鼠对化疗的敏感性增加[3]。
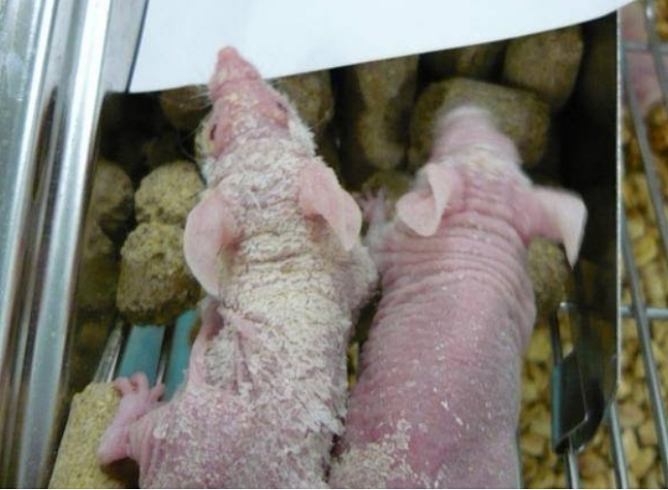
感染牛棒状杆菌的裸鼠[4]
传播途径
① 所有感染的小鼠,包括未表现出明显临床症状的小鼠都可以将细菌传播给其他小鼠;
② 牛棒状杆菌也可以在皮屑、物品表面长期停留,空气传播也是传播方式之一;
③ 发生感染的设施中,笼盒、地板表面、工作台、水槽、门把手、手套等都可能被污染,并成为传播媒介;
④ 感染了牛棒状杆菌的肿瘤细胞株或冻存的PDX组织也会成为它的潜在传播途径。
检测方法
①“鳞屑”的爆发是该病的信号,但要经培养法或PCR鉴定才能最终确定;
② 组织病理学也可作为辅助手段为诊断提供帮助。
防治措施
① 笼具、物料要严格的按照国标要求进行消毒后使用;
② 工作人员尽量不交叉处理各个房间内的动物,如果不得不同时进行两个以上的实验项目,则需保证先操作裸鼠品系,再操作其他品系;
③ 除了对动物房内进行消毒外,走廊、更衣室、缓冲间等都需进行彻底的消毒;
④ 对于包含裸鼠的实验项目,除了实验中日常观察的项目外,还需要增加对裸鼠皮屑的观察。
感染的小鼠如何处理
① 患病动物可以给予抗生素(该菌对四环素、恩诺沙星和氨苄西林敏感)治疗减少临床症状,同时使用碘液擦拭病变皮肤,每日1~2次[5];
② 牛棒状杆菌感染后不易彻底清除,对于常规品系发现牛棒感染建议全群扑杀,对于珍贵品系需通过胚胎移植或剖腹产手术进行净化。
认识不一样的皮肤病原真菌
PART.02
帅气逼人的小鼠头秃了,Tony Cai 也无法拯救的那种,不仅有圆形的断发斑,还有红肿和痂皮。这很有可能是实验动物感染了浅部的皮肤病原真菌,如果不严格管理和预防还会发生交叉感染,引起人畜共患的皮肤病。
分类及种属介绍
皮肤病原真菌分属三个属:小孢子菌属( Microsporum ) 、表皮癣菌属( Epidermonphyton )以及毛癣菌属( Trichophyton ),其中引起实验动物发病的约有 12种。其在实验动物中的感染及存在情况见表1[6]。

4种常见感染小鼠的皮肤病原真菌及临床症状
1、羊毛状小孢子菌病
感染主要表现为以下几种形式:
① 白癣:大多在头部,开始时为灰白色鳞屑斑,逐渐扩大。初发损害母斑,在母斑外围可能有后发的、小片圆形的损害称子斑。有时, 母子斑融合成大片灰白色的鳞屑斑,引起毛发松动,在距发根 2~4 mm 处折断,外围白套称菌鞘,具很强的传染性。
② 体癣:好发于颈部、躯干及上肢,表现为环形或同心圆形。损害数目多,但面积较小,炎症较严重,多水疱。
③ 脓癣:有脓疱,常破溃结痂。
2、石膏样小孢子菌病
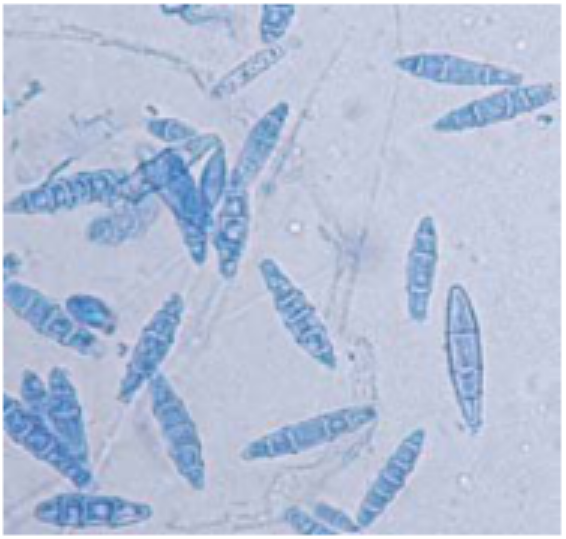
石膏样小孢子菌菌丝和孢子的显微特征(X400)[7]
感染后在皮肤上可引起强烈的炎症反应, 偶可产生黄癣痂样损害, 具有特殊的鼠尿臭味。也可引起毛发感染呈脓癣样表现。由此菌引起的体癣, 与羊毛状小孢子菌感染引起的体癣类似,鳞片较少,通常只有1~3片,炎症现象比较显著,除环状外,还可表现为湿疹样。
3、石膏样毛癣菌病
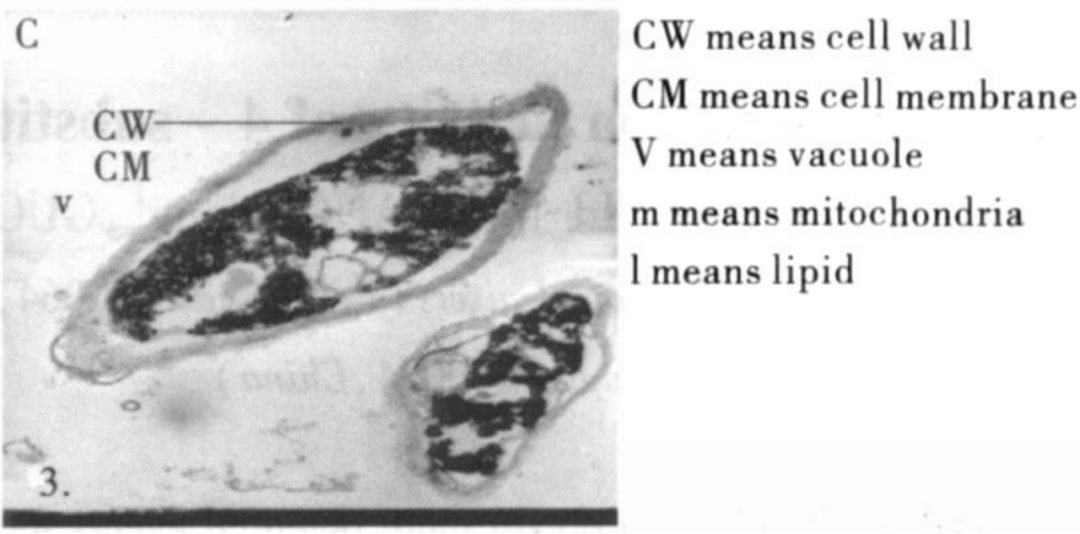
石膏样毛藓菌的超微结构[8]
本菌主要引起体股癣, 四肢癣, 头癣, 脓癣、须癣及皮肤肉芽肿性损害和癣菌疹。
① 体股癣:损害为环形或多环形,色红,常有较急性的炎症反应,中央皮肤正常,愈合倾向明显,无色素沉着,皮损直径较小,但数目较多,边缘。
② 脓癣:皮损化脓。本菌是脓癣的首位病原菌,约占50%左右。
③ 癣菌疹:有以下几种表现:苔藓样、荨麻疹样、丹毒疹样、水疱样。
④ 深部感染多引起脓肿和肉芽肿。
4、猴类毛癣菌
主要引起皮肤损害, 很少或不侵犯毛发。
传播途径
直接或间接接触无症状的带菌动物感染动物的皮肤损害、被污染的动物垫料、器具或空气、尘埃中及动物房表面的真菌而发生。只要感染动物存在以及在污染物上有活孢子存在,此病就可以传播。
检测方法
① 直接镜检法及培养法,菌种鉴定主要依据菌落形态和镜下特征, 同一种内不同的菌株菌落形态有较大的差异;但培养的假阴性率较高,而镜检存在不同程度的假阳性。
② PCR方法,基因型保守区相对表型稳定,能进行种间分型,同时可利用可变区进行种内的进一步分型;还能对病原菌核酸实时定量分析[9]。
预防措施
① 对新引进的动物进行皮肤病原真菌的严格筛选检测,确认健康合格后再入群;
② 做好环境卫生,动物房的环境和笼架应定期消毒;
③ 定期对动物进行监测 、淘汰阳性动物并做好环境消毒;
④ 建立洁净种群,可用于替换污染种群。
一“吻” 定终身,口咽内的隐形杀手 ——念珠状链杆菌
PART.03
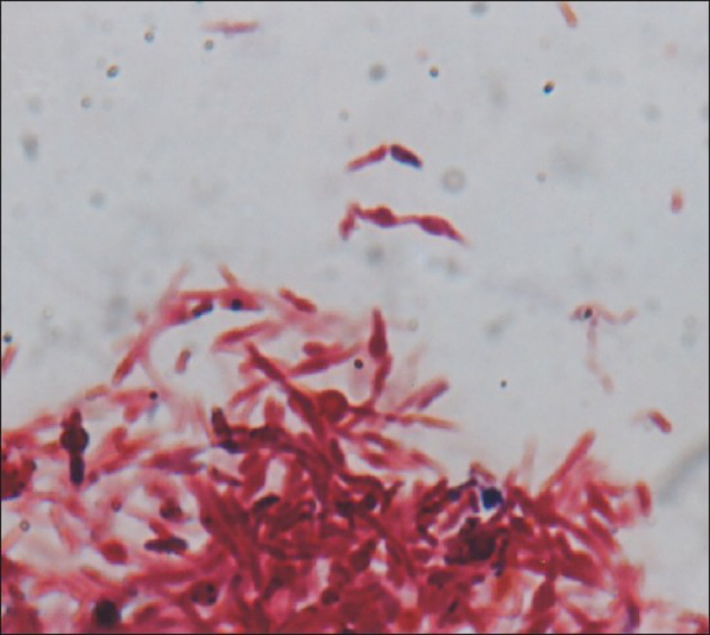
革兰氏染色呈伴有球根状或念珠状肿胀的阴性丝状杆菌(100×)[14]
鼠咬热的病原之一是念珠状链杆菌,也是一种人兽共患病。
Q:念珠状链杆菌主要发生在哪?
A:鼠咬热--啮齿动物口腔和咽部。
Q:这个病真的只是被鼠咬一下,然后仅仅发热一下吗?
A:NO!美国的WWMR期刊报道了在2003年、佛罗里达和华盛顿州各有一位女士发病后12小时内死亡,缺少诊断和治疗的时间。它可以引起暴发性脓毒症病引起发病患者迅速致命。
说起来这病还挺可怕呀。其实鼠咬热由两种病原引起,分别是小螺菌及念珠状链杆菌。两种病原引起的鼠咬热症状是有差异的,咱们这期的主角引起的症状恰好是较为严重的那个。
下面来正式认识一下念珠状链杆菌:
① 革兰阴性杆菌,大小为(0.3~0.5)µm ×(1.0~5.0)µm;
② 延长孵育时间镜下可见长达100~150µm的丝状体;
③ 单独存在的杆菌中央可膨胀,而长丝状菌体可呈现一系列的膨胀相连,出现像念珠状的长链;
④ 最后分裂成球杆形,也会自发变成L型;
⑤ 无芽胞、无荚膜。
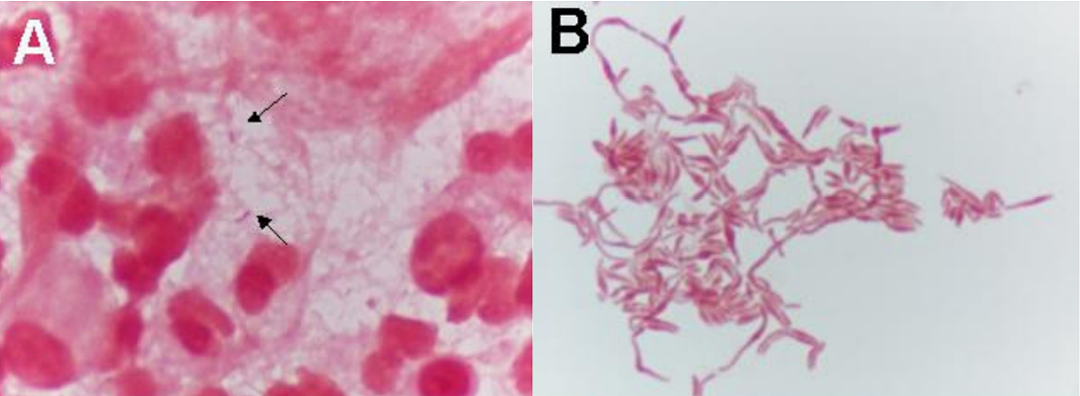
(A)滑膜液经革兰氏染色后呈阴性杆菌和多形性(1000×);(B)念株状链杆菌在传代培养后经革兰氏染色为伴有排列成链状和块状球状肿胀的革兰氏阴性杆菌[15]
临床症状
人工感染C57BL/6J小鼠可见败血症、淋巴结肿胀、多发性关节炎,四肢水肿、尾部淤血、紫绀、心脏肥大等症状。
传播途径
① 被感染啮齿动物咬伤;
② 通过污染水和食物使人患病,此时疾病的名称换了,叫做:哈弗里尔热。
检测方法
根据国标GB/T 14926.44-2001 《实验动物念珠状链杆菌检测方法》进行检测。
预防策略
① 避免动物咬伤及接触动物分泌物污染物品;
② 购买合格的动物。
看来,小鼠的生活环境、吃进口腔的食物等等样样都要按照标准要求来进行消毒和检测,不然病原细菌和真菌会影响小鼠健康,进而干扰了实验的准确性。还有更多实验动物病原微生物介绍敬请期待~
参考资料
[1] Manuel CA, Pugazhenthi U, Leszczynski JK. Surveillance of a ventilated rack system for Corynebacterium bovis by sampling exhaust-air manifolds[J]. J Am Assoc Lab Anim Sci, 2016, 55(1):58- 65.
[2]https://baike.baidu.com/item/%E6%A3%92%E7%8A%B6%E6%9D%86%E8%8F%8C%E5%B1%9E/8225101
[3] Scanziani E, Gobbi A, Crippa L, et al. Hyperkeratosis- associated coryneform infection in severe combined im-munodeficient mice[J]. Lab Anim, 1998, 32(3):330-336.
[4]https://www.dxy.cn/bbs/newweb/pc/post/21961231?keywords=牛棒状杆菌
[5] 白玉.牛棒状杆菌感染及其防治措施[A].实验动物科学.2015
[6] 范薇. 几种实验动物皮肤病原真菌及疾病[J].实验动物科学与管理, 2001,18(1):32-35.
[7] 马小平 叶娇等.大熊猫源石膏样小孢子菌培养条件的筛选[N].湖南农业大学学报(自然科学版),2017,43(2):180-186.
[8] 欧阳秋 等.瑞香狼毒对石膏样毛癣菌的抑制作用及对其超微结构的影响[J].华西医学杂志,2008,23(1):010- 012.
[9] 李筱芳 陈辉等.浅部真菌病临床标本致病菌DNA 提取方法的初步研究[J].医学研究杂志,2006,35(3):18-20.
[10] 李红. "念珠状链杆菌在小鼠群中的自然感染和发病特征的观察." 中国实验动物学报 000.002(1995):80-86.
[11] 龚震宇. 致命性鼠咬热(2003年,美国佛罗里达和华盛顿州)[J]. 疾病监测, 2005, 20(005):278.
[12] GB/T 14926.44-2001 《实验动物 念珠状链杆菌检测方法》
[13]《默沙东诊疗手册》
[14] De A S, Baveja S M, Salunke P M, Manglani M V. Isolation of Streptobacillus moniliformis from the blood of a child with acute lymphoblastic leukaemia. Indian J Med Microbiol 2010;28:387-9
[15] Wang, T.K., Wong, S.S. Streptobacillus moniliformis septic arthritis: a clinical entity distinct from rat-bite fever?. BMC Infect Dis 7, 56 (2007). https://doi.org/10.1186/1471-2334-7-56






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号